解题方法
1 . 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(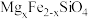 )。回答下列问题:
)。回答下列问题:
(1)基态Fe原子的价电子排布式为__________ 。橄榄石中,各元素电负性大小顺序为__________ ,铁的化合价为__________ 。
(2) 分子的空间结构(以
分子的空间结构(以 为中心)名称为
为中心)名称为__________ ,分子中氮原子的杂化轨道类型是__________ 。 原子核外有种不同运动状态的电子
原子核外有种不同运动状态的电子__________ 。
(3)由硅原子核形成的三种微粒,电子排布式分别为:① 、②
、② 、③
、③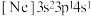 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。
(4)根据价层电子对互斥理论,NH3、 、
、 中,中心原子价层电子对数不同于其他两种粒子的是
中,中心原子价层电子对数不同于其他两种粒子的是___________ (填化学式); 与
与 中O-N-O的键角:
中O-N-O的键角: 
________  (填“<”、“>”、“=”),解释原因
(填“<”、“>”、“=”),解释原因__________ 。
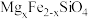 )。回答下列问题:
)。回答下列问题:(1)基态Fe原子的价电子排布式为
(2)
 分子的空间结构(以
分子的空间结构(以 为中心)名称为
为中心)名称为 原子核外有种不同运动状态的电子
原子核外有种不同运动状态的电子(3)由硅原子核形成的三种微粒,电子排布式分别为:①
 、②
、② 、③
、③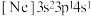 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。| A.微粒半径:③>①>② |
| B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ |
| D.得电子能力:①>② |
 、
、 中,中心原子价层电子对数不同于其他两种粒子的是
中,中心原子价层电子对数不同于其他两种粒子的是 与
与 中O-N-O的键角:
中O-N-O的键角: 
 (填“<”、“>”、“=”),解释原因
(填“<”、“>”、“=”),解释原因
您最近一年使用:0次
名校
解题方法
2 . 我国科研工作者发现并制备了一系列主要由 、
、 、
、 等元素组成的导电材料。回答下列问题:
等元素组成的导电材料。回答下列问题:
(1) 三种元素中,电负性最小的元素名称是
三种元素中,电负性最小的元素名称是___________ ;沸点:
___________  (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(2)肼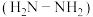 分子中孤电子对与
分子中孤电子对与 键的数目之比为
键的数目之比为___________ ,肼的相对分子质量与乙烯接近,但沸点远高于乙烯的原因是___________ 。
(3)正硝酸钠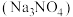 是一种重要的化工原料。
是一种重要的化工原料。 阴离子的空间结构为
阴离子的空间结构为___________ 形,其中心原子杂化方式为___________ 杂化。
(4)制备 的反应为
的反应为 。上述化学方程式中非金属元素电负性由大到小的顺序是
。上述化学方程式中非金属元素电负性由大到小的顺序是___________  用元素符号表示
用元素符号表示 。
。
 、
、 、
、 等元素组成的导电材料。回答下列问题:
等元素组成的导电材料。回答下列问题:(1)
 三种元素中,电负性最小的元素名称是
三种元素中,电负性最小的元素名称是
 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。(2)肼
 分子中孤电子对与
分子中孤电子对与 键的数目之比为
键的数目之比为(3)正硝酸钠
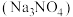 是一种重要的化工原料。
是一种重要的化工原料。 阴离子的空间结构为
阴离子的空间结构为(4)制备
 的反应为
的反应为 。上述化学方程式中非金属元素电负性由大到小的顺序是
。上述化学方程式中非金属元素电负性由大到小的顺序是 用元素符号表示
用元素符号表示 。
。
您最近一年使用:0次
名校
解题方法
3 . 碳是地球上组成生命的最基本元素之一、不仅能形成丰富多彩的有机化合物,还能形成多种无机化合物,碳及其化合物的用途广泛。根据要求回答下列问题:
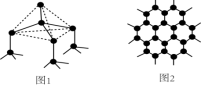
(1)下图中分别代表了碳单质的两种常见晶体,图1晶体中C原子的杂化方式为___________ ,图2晶体中,每个六元环占有___________ 个 C原子。 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为___________ 。
(3)丙炔(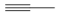 )分子中π键、σ键数目之比为
)分子中π键、σ键数目之比为___________ 。
(4)g-C3N4具有和石墨相似的层状结构,其中一种二维平面结构如下图(左)所示,用硅原子替换氮化碳的部分碳原子可形成具有相似性质的化合物如下图(右)所示,该化合物的化学式为___________ ,该化合物中所有元素的电负性由大到小的顺序为 ___________ 。___________ 个手性碳原子。
(1)下图中分别代表了碳单质的两种常见晶体,图1晶体中C原子的杂化方式为
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为(3)丙炔(
 )分子中π键、σ键数目之比为
)分子中π键、σ键数目之比为(4)g-C3N4具有和石墨相似的层状结构,其中一种二维平面结构如下图(左)所示,用硅原子替换氮化碳的部分碳原子可形成具有相似性质的化合物如下图(右)所示,该化合物的化学式为
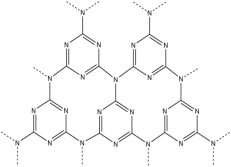
您最近一年使用:0次
4 . 短周期元素在自然界中比较常见,它们的化合物及其合金在社会生活中有着很重要的作用。请回答下列问题:
(1)硫代硫酸盐可用作浸金试剂。硫代硫酸根( )可看作是
)可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。
①基态O原子的核外电子中,两种自旋状态的电子数之比为________ 。 的空间结构是
的空间结构是________ 。
②浸金时, 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成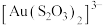 。分别判断
。分别判断 中的中心S原子和端基S原子能否做配位原子并说明理由:
中的中心S原子和端基S原子能否做配位原子并说明理由:_______ 。
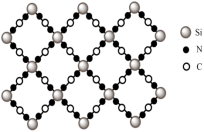
(2)一定条件下,将F插入石墨层间可得到具有润滑性的层状结构化合物 ,其单层局部结构如图所示:
,其单层局部结构如图所示: 中C原子的杂化方式为
中C原子的杂化方式为________ ,与石墨相比, 的导电性将
的导电性将________ ,原因是________ 。

(3)①呋喃(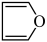 )和吡咯(
)和吡咯(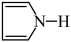 )均是重要化工原料,请解释呋喃沸点低于吡咯沸点的原因
)均是重要化工原料,请解释呋喃沸点低于吡咯沸点的原因_____ 。
②卤代乙酸可增强乙酸的酸性,则酸性:三氯乙酸( )
)___ 三氟乙酸( )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。
(4)Mg-Fe合金是当前储氢密度最高的储氢材料之一,其晶胞结构如图所示。
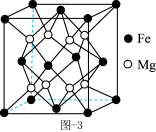
①距离Fe原子最近的Mg原子个数是_______ 。
②若该晶胞的棱长为a pm,阿伏加德罗常数的值为 ,则该合金的密度为
,则该合金的密度为______  。
。
(1)硫代硫酸盐可用作浸金试剂。硫代硫酸根(
 )可看作是
)可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。①基态O原子的核外电子中,两种自旋状态的电子数之比为
 的空间结构是
的空间结构是②浸金时,
 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成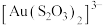 。分别判断
。分别判断 中的中心S原子和端基S原子能否做配位原子并说明理由:
中的中心S原子和端基S原子能否做配位原子并说明理由:(2)一定条件下,将F插入石墨层间可得到具有润滑性的层状结构化合物
 ,其单层局部结构如图所示:
,其单层局部结构如图所示: 中C原子的杂化方式为
中C原子的杂化方式为 的导电性将
的导电性将
(3)①呋喃(
 )和吡咯(
)和吡咯( )均是重要化工原料,请解释呋喃沸点低于吡咯沸点的原因
)均是重要化工原料,请解释呋喃沸点低于吡咯沸点的原因②卤代乙酸可增强乙酸的酸性,则酸性:三氯乙酸(
 )
) )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。(4)Mg-Fe合金是当前储氢密度最高的储氢材料之一,其晶胞结构如图所示。

①距离Fe原子最近的Mg原子个数是
②若该晶胞的棱长为a pm,阿伏加德罗常数的值为
 ,则该合金的密度为
,则该合金的密度为 。
。
您最近一年使用:0次
5 .  在实验、医疗、化工等方面有广泛的应用。酸性高锰酸钾溶液可与
在实验、医疗、化工等方面有广泛的应用。酸性高锰酸钾溶液可与 反应,其化学方程式是
反应,其化学方程式是 。已知:稀
。已知:稀 溶液几乎无色。
溶液几乎无色。
(1)X的化学式是___________ 。
(2)用双线桥法标出,上述反应中电子转移的方向和数目___________ 。
(3)上述反应中的还原剂为___________ (填化学式),被还原的元素是___________ (填元素符号)。
(4)向酸性 溶液中滴入过量双氧水,观察到的现象是
溶液中滴入过量双氧水,观察到的现象是___________ ,反应后溶液的pH___________ (填“增大”“减小”或“不变”)。
(5)0.2mol 参加上述反应,转移电子
参加上述反应,转移电子___________ mol。
 在实验、医疗、化工等方面有广泛的应用。酸性高锰酸钾溶液可与
在实验、医疗、化工等方面有广泛的应用。酸性高锰酸钾溶液可与 反应,其化学方程式是
反应,其化学方程式是 。已知:稀
。已知:稀 溶液几乎无色。
溶液几乎无色。(1)X的化学式是
(2)用双线桥法标出,上述反应中电子转移的方向和数目
(3)上述反应中的还原剂为
(4)向酸性
 溶液中滴入过量双氧水,观察到的现象是
溶液中滴入过量双氧水,观察到的现象是(5)0.2mol
 参加上述反应,转移电子
参加上述反应,转移电子
您最近一年使用:0次
6 . 现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100mL)。
I.实验步骤
(1)用_______ (填仪器名称)量取10.00mL市售白醋,在烧杯中用水稀释后转移到100mL_______ (填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴_______ 作指示剂。
(3)读取盛装0.1000mol·L-1NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为_______ mL。

(4)滴定。当_______ 时,停止滴定,并记录NaOH溶液的最终读数。重复滴定4次。
II.实验记录
III.数据处理与讨论
(5)数据处理,可得c(市售白醋)=_______ mol·L-1;市售白醋总酸量为_______ g/100mL。(结果保留四位有效数字)
(6)在本实验的滴定过程中,下列操作会使实验结果偏高的是_______(填字母)。
I.实验步骤
(1)用
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴
(3)读取盛装0.1000mol·L-1NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为

(4)滴定。当
II.实验记录
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V消耗(NaOH)/mL | 15.95 | 15.00 | 15.05 | 14.95 |
(5)数据处理,可得c(市售白醋)=
(6)在本实验的滴定过程中,下列操作会使实验结果偏高的是_______(填字母)。
| A.碱式滴定管在滴定时未用NaOH标准溶液润洗 |
| B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失 |
| C.锥形瓶中加入待测白醋溶液后,再加少量水 |
| D.锥形瓶在滴定时剧烈摇动,有少量液体溅出 |
您最近一年使用:0次
解题方法
7 . 依据醋酸的性质,请回答下列问题(以下讨论均在常温时)。
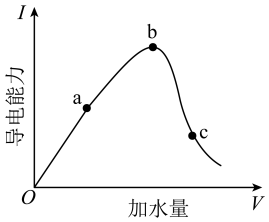
(1)取 (冰醋酸)作导电性实验,稀释过程中溶液的导电能力变化如下图所示。
(冰醋酸)作导电性实验,稀释过程中溶液的导电能力变化如下图所示。
① 的电离方程式是
的电离方程式是_______ 。
②a、b、c三点中 最小的是
最小的是_______ ,电离程度最大的是_______ 。
③在稀释过程中,
_______ (填“先怎么变后怎么变”)。
(2)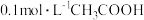 溶液的
溶液的 ,该溶液中由水电离出的
,该溶液中由水电离出的 浓度是
浓度是_______  。
。
(3)向相同的两密闭容器中加入0.05g镁条,分别注入 盐酸、
盐酸、 醋酸,测得容器内压强随时间变化如下图所示。
醋酸,测得容器内压强随时间变化如下图所示。
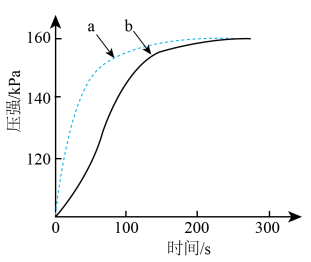
①反应为醋酸的曲线是_______ (填字母)。
②反应开始时反应速率 的原因是
的原因是_______ 。
(1)取
 (冰醋酸)作导电性实验,稀释过程中溶液的导电能力变化如下图所示。
(冰醋酸)作导电性实验,稀释过程中溶液的导电能力变化如下图所示。
①
 的电离方程式是
的电离方程式是②a、b、c三点中
 最小的是
最小的是③在稀释过程中,

(2)
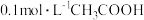 溶液的
溶液的 ,该溶液中由水电离出的
,该溶液中由水电离出的 浓度是
浓度是 。
。(3)向相同的两密闭容器中加入0.05g镁条,分别注入
 盐酸、
盐酸、 醋酸,测得容器内压强随时间变化如下图所示。
醋酸,测得容器内压强随时间变化如下图所示。
①反应为醋酸的曲线是
②反应开始时反应速率
 的原因是
的原因是
您最近一年使用:0次
名校
解题方法
8 . 氮是生命体重要的组成元素,自然界中氮的循环对生命活动有重要意义。
(1)汽车尾气主要含有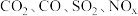 等物质,这种尾气逐渐成为城市空气污染的主要来源之一、其中的
等物质,这种尾气逐渐成为城市空气污染的主要来源之一、其中的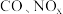 ,在适宜条件下会转化为参与大气循环的两种无毒气体,该过程的化学反应方程式为
,在适宜条件下会转化为参与大气循环的两种无毒气体,该过程的化学反应方程式为___________ 。
(2)“价-类”二维图是学习元素化合物性质的重要方法,利用所学知识能更好地了解氮的循环。___________ ;丙为钠盐,其化学式为__________ 。
②甲为常见的碱性气体,是制造氮肥、炸药等物质的化工原料。实验室制备甲的化学方程式为________ 。实验室用该反应原理制取并收集一瓶干燥的甲气体,从下图中选择合适的装置,其连接顺序为___________ 。(按从左到右的气流方向,用小写字母 和箭头表示)___________ (填字母)。
A. B.
B. C.
C. D.
D.
④丁主要用于染料、医药、印染、漂白等方面,且丁的焰色反应呈黄色。丁在酸性条件下,与 按物质的量
按物质的量 恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式
恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式___________ 。
(3)海洋生物参与氮循环的过程如图所示(其它含氨物质不参与反应)。___________ 种价态。反应③和⑤中,若生成等物质的量的 ,则转移的电子数之比为
,则转移的电子数之比为___________ 。
(1)汽车尾气主要含有
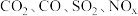 等物质,这种尾气逐渐成为城市空气污染的主要来源之一、其中的
等物质,这种尾气逐渐成为城市空气污染的主要来源之一、其中的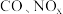 ,在适宜条件下会转化为参与大气循环的两种无毒气体,该过程的化学反应方程式为
,在适宜条件下会转化为参与大气循环的两种无毒气体,该过程的化学反应方程式为(2)“价-类”二维图是学习元素化合物性质的重要方法,利用所学知识能更好地了解氮的循环。

②甲为常见的碱性气体,是制造氮肥、炸药等物质的化工原料。实验室制备甲的化学方程式为

A.
 B.
B. C.
C. D.
D.
④丁主要用于染料、医药、印染、漂白等方面,且丁的焰色反应呈黄色。丁在酸性条件下,与
 按物质的量
按物质的量 恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式
恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式(3)海洋生物参与氮循环的过程如图所示(其它含氨物质不参与反应)。
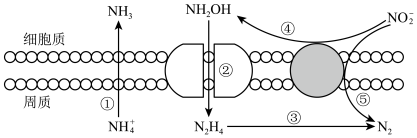
 ,则转移的电子数之比为
,则转移的电子数之比为
您最近一年使用:0次
2024-02-21更新
|
740次组卷
|
2卷引用:四川省达州外国语学校2023-2024学年高一下学期3月月考化学试题
9 . 现有下列物质:①Na ②洁厕灵(主要成分为稀盐酸) ③NaOH溶液 ④“84”消毒液(主要成分为NaClO) ⑤ ⑥
⑥
(1)上述为电解质的是___________ (填序号),其电离方程式为___________ 。
(2)实验室通常将①保存在___________ 中,其在氧气中燃烧的化学方程式为___________ 。
(3)日常生活中②与④不能混合使用,请分析原因___________ 。
(4)向⑥的溶液中逐滴加入③的实验现象为___________ ,写出其中涉及的氧化还原反应的化学方程式___________ 。
 ⑥
⑥
(1)上述为电解质的是
(2)实验室通常将①保存在
(3)日常生活中②与④不能混合使用,请分析原因
(4)向⑥的溶液中逐滴加入③的实验现象为
您最近一年使用:0次
解题方法
10 . 自然界中含硫物质不断发生转化和转移,形成了硫元素的循环。利用这些转化可以制备重要的化工产品,过程中产生的 等会污染环境,需要加以治理。
等会污染环境,需要加以治理。
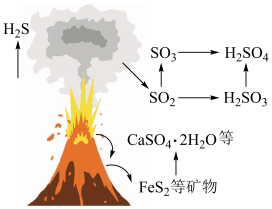
(1)火山喷发是硫元素在自然界中转化的一种途径,反应过程如图所示。 的结构式为
的结构式为___________ 。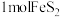 与
与 和
和 溶液反应转化为
溶液反应转化为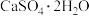 和
和 ,理论上转移电子的物质的量为
,理论上转移电子的物质的量为___________  。
。
(2)工业上利用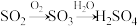 的转化制备硫酸,其模拟实验的部分装置如图所示。
的转化制备硫酸,其模拟实验的部分装置如图所示。___________ (写出两点)。
②装置Ⅲ用于吸收 制备硫酸,适宜的吸收剂是
制备硫酸,适宜的吸收剂是___________ (填字母)。
A. 溶液 B.水 C.
溶液 B.水 C. 浓硫酸
浓硫酸
③装置Ⅱ中待反应进行后撤走酒精灯,无需持续加热,原因是___________ 。若用 、水在催化剂存在时吸收尾气中的
、水在催化剂存在时吸收尾气中的 ,吸收完成后,随着氧化的进行,溶液的
,吸收完成后,随着氧化的进行,溶液的 将
将___________ (填“增大”“减小”或“不变”)。
(3) 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 脱硫和
脱硫和 再生的反应机理如图所示。
再生的反应机理如图所示。___________ 。
(4) 的“再生”是在
的“再生”是在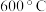 时,用一定浓度的
时,用一定浓度的 与
与 反应实现(如上图所示)。温度略低于
反应实现(如上图所示)。温度略低于 时,“再生”所得固体质量增加,原因是
时,“再生”所得固体质量增加,原因是___________ 。
 等会污染环境,需要加以治理。
等会污染环境,需要加以治理。(1)火山喷发是硫元素在自然界中转化的一种途径,反应过程如图所示。
 的结构式为
的结构式为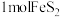 与
与 和
和 溶液反应转化为
溶液反应转化为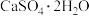 和
和 ,理论上转移电子的物质的量为
,理论上转移电子的物质的量为 。
。(2)工业上利用
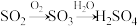 的转化制备硫酸,其模拟实验的部分装置如图所示。
的转化制备硫酸,其模拟实验的部分装置如图所示。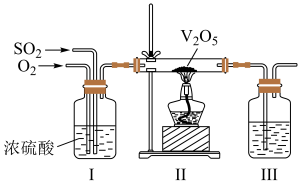
②装置Ⅲ用于吸收
 制备硫酸,适宜的吸收剂是
制备硫酸,适宜的吸收剂是A.
 溶液 B.水 C.
溶液 B.水 C. 浓硫酸
浓硫酸③装置Ⅱ中待反应进行后撤走酒精灯,无需持续加热,原因是
 、水在催化剂存在时吸收尾气中的
、水在催化剂存在时吸收尾气中的 ,吸收完成后,随着氧化的进行,溶液的
,吸收完成后,随着氧化的进行,溶液的 将
将(3)
 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 脱硫和
脱硫和 再生的反应机理如图所示。
再生的反应机理如图所示。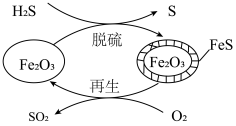
(4)
 的“再生”是在
的“再生”是在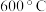 时,用一定浓度的
时,用一定浓度的 与
与 反应实现(如上图所示)。温度略低于
反应实现(如上图所示)。温度略低于 时,“再生”所得固体质量增加,原因是
时,“再生”所得固体质量增加,原因是
您最近一年使用:0次
2024-02-04更新
|
607次组卷
|
2卷引用:四川省达州外国语学校2023-2024学年高一下学期3月月考化学试题



