1 . 海洋蕴藏着中极为丰富的化学资源,如海水中就有80多种元素,所含的盐大部分是氯化钠。十九世纪末工业上开始通过电解饱和食盐水的方法制备氯气、氨气和烧碱,并以它们为原料生产一系列含氯、含钠产品(氯碱工业),请回答下列问题:
(1)天原化工厂是我国最早的氯碱企业,其创始人是______(单选)
(2)电解饱和食盐水时,与电源正极相连的电极叫阳极,阳极产物是氯气,可以用______ 检验,现象为______ ,写出检验氯气的离子方程式_____________________
(3)工业上用氯气与消石灰制成漂白粉,漂白粉的有效成分为______(单选)
(4)新制氧水呈浅黄绿色,是因为氯水中存在______(单选)
(5)有两组学生根据不同的反应原理在实验室制取氯气。

①请按要求填表。
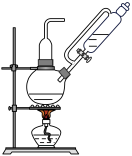
②有同学建议第一组使用图所示装置作为氯气的发生装置,请谈谈你的看法______ 。
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用如图表示。
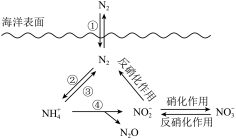
(6)海洋中的氮循环属于固氮作用的一步是______ (填图中的数字序号)。
(7)下列关于海洋氮循环的说法正确的是______(双选)。
(8)有氧时,在硝化细菌作用下, 可实现过程④的转化,方程式如下,请标出该反应的电子转移的方向与数目。
可实现过程④的转化,方程式如下,请标出该反应的电子转移的方向与数目。_______ 。

(9)有人研究了温度对海洋硝化细菌去除氯氮效果的影响.下表为对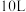 人工海水样本的监测数据.硝化细菌去除氨氮的最佳反应温度是
人工海水样本的监测数据.硝化细菌去除氨氮的最佳反应温度是______ ,在最佳反应温度时, 内去除氨氮反应的平均速率是
内去除氨氮反应的平均速率是____ 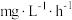 。
。
(1)天原化工厂是我国最早的氯碱企业,其创始人是______(单选)
| A.侯德榜 | B.吴蕴初 | C.荣毅仁 | D.戴安邦 |
(3)工业上用氯气与消石灰制成漂白粉,漂白粉的有效成分为______(单选)
A. | B. | C. | D. |
A. | B. | C. | D. |

①请按要求填表。
实验组 | 实验原理 | 发生装置(填编号) |
第一组 |  | |
第二组 | 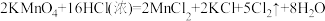 |

氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用如图表示。

(6)海洋中的氮循环属于固氮作用的一步是
(7)下列关于海洋氮循环的说法正确的是______(双选)。
| A.海洋中存在游离态的氮 |
| B.海洋中的氮循环起始于氮的氧化 |
C.向海洋排放含 的废水会影响海洋中 的废水会影响海洋中 的含量 的含量 |
| D.海洋中的反硝化作用一定有氧气的参与 |
 可实现过程④的转化,方程式如下,请标出该反应的电子转移的方向与数目。
可实现过程④的转化,方程式如下,请标出该反应的电子转移的方向与数目。
(9)有人研究了温度对海洋硝化细菌去除氯氮效果的影响.下表为对
 人工海水样本的监测数据.硝化细菌去除氨氮的最佳反应温度是
人工海水样本的监测数据.硝化细菌去除氨氮的最佳反应温度是 内去除氨氮反应的平均速率是
内去除氨氮反应的平均速率是 。
。温度/ | 样本氨氮含量/ | 处理 | 处理 |
氨氮含量/ | 氨氮含量/ | ||
20 | 1008 | 838 | 788 |
25 | 1008 | 757 | 468 |
30 | 1008 | 798 | 600 |
40 | 1008 | 977 | 910 |
您最近一年使用:0次
2 . 为达到下表中的实验目的,请选择合适的试剂及实验方法,将其标号 填入对应的空格。
供选择的化学试剂或实验方法有:A.加热B.溶解、过滤、蒸发、结晶C.取样,滴加KSCN溶液,观察现象D.将气体通入盛有饱和食盐水的洗气瓶
供选择的化学试剂或实验方法有:A.加热B.溶解、过滤、蒸发、结晶C.取样,滴加KSCN溶液,观察现象D.将气体通入盛有饱和食盐水的洗气瓶
| 序号 | 实验目的 | 试剂或方法 |
(1) | 除去Cl2中混有少量的HCl | |
(2) | 检验Fe2+溶液中是否含有少量Fe3+ | |
(3) | 除去Na2CO3固体中混有的NaHCO3 | |
(4) | 分离Na2SO4和BaSO4固体混合物 |
您最近一年使用:0次
2020-11-27更新
|
241次组卷
|
2卷引用:福建省上杭县第一中学2021-2022学年高一下学期第二次学业水平模拟考试化学试题
解题方法
3 . 有关O2的研究具有非常重要的意义,2019年3名科学家因发现大多数动物体内O2的感知通路而获得诺贝尔奖。
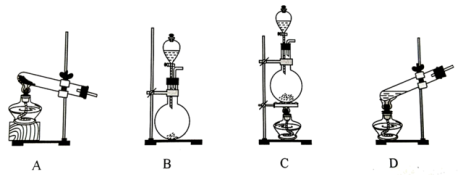
(1)标准状况下,22.4LO2的质量为_______ g。
(2)在MnO2存在下用H2O2为原料制备O2,反应的化学方程式为_________________ , 应选择的气体发生装置为____________ (填字母)。
(3) 已知H2O2不与CI-反应。为探究FeCl3在H2O2制取O2反应中的作用, 某兴趣小组进行下列实验:向试管中加入5mL 11 mol∙L−1H2O2溶液,静置几分钟,无明显现象;滴加2滴1 mol∙L−1FeCl3溶液,立即产生大量气泡。
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5 mol∙L−1,则20min内H2O2的平均反应速率为___ mol∙L−1∙min−1。
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以上实验,可推断出:在H2O2制O2反应中,FeCl3作__________ 剂。
(4)实验完毕,在离开实验室之前,应该完成的事项有________ (写出3项)。

(1)标准状况下,22.4LO2的质量为
(2)在MnO2存在下用H2O2为原料制备O2,反应的化学方程式为
(3) 已知H2O2不与CI-反应。为探究FeCl3在H2O2制取O2反应中的作用, 某兴趣小组进行下列实验:向试管中加入5mL 11 mol∙L−1H2O2溶液,静置几分钟,无明显现象;滴加2滴1 mol∙L−1FeCl3溶液,立即产生大量气泡。
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5 mol∙L−1,则20min内H2O2的平均反应速率为
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以上实验,可推断出:在H2O2制O2反应中,FeCl3作
(4)实验完毕,在离开实验室之前,应该完成的事项有
您最近一年使用:0次
2020-12-04更新
|
393次组卷
|
2卷引用:2020年7月广东省普通高中学业水平合格性考试化学试卷
解题方法
4 . 原电池是化学电源的雏形。关于如图所示原电池的说法正确的是
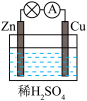
(1)如图连接好装置后,负极材料是__ (填“Zn”或“Cu”),铜电极发生的现象:_____ 。
(2)相应原电池的总反应方程式为____ 。
(3)下列化学反应可通过原电池装置,可实现化学能直接转化为电能的是__ (填序号)
①2NaOH+H2SO4=Na2SO4+2H2O
②Cu+2Fe3+=Cu2++2Fe2+
③C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O

(1)如图连接好装置后,负极材料是
(2)相应原电池的总反应方程式为
(3)下列化学反应可通过原电池装置,可实现化学能直接转化为电能的是
①2NaOH+H2SO4=Na2SO4+2H2O
②Cu+2Fe3+=Cu2++2Fe2+
③C2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O
您最近一年使用:0次
2019-06-28更新
|
426次组卷
|
4卷引用:北京市2019年普通高中学业水平合格性考试模拟化学试题
13-14高一·全国·课时练习
5 . 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫和铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________ (填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是________ (填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
根据以上信息回答下列问题:
a.除去Al3+的离子方程式是_____________________________________________________ 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为________ 。证明炉渣中含有FeO的实验现象为_______________________ 。
(1)冶炼铜的反应为8CuFeS2+21O2
 8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
根据以上信息回答下列问题:
a.除去Al3+的离子方程式是
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为
您最近一年使用:0次
2018-06-27更新
|
224次组卷
|
4卷引用:【全国市级联考】贵州省毕节市2017-2018学年高一毕业学业达标模拟考试化学试题
【全国市级联考】贵州省毕节市2017-2018学年高一毕业学业达标模拟考试化学试题(已下线)2014年高一化学人教版必修二 4-1-1金属矿物的开发利用练习卷苏教版高中化学必修2专题四《化学科学与人类文明》测试卷苏教版高一化学必修2专题4《化学科学与人类文明》测试卷
6 . 四氧化三铁(Fe3O4)俗称磁性氧化铁,在工业上应用广泛,可作催化剂、磁记录材料等。Fe3O4的一种制备方法如下:
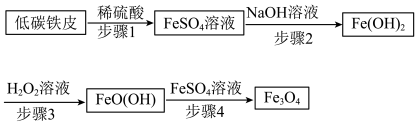
(1)低碳铁皮与稀硫酸反应时,会形成许多微小原电池。
①形成原电池时,Fe作___________ 。
A.正极 B.负极
②反应过程中,溶液的pH___________ 。
A.变大 B.变小 C.不变
(2)检验步骤1得到的FeSO4溶液中是否存在 ,可选用的试剂是___________。
,可选用的试剂是___________。
(3)实验室测定FeSO4溶液的浓度,常用K2Cr2O7标准溶液进行滴定。现称量2.940gK2Cr2O7(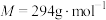 )固体,配制成
)固体,配制成 K2Cr2O7标准溶液。
K2Cr2O7标准溶液。
①称量时,需用到的仪器有___________ 。
②根据计算,选用的容量瓶规格应为___________ 。
A.100mL B.250mL C.500mL D.1000mL
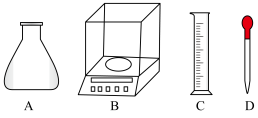
(4)步骤2用下图所示装置制备 。制备时,先打开止水夹,通入N2一段时间;再关闭止水夹,继续通入N2一段时间。
。制备时,先打开止水夹,通入N2一段时间;再关闭止水夹,继续通入N2一段时间。
止水夹关闭前后,通入N2的作用分别为___________ 、___________ 。
(5)步骤3的反应原理为: 。反应中每消耗34gH2O2,转移的电子数为
。反应中每消耗34gH2O2,转移的电子数为___________ 。
(6)步骤4在不同时刻得到的Fe3O4粒径大小如下图所示。
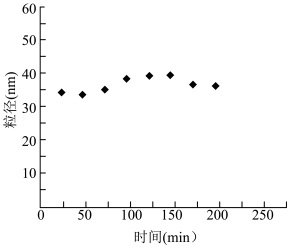
①实验过程中,Fe3O4不易形成沉淀,结合上图分析原因___________ 。
②写出一种可使Fe3O4较快形成沉淀的方法___________ 。

(1)低碳铁皮与稀硫酸反应时,会形成许多微小原电池。
①形成原电池时,Fe作
A.正极 B.负极
②反应过程中,溶液的pH
A.变大 B.变小 C.不变
(2)检验步骤1得到的FeSO4溶液中是否存在
 ,可选用的试剂是___________。
,可选用的试剂是___________。| A.KSCN溶液 | B.KMnO4溶液 | C.稀硝酸 | D.BaCl2溶液 |
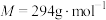 )固体,配制成
)固体,配制成 K2Cr2O7标准溶液。
K2Cr2O7标准溶液。①称量时,需用到的仪器有

②根据计算,选用的容量瓶规格应为
A.100mL B.250mL C.500mL D.1000mL
(4)步骤2用下图所示装置制备
 。制备时,先打开止水夹,通入N2一段时间;再关闭止水夹,继续通入N2一段时间。
。制备时,先打开止水夹,通入N2一段时间;再关闭止水夹,继续通入N2一段时间。
止水夹关闭前后,通入N2的作用分别为
(5)步骤3的反应原理为:
 。反应中每消耗34gH2O2,转移的电子数为
。反应中每消耗34gH2O2,转移的电子数为(6)步骤4在不同时刻得到的Fe3O4粒径大小如下图所示。

①实验过程中,Fe3O4不易形成沉淀,结合上图分析原因
②写出一种可使Fe3O4较快形成沉淀的方法
您最近一年使用:0次
解题方法
7 . Ⅰ.氯气及氯的化合物的“价-类”二维图体现了化学变化之美。
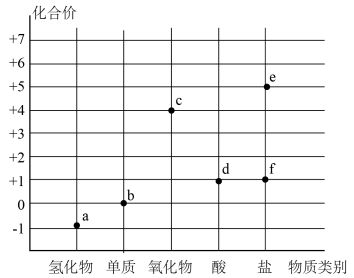
(1)f(84消毒液的主要成分)可用于环境杀菌消毒,f的化学式是_____ 。
(2)不同价态的氯元素可以相互转化,请写出反应前后存在3种价态氯元素的化学方程式_____ 。
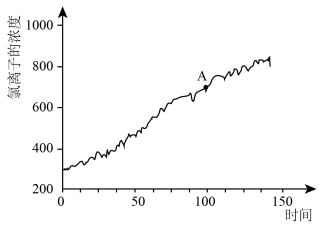
(3)将氯离子传感器插入新制b的水溶液广口瓶中,与数据采集器、计算机连接,用强光照射瓶中溶液,采集数据所得图像如图所示。A点溶液发生分解反应的离子方程式为_____ 。
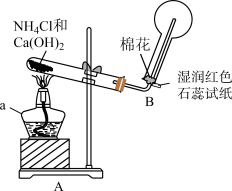
Ⅱ.氨是一种重要的化工产品,也是重要的化工原料。某化学小组在实验室制备氨并完成相关性质实验。
(4)实验一:用如图所示装置制备并收集 。仪器a的名称为
。仪器a的名称为_____ ,装置A中产生 的化学方程式为
的化学方程式为_____ ,装置B中用圆底烧瓶收集 的方法为
的方法为_____ (填“向上排空气法”或“向下排空气法”),当湿润红色石蕊试纸颜色变为_____ 色,表示已经收集满 。
。

(1)f(84消毒液的主要成分)可用于环境杀菌消毒,f的化学式是
(2)不同价态的氯元素可以相互转化,请写出反应前后存在3种价态氯元素的化学方程式
(3)将氯离子传感器插入新制b的水溶液广口瓶中,与数据采集器、计算机连接,用强光照射瓶中溶液,采集数据所得图像如图所示。A点溶液发生分解反应的离子方程式为

Ⅱ.氨是一种重要的化工产品,也是重要的化工原料。某化学小组在实验室制备氨并完成相关性质实验。
(4)实验一:用如图所示装置制备并收集
 。仪器a的名称为
。仪器a的名称为 的化学方程式为
的化学方程式为 的方法为
的方法为 。
。
您最近一年使用:0次
名校
8 . 据史料记载,我国汉代已将 用于制药等生活实践。
用于制药等生活实践。
(1)实验室模拟工业制备 :在锥形瓶中加入铜屑和稀
:在锥形瓶中加入铜屑和稀 ,水浴加热使温度保持
,水浴加热使温度保持 左右,向混合物中通入
左右,向混合物中通入 ,充分反应。实验装置如图所示。所得溶液经分离提纯得
,充分反应。实验装置如图所示。所得溶液经分离提纯得 。
。

①反应中将 氧化为
氧化为 的氧化剂为
的氧化剂为_______ (填化学式)。
②装置中多孔球泡的作用是_______ 。
(2)工业用上述方法制备 时,若采用空气代替氧气,会增加制备过程中能量的消耗。原因是
时,若采用空气代替氧气,会增加制备过程中能量的消耗。原因是_______ 。
(3)为测定所制得样品中 的质量分数,进行如下实验:称取
的质量分数,进行如下实验:称取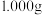 样品,配成
样品,配成 溶液;取
溶液;取 溶液,向其中加入
溶液,向其中加入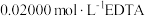 溶液与
溶液与 反应(参加反应的
反应(参加反应的 与EDTA物质的量之比为
与EDTA物质的量之比为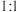 )。恰好完全反应时,消耗EDTA溶液
)。恰好完全反应时,消耗EDTA溶液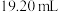 。计算样品中
。计算样品中 的质量分数
的质量分数_____ (写出计算过程)。
 用于制药等生活实践。
用于制药等生活实践。(1)实验室模拟工业制备
 :在锥形瓶中加入铜屑和稀
:在锥形瓶中加入铜屑和稀 ,水浴加热使温度保持
,水浴加热使温度保持 左右,向混合物中通入
左右,向混合物中通入 ,充分反应。实验装置如图所示。所得溶液经分离提纯得
,充分反应。实验装置如图所示。所得溶液经分离提纯得 。
。
①反应中将
 氧化为
氧化为 的氧化剂为
的氧化剂为②装置中多孔球泡的作用是
(2)工业用上述方法制备
 时,若采用空气代替氧气,会增加制备过程中能量的消耗。原因是
时,若采用空气代替氧气,会增加制备过程中能量的消耗。原因是(3)为测定所制得样品中
 的质量分数,进行如下实验:称取
的质量分数,进行如下实验:称取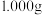 样品,配成
样品,配成 溶液;取
溶液;取 溶液,向其中加入
溶液,向其中加入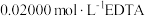 溶液与
溶液与 反应(参加反应的
反应(参加反应的 与EDTA物质的量之比为
与EDTA物质的量之比为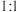 )。恰好完全反应时,消耗EDTA溶液
)。恰好完全反应时,消耗EDTA溶液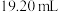 。计算样品中
。计算样品中 的质量分数
的质量分数
您最近一年使用:0次
2022-12-16更新
|
412次组卷
|
2卷引用:江苏省南京市六校联合体2022-2023学年高二上学期12月联考合格性考试化学试题
解题方法
9 . 铁是目前人类使用量最大的金属,它能形成多种化合物。
(1)取5.6 g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集的气体体积均小于2.24 L(标准状况),最主要的原因是_____________________ ;所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因:___________ 。
(2)ZnFe2Ox是一种新型纳米材料,可将工业废气中的某些元素转化为游离态,制取纳米ZnFe2Ox和用于除去废气的转化关系为ZnFe2O4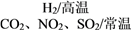 ZnFe2Ox。若上述转化反应中消耗的n(ZnFe2O4)∶n(H2)=2∶1,x的值为
ZnFe2Ox。若上述转化反应中消耗的n(ZnFe2O4)∶n(H2)=2∶1,x的值为________ 。请写出 ZnFe2Ox与NO2反应的化学方程式:_________________________ (x用前一问求出的具体值)。
(3)LiFePO4(难溶于水)材料被视为最有前途的锂离子电池材料之一。
①以 FePO4(难溶于水)、Li2CO3、单质碳为原料在高温下制备LiFePO4,该反应还生成一种可燃性气体,则反应的化学方程式为___________________________ 。
②磷酸铁锂动力电池有几种类型,其中一种(中间是锂离子聚合物的隔膜,它把正极与负极隔开)工作原理为FePO4+Li LiFePO4。则放电时正极上的电极反应式为
LiFePO4。则放电时正极上的电极反应式为___________________________________ 。
(4)已知25 ℃时Ksp[Fe(OH3)]=4.0×10-38,此温度下若在实验室中配制5 mol·L-1 100 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入______ mL 2 mol·L-1的盐酸(忽略加入盐酸时溶液体积的变化)。
(1)取5.6 g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集的气体体积均小于2.24 L(标准状况),最主要的原因是
(2)ZnFe2Ox是一种新型纳米材料,可将工业废气中的某些元素转化为游离态,制取纳米ZnFe2Ox和用于除去废气的转化关系为ZnFe2O4
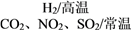 ZnFe2Ox。若上述转化反应中消耗的n(ZnFe2O4)∶n(H2)=2∶1,x的值为
ZnFe2Ox。若上述转化反应中消耗的n(ZnFe2O4)∶n(H2)=2∶1,x的值为(3)LiFePO4(难溶于水)材料被视为最有前途的锂离子电池材料之一。
①以 FePO4(难溶于水)、Li2CO3、单质碳为原料在高温下制备LiFePO4,该反应还生成一种可燃性气体,则反应的化学方程式为
②磷酸铁锂动力电池有几种类型,其中一种(中间是锂离子聚合物的隔膜,它把正极与负极隔开)工作原理为FePO4+Li
 LiFePO4。则放电时正极上的电极反应式为
LiFePO4。则放电时正极上的电极反应式为(4)已知25 ℃时Ksp[Fe(OH3)]=4.0×10-38,此温度下若在实验室中配制5 mol·L-1 100 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入
您最近一年使用:0次
解题方法
10 . (1) 良好的生态环境可以提升生活质量。
① 下列物质不属于空气质量周报中污染物的是________ (填字母)。
a. SO2 b. NO2 c. PM2.5
② 垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有________ (填字母)标志的垃圾桶内。
③ 燃烧煤产生的SO2所形成的酸雨中,SO2最终转化成的酸是________ (填化学式)。
(2) 右图是某品牌调料标签的一部分。
① 配料中的大量氨基酸态氮来源于黄豆中的蛋白质发生________ 反应得到。
② 小麦粉中的主要营养物质是________ 。
③ 配料表中属于防腐剂的是________ 。
④ 配料表中的辣椒红是着色剂。亚硝酸钠也可作着色剂,但亚硝酸钠有毒,要严格控制其用量。亚硝酸钠外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故。亚硝酸钠和氯化钠的部分性质如下表:
请根据表中信息设计一种鉴别NaNO2和NaCl的方法,写出简单的操作过程、现象和结论:________ 。
(3) 材料是人类赖以生存和发展的重要物质基础。
① 钢铁是应用广泛的金属材料。钢铁在潮湿空气中易生锈,铁锈的主要成分是____________ (填化学式),请列举一种防止钢铁腐蚀的方法:________ 。
② 水泥、玻璃、陶瓷是生活中常见的硅酸盐材料。制备普通玻璃的原料有CaCO3、________ 和________ (填化学式)。青瓷是中国最早发明的瓷器,青瓷表面的绿色是釉层中的________ 价铁元素显色而成的。
③ 氮化硅陶瓷抗腐蚀能力强,工业上可用四氯化硅和氮气在氢气气氛中加强热发生反应制得。请写出该反应的化学方程式:________ 。
① 下列物质不属于空气质量周报中污染物的是
a. SO2 b. NO2 c. PM2.5
② 垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有

③ 燃烧煤产生的SO2所形成的酸雨中,SO2最终转化成的酸是
(2) 右图是某品牌调料标签的一部分。

① 配料中的大量氨基酸态氮来源于黄豆中的蛋白质发生
② 小麦粉中的主要营养物质是
③ 配料表中属于防腐剂的是
④ 配料表中的辣椒红是着色剂。亚硝酸钠也可作着色剂,但亚硝酸钠有毒,要严格控制其用量。亚硝酸钠外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故。亚硝酸钠和氯化钠的部分性质如下表:
性质 | 亚硝酸钠 | 氯化钠 |
1. 酸性条件下的稳定性 | 微热分解为NO和NO2 | 微热时不分解 |
2. 熔点 | 271 ℃ | 801 ℃ |
3. 室温时的溶解度 | 约80 g | 约35 g |
请根据表中信息设计一种鉴别NaNO2和NaCl的方法,写出简单的操作过程、现象和结论:
(3) 材料是人类赖以生存和发展的重要物质基础。
① 钢铁是应用广泛的金属材料。钢铁在潮湿空气中易生锈,铁锈的主要成分是
② 水泥、玻璃、陶瓷是生活中常见的硅酸盐材料。制备普通玻璃的原料有CaCO3、
③ 氮化硅陶瓷抗腐蚀能力强,工业上可用四氯化硅和氮气在氢气气氛中加强热发生反应制得。请写出该反应的化学方程式:
您最近一年使用:0次
2017-03-16更新
|
264次组卷
|
2卷引用:2016-2017学年江苏省无锡市高二学业水平模拟(十四)化学试卷






