2025高三上·全国·专题练习
1 . 向500 mL氢氧化钠溶液中投入10.8 g铝,二者恰好完全反应,计算回答:
(1)铝的物质的量是___________ 。
(2)氢氧化钠溶液的物质的量浓度是___________ 。
(3)在标准状况下生成氢气的体积是___________ 。
(1)铝的物质的量是
(2)氢氧化钠溶液的物质的量浓度是
(3)在标准状况下生成氢气的体积是
您最近一年使用:0次
2025高三上·全国·专题练习
解题方法
2 . 把10.2 g镁铝合金的粉末放入过量的烧碱溶液中,在标准状况下生成6.72 L氢气。试计算:
(1)该合金中铝的质量分数是___________ 。
(2)该合金中镁与铝的物质的量之比是___________ 。
(3)该合金溶于足量的盐酸溶液中,标准状况下产生氢气的体积是___________ 。
(1)该合金中铝的质量分数是
(2)该合金中镁与铝的物质的量之比是
(3)该合金溶于足量的盐酸溶液中,标准状况下产生氢气的体积是
您最近一年使用:0次
2025高三上·全国·专题练习
3 . 一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。称取TiO2样品0.60 g,消耗0.20 mol·L-1的NH4Fe(SO4)2溶液36.75 mL,则样品中TiO2的质量分数是_______ 。
您最近一年使用:0次
2025高三上·全国·专题练习
4 . 已知MnO2与浓盐酸反应的化学方程式为MnO2+ 4HCl(浓) MnCl2+Cl2↑+2H2O,回答下列问题:
MnCl2+Cl2↑+2H2O,回答下列问题:
(1)该反应的离子方程式为___________ 。
(2)被氧化的HCl占HCl总量的___________ 。
(3)当标准状况下有11.2 L氯气生成时,该反应转移的电子数为___________ (设NA为阿伏加德罗常数的值)。
(4)1.74 g MnO2与100 mL 12 mol·L-1的过量浓盐酸完全反应(假设HCl无挥发),在反应后的溶液中加入足量的AgNO3溶液,可生成___________ g沉淀。
 MnCl2+Cl2↑+2H2O,回答下列问题:
MnCl2+Cl2↑+2H2O,回答下列问题:(1)该反应的离子方程式为
(2)被氧化的HCl占HCl总量的
(3)当标准状况下有11.2 L氯气生成时,该反应转移的电子数为
(4)1.74 g MnO2与100 mL 12 mol·L-1的过量浓盐酸完全反应(假设HCl无挥发),在反应后的溶液中加入足量的AgNO3溶液,可生成
您最近一年使用:0次
2025高三上·全国·专题练习
解题方法
5 . 用“间接碘量法”测定CuCl2·2H2O样品的纯度,过程如下:取0.400 0 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀,滴入几滴淀粉溶液作指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。(滴定反应为I2+2S2O =S4O
=S4O +2I-)
+2I-)
(1)写出生成白色CuI沉淀的离子方程式:___________ 。
(2)该样品中CuCl2·2H2O的质量分数为___________ 。
 =S4O
=S4O +2I-)
+2I-)(1)写出生成白色CuI沉淀的离子方程式:
(2)该样品中CuCl2·2H2O的质量分数为
您最近一年使用:0次
2025高三上·全国·专题练习
6 . 臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2 2O3。
2O3。
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为___________ g·mol-1(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为___________ L。
 2O3。
2O3。(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为
您最近一年使用:0次
2025高三上·全国·专题练习
解题方法
7 . 质量、物质的量、物质的量浓度等是用于化学计算的常见物理量。
(1)质量之比为16:7:6的三种气体SO2、CO、NO。分子个数之比为___________ ;氧原子个数之比为___________ ;相同条件下的体积之比为___________ 。
(2)标准状况下,17g NH3的体积为___________ ,含有氢原子个数为___________ ,它与标准状况下___________ L H2S含有相同数目的氢原子。
(3)某气体氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为___________ ,R的相对原子质量为___________ 。
(4)同温同压下,A2气体与B2气体等体积化合,生成AxBy气体,已知反应前后气体的密度不变,则AxBy的分子式为___________ 。
(5)在t℃时将a g NH3 完全溶于水得到V mL溶液,该溶液的密度为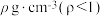 ;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。
;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。
(6)将a L Al2(SO4)3和(NH4)2SO4的混合溶液分成两等份,一份加入b mol BaCl2溶液使溶液中的SO 刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为
刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为___________ 。
(7)将0.24g Mg和0.27g Al的混合物投入到100mL 1mol/L的盐酸中,充分反应后固体完全溶解。向所得溶液中加入2mol/L的NaOH溶液,恰好使金属离子全部沉淀完全,需要NaOH溶液的体积为___________ mL。
(1)质量之比为16:7:6的三种气体SO2、CO、NO。分子个数之比为
(2)标准状况下,17g NH3的体积为
(3)某气体氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为
(4)同温同压下,A2气体与B2气体等体积化合,生成AxBy气体,已知反应前后气体的密度不变,则AxBy的分子式为
(5)在t℃时将a g NH3 完全溶于水得到V mL溶液,该溶液的密度为
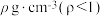 ;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。
;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。A.溶质的质量分数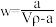 |
B.溶质的物质的量浓度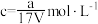 |
C.溶液密度ρ可表示为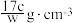 |
| D.上述溶液中再加入V mL水,所得溶液溶质的质量分数小于0.5w |
 刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为
刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为(7)将0.24g Mg和0.27g Al的混合物投入到100mL 1mol/L的盐酸中,充分反应后固体完全溶解。向所得溶液中加入2mol/L的NaOH溶液,恰好使金属离子全部沉淀完全,需要NaOH溶液的体积为
您最近一年使用:0次
8 .  是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)已知 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为_______  。
。
 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)已知
 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为 。
。
您最近一年使用:0次
2024高三下·全国·专题练习
9 .  作为绿色氧化剂应用广泛,氢醌法制备
作为绿色氧化剂应用广泛,氢醌法制备 原理及装置如下:
原理及装置如下: 、
、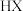 等杂质易使
等杂质易使 催化剂中毒。回答下列问题:
催化剂中毒。回答下列问题:
(1)取 产品,加蒸馏水定容至
产品,加蒸馏水定容至 摇匀,取
摇匀,取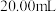 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、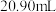 、
、 。假设其他杂质不干扰结果,产品中
。假设其他杂质不干扰结果,产品中 质量分数为
质量分数为_______ 。
 作为绿色氧化剂应用广泛,氢醌法制备
作为绿色氧化剂应用广泛,氢醌法制备 原理及装置如下:
原理及装置如下: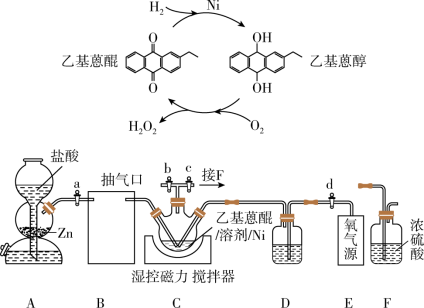
 、
、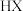 等杂质易使
等杂质易使 催化剂中毒。回答下列问题:
催化剂中毒。回答下列问题:(1)取
 产品,加蒸馏水定容至
产品,加蒸馏水定容至 摇匀,取
摇匀,取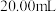 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、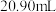 、
、 。假设其他杂质不干扰结果,产品中
。假设其他杂质不干扰结果,产品中 质量分数为
质量分数为
您最近一年使用:0次
解题方法
10 . 某种天然碱样品的化学式可以用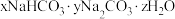 表示(式中x、y、z是最简整数比)。取50g某一浓度的盐酸与3.32g样品充分反应,能生成
表示(式中x、y、z是最简整数比)。取50g某一浓度的盐酸与3.32g样品充分反应,能生成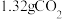 气体。
气体。
(1)若改用1.66g样品与50g这种盐酸反应,能生成
 ?
?(2)另取3.32g样品在300℃下加热至完全分解(已知
 在300℃时不会分解),能产生
在300℃时不会分解),能产生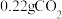 和
和 ,试确定该样品的化学式
,试确定该样品的化学式(3)写出这种天然碱与盐酸完全反应的化学方程式:
 最多,求该盐酸中溶质质量分数
最多,求该盐酸中溶质质量分数
您最近一年使用:0次



