解题方法
1 . 回答下列问题:
(1)0.1 mol/l HCl溶液和0.05 mol/L H2SO4溶液等体积混合,pH=_______ 。
(2)在25℃下,将pH=3的强酸溶液和pH=12强碱溶液混合,当混合溶液的pH=11时,强酸溶液和强碱溶液的体积比是_______ 。
(3)某温度(t℃) 时,测得0.01 mol/L的NaOH溶液的pH=11,则该温度下水的Kw=_______ 。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。
①若所得混合液为中性,且a=12,b=2,则Va:Vb=_______ 。
②若所得混合液为中性,且a+b=12,则Va:Vb=_______ 。
③若所得混合液的pH=10,且a=12,b=2,则Va:Vb=_______ 。
(1)0.1 mol/l HCl溶液和0.05 mol/L H2SO4溶液等体积混合,pH=
(2)在25℃下,将pH=3的强酸溶液和pH=12强碱溶液混合,当混合溶液的pH=11时,强酸溶液和强碱溶液的体积比是
(3)某温度(t℃) 时,测得0.01 mol/L的NaOH溶液的pH=11,则该温度下水的Kw=
①若所得混合液为中性,且a=12,b=2,则Va:Vb=
②若所得混合液为中性,且a+b=12,则Va:Vb=
③若所得混合液的pH=10,且a=12,b=2,则Va:Vb=
您最近一年使用:0次
名校
2 . 填空
(1)标准状况下有①44.8LCH4,②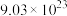 个NH3分子,③85gH2S三种气体,这三种气体的物质的量从大到小的顺序是
个NH3分子,③85gH2S三种气体,这三种气体的物质的量从大到小的顺序是______ 。
(2)40.5g某金属氯化物MCl2中含有0.6molCl-,则M的相对原子质量为______ 。
(3)amLAl2(SO4)3溶液中含 bg,则溶液中Al3+的物质的量浓度
bg,则溶液中Al3+的物质的量浓度______ 。
(4)将一定量的CO2和SO2混合,测得混合气体中碳元素和硫元素的质量之比为3∶8,则该混合气体中CO2与SO2的物质的量之比为______ ,该混合气体的密度是同温同压下氢气密度的______ 倍。
(5)把VL含有MgSO4与K2SO4的混合溶液分成两等份,一份加入含amolNaOH的溶液,恰好使镁离子完全沉淀为Mg(OH)2;另一份加入含bmolBaCl2的溶液,恰好使 完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为
完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为______ 。
(1)标准状况下有①44.8LCH4,②
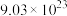 个NH3分子,③85gH2S三种气体,这三种气体的物质的量从大到小的顺序是
个NH3分子,③85gH2S三种气体,这三种气体的物质的量从大到小的顺序是(2)40.5g某金属氯化物MCl2中含有0.6molCl-,则M的相对原子质量为
(3)amLAl2(SO4)3溶液中含
 bg,则溶液中Al3+的物质的量浓度
bg,则溶液中Al3+的物质的量浓度(4)将一定量的CO2和SO2混合,测得混合气体中碳元素和硫元素的质量之比为3∶8,则该混合气体中CO2与SO2的物质的量之比为
(5)把VL含有MgSO4与K2SO4的混合溶液分成两等份,一份加入含amolNaOH的溶液,恰好使镁离子完全沉淀为Mg(OH)2;另一份加入含bmolBaCl2的溶液,恰好使
 完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为
完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为
您最近一年使用:0次
2023-12-19更新
|
112次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高三上学期10月考试化学试卷
名校
3 . 填空
(1)3.01×1023个H2O的物质的量为___________ mol,其中,所含原子的物质的量为___________ mol,所含电子的物质的量为___________ mol。
(2)___________ gH2O中的氧原子数目与标准状况下22.4LCO2中的氧原子数目相同。
(3)2gNaOH溶于水配制成___________ mL溶液时其物质的量浓度为2mol/L。
(4)某硫酸铝溶液中所含铝离子浓度为3mol/L,则硫酸根离子浓度为___________
(5)电解1.8gH2O所得的H2在标准状况下的体积为___________
(6)标准状况下,2molNH3与___________  CO2的体积相等。
CO2的体积相等。
(7)33.3g某金属氯化物MCl2中含有0.6molCl-,则该氯化物的摩尔质量为___________
(8)在同温同压下,等质量的CO和CO2,其体积之比为___________ 。
(9)某元素的一种同位素X的质量数为A,含N个中子,它与1H原子组成HmX分子,在agHmX分子中含质子的物质的量是___________ 。
(10)在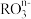 中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是___________
(1)3.01×1023个H2O的物质的量为
(2)
(3)2gNaOH溶于水配制成
(4)某硫酸铝溶液中所含铝离子浓度为3mol/L,则硫酸根离子浓度为
(5)电解1.8gH2O所得的H2在标准状况下的体积为
(6)标准状况下,2molNH3与
 CO2的体积相等。
CO2的体积相等。(7)33.3g某金属氯化物MCl2中含有0.6molCl-,则该氯化物的摩尔质量为
(8)在同温同压下,等质量的CO和CO2,其体积之比为
(9)某元素的一种同位素X的质量数为A,含N个中子,它与1H原子组成HmX分子,在agHmX分子中含质子的物质的量是
(10)在
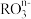 中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
您最近一年使用:0次
2023-10-23更新
|
326次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高三上学期10月考试化学试卷
解题方法
4 . 联氨( )是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
)是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
(1)工业上利用 和
和 合成
合成 ,用
,用 进一步制备联氨(
进一步制备联氨( )。已知断开(或形成)1 mol
)。已知断开(或形成)1 mol  键、
键、 键分别需要吸收(或放出)948.9kJ,436.0kJ的热量,合成1 mol
键分别需要吸收(或放出)948.9kJ,436.0kJ的热量,合成1 mol  可放出46.1 kJ的热量,则拆开1 mol
可放出46.1 kJ的热量,则拆开1 mol  吸收的热量为
吸收的热量为___________ kJ(保留一位小数),反应 中反应物的能量
中反应物的能量___________ (填写“大于”或“低于”)产物的能量。
(2)发射航天器时常以 为燃料。已知有关化学反应的能量变化如图所示。
为燃料。已知有关化学反应的能量变化如图所示。 与
与 反应生成
反应生成 和
和 的热化学方程式是
的热化学方程式是___________ , 与
与 转化为
转化为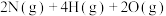 需要
需要___________ (填写“吸收”、“放出”)能量___________ kJ。

(3)一种联氨燃料电池的工作原理如图所示。放电一段时间,电池内的 向
向___________ (填写“电极甲”,“电极乙”);负极电极反应式是___________ 。

 )是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
)是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:(1)工业上利用
 和
和 合成
合成 ,用
,用 进一步制备联氨(
进一步制备联氨( )。已知断开(或形成)1 mol
)。已知断开(或形成)1 mol  键、
键、 键分别需要吸收(或放出)948.9kJ,436.0kJ的热量,合成1 mol
键分别需要吸收(或放出)948.9kJ,436.0kJ的热量,合成1 mol  可放出46.1 kJ的热量,则拆开1 mol
可放出46.1 kJ的热量,则拆开1 mol  吸收的热量为
吸收的热量为 中反应物的能量
中反应物的能量(2)发射航天器时常以
 为燃料。已知有关化学反应的能量变化如图所示。
为燃料。已知有关化学反应的能量变化如图所示。 与
与 反应生成
反应生成 和
和 的热化学方程式是
的热化学方程式是 与
与 转化为
转化为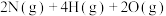 需要
需要
(3)一种联氨燃料电池的工作原理如图所示。放电一段时间,电池内的
 向
向
您最近一年使用:0次
5 . 回答下列问题:
(1)已知:①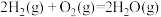 ∆H1=-483.6kJ/mol
∆H1=-483.6kJ/mol
②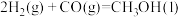 ∆H2=-128.3kJ/mol
∆H2=-128.3kJ/mol
③ ∆H3=+206.1kJ/mol
∆H3=+206.1kJ/mol
属于吸热反应的是__________ (填序号)。
写出由甲烷和氧气合成液态甲醇的热化学方程式:_____________ 。
(2)通过化学键的键能计算。已知:
则合成氨反应N2(g)+3H2(g) 2NH3(g) △H=a kJ/mol,a为
2NH3(g) △H=a kJ/mol,a为______ 。
(3)已知:1 mol H2O(g)转化为1 mol H2O(l)时放出44.0 kJ的热量。写出H2O(g)转化为1 mol H2O(l)热化学方程式:_______________ 。H2O(l)的稳定性_________ 填(“大于”“小于”)H2O(g)
(1)已知:①
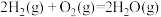 ∆H1=-483.6kJ/mol
∆H1=-483.6kJ/mol ②
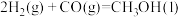 ∆H2=-128.3kJ/mol
∆H2=-128.3kJ/mol ③
 ∆H3=+206.1kJ/mol
∆H3=+206.1kJ/mol 属于吸热反应的是
写出由甲烷和氧气合成液态甲醇的热化学方程式:
(2)通过化学键的键能计算。已知:
化学键 | H—H | N—H | N≡N |
键能(kJ/mol ) | 436 | 391 | 945 |
 2NH3(g) △H=a kJ/mol,a为
2NH3(g) △H=a kJ/mol,a为(3)已知:1 mol H2O(g)转化为1 mol H2O(l)时放出44.0 kJ的热量。写出H2O(g)转化为1 mol H2O(l)热化学方程式:
您最近一年使用:0次
6 . 用 与
与 的混合物共
的混合物共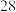
 配制成
配制成
 溶液,测得该溶液中
溶液,测得该溶液中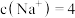
 。另取相同质量的上述混合物,加入盐酸完全反应后,放出的气体在标准状况下的体积为
。另取相同质量的上述混合物,加入盐酸完全反应后,放出的气体在标准状况下的体积为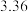
 ,消耗盐酸
,消耗盐酸 。试计算:
。试计算:
(1)原混合物中 的质量分数
的质量分数______ 。
(2)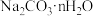 中的
中的 值
值______ 。
(3)盐酸的物质的量浓度______ 。
 与
与 的混合物共
的混合物共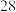
 配制成
配制成
 溶液,测得该溶液中
溶液,测得该溶液中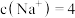
 。另取相同质量的上述混合物,加入盐酸完全反应后,放出的气体在标准状况下的体积为
。另取相同质量的上述混合物,加入盐酸完全反应后,放出的气体在标准状况下的体积为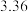
 ,消耗盐酸
,消耗盐酸 。试计算:
。试计算:(1)原混合物中
 的质量分数
的质量分数(2)
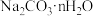 中的
中的 值
值(3)盐酸的物质的量浓度
您最近一年使用:0次
2023-01-21更新
|
102次组卷
|
2卷引用:广西钦州市2022-2023学年高一上学期第2次教学质量监测化学试卷
名校
7 . 根据要求,回答下列问题:
(1)已知甲烷的燃烧热为 ,
,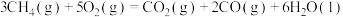
 。写出CO燃烧的热化学方程式:
。写出CO燃烧的热化学方程式:_______ ,若 、
、 键的键能分别为
键的键能分别为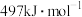 、
、 ,则使1molCO转化为相应的原子时需要的能量是
,则使1molCO转化为相应的原子时需要的能量是_______ ;1mol 按上述方式燃烧时损失的热能是
按上述方式燃烧时损失的热能是_______ (保留1位小数)。
(2)煤的气化反应之一为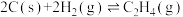

已知:①

②
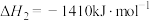
③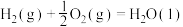

则上述煤的生成 的气化反应的
的气化反应的
_______ 。实际生产中该气化反应需要加入催化剂,其主要原因是_______ (填“速率问题”或“平衡问题”)。
(1)已知甲烷的燃烧热为
 ,
,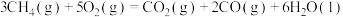
 。写出CO燃烧的热化学方程式:
。写出CO燃烧的热化学方程式: 、
、 键的键能分别为
键的键能分别为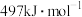 、
、 ,则使1molCO转化为相应的原子时需要的能量是
,则使1molCO转化为相应的原子时需要的能量是 按上述方式燃烧时损失的热能是
按上述方式燃烧时损失的热能是(2)煤的气化反应之一为
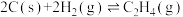

已知:①


②

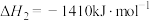
③
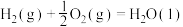

则上述煤的生成
 的气化反应的
的气化反应的
您最近一年使用:0次
2022-12-13更新
|
210次组卷
|
2卷引用:广西北海市2022-2023学年高二上学期期末考试化学试题
8 . 利用相关知识填空。
(1)标准状况下11.2LNH3含___________ 个氨分子,含___________ mol氢原子。
(2)等质量的SO2和SO3物质的量之比是___________ ;所含的氧原子个数之比是___________ 。
(3)4.8gCH4中所含氢原子数与___________ g水所含氢原子数相等。
(4)已知A是一种金属,82gA(NO3)2中含有6.02×1023个硝酸根离子,则该硝酸盐的摩尔质量为___________ 。
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为___________ 。若此时压强为101kPa,则温度___________ 0℃(填“高于”“低于”或“等于”)。
(6)有一种由Na2S、Na2SO3、Na2SO4组成的混合物,经测定含硫25.6%,则混合物中含氧的质量分数为___________ 。
(1)标准状况下11.2LNH3含
(2)等质量的SO2和SO3物质的量之比是
(3)4.8gCH4中所含氢原子数与
(4)已知A是一种金属,82gA(NO3)2中含有6.02×1023个硝酸根离子,则该硝酸盐的摩尔质量为
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为
(6)有一种由Na2S、Na2SO3、Na2SO4组成的混合物,经测定含硫25.6%,则混合物中含氧的质量分数为
您最近一年使用:0次
解题方法
9 . 已知常温下, 的电离平衡常数
的电离平衡常数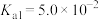 ,
, 。
。
(1)常温下, 的
的 溶液中,由水电离出的
溶液中,由水电离出的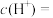
_______ 。
(2)常温下,将 的
的 溶液稀释100倍,溶液的pH
溶液稀释100倍,溶液的pH_______ 4(填“>”“=”或“<”)。
(3)常温下,反应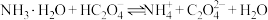 的平衡常数
的平衡常数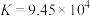 ,计算
,计算 的电离平衡常数
的电离平衡常数
_______ 。
 的电离平衡常数
的电离平衡常数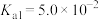 ,
, 。
。(1)常温下,
 的
的 溶液中,由水电离出的
溶液中,由水电离出的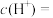
(2)常温下,将
 的
的 溶液稀释100倍,溶液的pH
溶液稀释100倍,溶液的pH(3)常温下,反应
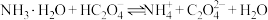 的平衡常数
的平衡常数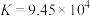 ,计算
,计算 的电离平衡常数
的电离平衡常数
您最近一年使用:0次
10 . 将0.1mol镁和铝的混合物溶于100mL2mol·L-1硫酸中,然后滴加1mol·L-1NaOH溶液。回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液体积的变化如图所示。

①有关反应的离子方程式为____ 。
②当V1=160时,金属粉末中n(Mg)=____ mol,V2=___ 。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积为___ 。
(3)若混合物仍为0.1mol,其中镁粉的物质的量分数为a,用100mL2mol·L-1硫酸溶解此混合物后,再加入450mL1mol·L-1NaOH溶液,所得沉淀中无Al(OH)3,写出满足此条件的a的取值范围:____ 。
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液体积的变化如图所示。

①有关反应的离子方程式为
②当V1=160时,金属粉末中n(Mg)=
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积为
(3)若混合物仍为0.1mol,其中镁粉的物质的量分数为a,用100mL2mol·L-1硫酸溶解此混合物后,再加入450mL1mol·L-1NaOH溶液,所得沉淀中无Al(OH)3,写出满足此条件的a的取值范围:
您最近一年使用:0次



