名校
解题方法
1 . 氮元素的单质及其化合物在工农业生产、生活中有着重要作用。回答下列问题:
I.一定条件下,在2 L密闭容器中发生反应:3A(g) + B(g) 2C(g)。开始时加入4 mol A,6 mol B,2molC,在2 min末测得C的物质的量是3mol。
2C(g)。开始时加入4 mol A,6 mol B,2molC,在2 min末测得C的物质的量是3mol。
(1)用A的浓度变化表示反应的平均速率:___________ 。
(2)在2 min末,B的浓度为___________ 。
II.某反应过程的能量变化如下图所示。
(3)反应过程___________ (填“a”或“b”)有催化剂参与。
(4)①该反应为___________ 反应(填“放热”或“吸热”)。
②已知:
反应i:
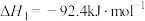
反应ii:
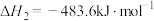
则氨气完全燃烧生成氮气和水蒸气的热化学方程式为___________ 。
III.已知反应i断开化学键所需的能量如下表。
(5)则断开 N—H键所需的能量是
N—H键所需的能量是___________ 。
I.一定条件下,在2 L密闭容器中发生反应:3A(g) + B(g)
 2C(g)。开始时加入4 mol A,6 mol B,2molC,在2 min末测得C的物质的量是3mol。
2C(g)。开始时加入4 mol A,6 mol B,2molC,在2 min末测得C的物质的量是3mol。(1)用A的浓度变化表示反应的平均速率:
(2)在2 min末,B的浓度为
II.某反应过程的能量变化如下图所示。
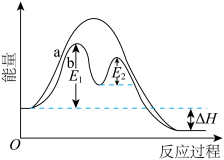
(3)反应过程
(4)①该反应为
②已知:
反应i:

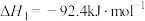
反应ii:

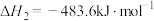
则氨气完全燃烧生成氮气和水蒸气的热化学方程式为
III.已知反应i断开化学键所需的能量如下表。
| 化学键 |  | H—H | N—H |
键能/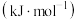 | 945 | 436 | ? |
(5)则断开
 N—H键所需的能量是
N—H键所需的能量是
您最近一年使用:0次
解题方法
2 . Ⅰ.回答下列问题
(1)6.02×1023个CO2与______ mol H2的质量相等。
(2)含0.4 mol Cl-的氯化镁是______ mol,质量是______ g。
(3)4 mol Na2CO3与______ mol Na2SO4所含氧原子数相等。
(4)8 g甲烷(CH4)是______ mol,含______ 个甲烷分子。
(5)相同质量的SO2和SO3的物质的量之比为______ 。
(6)在一密闭容器中充入a mol NO和b mol O2,可发生如下反应:2NO+O2=2NO2,充分反应后容器中氮原子和氧原子的个数之比为______ 。
Ⅱ.向100mLNaOH溶液中通入一定量CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2mol·L-1的盐酸,所得气体的体积与所加盐酸体积的关系如图所示。
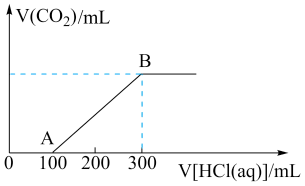
(7)①OA段发生反应的离子方程式为______ 。
②混合溶液中Na2CO3和NaHCO3的物质的量之比为______ 。
(1)6.02×1023个CO2与
(2)含0.4 mol Cl-的氯化镁是
(3)4 mol Na2CO3与
(4)8 g甲烷(CH4)是
(5)相同质量的SO2和SO3的物质的量之比为
(6)在一密闭容器中充入a mol NO和b mol O2,可发生如下反应:2NO+O2=2NO2,充分反应后容器中氮原子和氧原子的个数之比为
Ⅱ.向100mLNaOH溶液中通入一定量CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2mol·L-1的盐酸,所得气体的体积与所加盐酸体积的关系如图所示。

(7)①OA段发生反应的离子方程式为
②混合溶液中Na2CO3和NaHCO3的物质的量之比为
您最近一年使用:0次
3 . 填空。
(1)用20g烧碱配成1000mL溶液,其物质的量浓度为___________ ,从中取出1mL,其中烧碱的物质的量浓度为___________ ,含溶质___________ g,若将这1mL溶液稀释至100mL,所得溶液中溶质的物质的量浓度为___________ 。
(2)标准状况下,500LHC1气体完全溶于1L水中,所得溶液的密度为1.19g/mL,则该溶液的物质的量浓度为___________ (保留一位小数)。
(3)某化合物的相对分子质量为M,在t℃时,amL该化合物的饱和溶液质量为bg,将其蒸干后得到不含结晶水的固体cg,则该化合物在t℃时的溶解度为___________ ,其饱和溶液的物质的量浓度为___________ mol/L。
(1)用20g烧碱配成1000mL溶液,其物质的量浓度为
(2)标准状况下,500LHC1气体完全溶于1L水中,所得溶液的密度为1.19g/mL,则该溶液的物质的量浓度为
(3)某化合物的相对分子质量为M,在t℃时,amL该化合物的饱和溶液质量为bg,将其蒸干后得到不含结晶水的固体cg,则该化合物在t℃时的溶解度为
您最近一年使用:0次
4 . 某固体可能含NaOH、Na2CO3、NaHCO3中的其中二种成分,某实验研究小组取该固体把它配成溶液。用一定浓度的盐酸逐滴加入该溶液中,产生的CO2气体的体积(标准状况下)与加入盐酸的体积示意图如下:
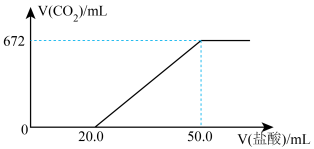
(1)盐酸的物质的量浓度为______________ mol/L;
(2)该固体中两种化合物的物质的量之比为n(Na2CO3):n(NaHCO3)=_________________ 。

(1)盐酸的物质的量浓度为
(2)该固体中两种化合物的物质的量之比为n(Na2CO3):n(NaHCO3)=
您最近一年使用:0次
名校
5 . 向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL1.0mol·L-1的盐酸,恰好使混合物完全溶解并放出约224mL(标准状况)气体,假设溶液体积不变,所得溶液中加入KSCN溶液无血红色出现。请回答下列问题:
(1)生成气体的物质的量为___________ ;
(2)所得溶液中溶质的物质的量浓度为___________ ;
(3)若向溶液中加入氢氧化钠溶液震荡,现象是___________ ;原因是(用方程式表示)___________ ;
(4)若用足量的CO在高温下还原相同质量的该混合物,最多能得到单质铁的质量为___________ ;
(5)原混合物的总质量为___________ 。
(1)生成气体的物质的量为
(2)所得溶液中溶质的物质的量浓度为
(3)若向溶液中加入氢氧化钠溶液震荡,现象是
(4)若用足量的CO在高温下还原相同质量的该混合物,最多能得到单质铁的质量为
(5)原混合物的总质量为
您最近一年使用:0次
2023-10-04更新
|
286次组卷
|
2卷引用:辽宁省沈阳市第十五中学2023-2024学年高一上学期12月月考化学试题
解题方法
6 . 试回答下列问题
(1)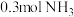 ,分子中所含质子数与
,分子中所含质子数与___________ 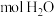 分子中所含质子数相等。
分子中所含质子数相等。
(2)正常人的血液中葡萄糖(简称血糖,分子式为 )的浓度在
)的浓度在 之间,今测得某病人1mL血液中含葡萄糖0.60mg,相当于
之间,今测得某病人1mL血液中含葡萄糖0.60mg,相当于___________ 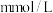 。
。
(3)质量分数为36.5%浓盐酸(密度为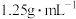 )的物质的量浓度为
)的物质的量浓度为___________ ,若配制250mL 的盐酸,需要量取浓盐酸的体积为
的盐酸,需要量取浓盐酸的体积为___________ mL。
(1)
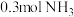 ,分子中所含质子数与
,分子中所含质子数与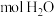 分子中所含质子数相等。
分子中所含质子数相等。(2)正常人的血液中葡萄糖(简称血糖,分子式为
 )的浓度在
)的浓度在 之间,今测得某病人1mL血液中含葡萄糖0.60mg,相当于
之间,今测得某病人1mL血液中含葡萄糖0.60mg,相当于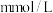 。
。(3)质量分数为36.5%浓盐酸(密度为
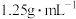 )的物质的量浓度为
)的物质的量浓度为 的盐酸,需要量取浓盐酸的体积为
的盐酸,需要量取浓盐酸的体积为
您最近一年使用:0次
解题方法
7 . 根据题意回答下列问题。
(1)下列属于放热反应的是___________ 。
① 与
与 反应
反应
② 溶于水
溶于水
③
④碳与水蒸气反应
⑤ 与
与 反应
反应
(2)用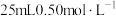 硫酸与
硫酸与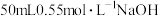 溶液在如图所示的装置中进行中和热的测定。
溶液在如图所示的装置中进行中和热的测定。
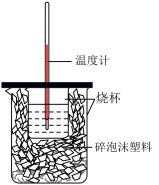
①从实验装置上看,图中尚缺少的一种玻璃仪器是___________ 。
②通过测定,计算出产生的热量为1.42kJ,请写出该反应的中和热的热化学方程式___________ 。
③若用相同浓度和体积的氨水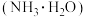 代替NaOH溶液进行上述实验,测得的中和热的数值会
代替NaOH溶液进行上述实验,测得的中和热的数值会___________ (填“偏大”“偏小”或“无影响”)
(3)家用液化气的成分之一是丁烷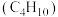 ,当
,当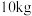 丁烷完全燃烧生成
丁烷完全燃烧生成 和液态水时,放出
和液态水时,放出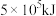 的热量。请写出丁烷燃烧热的热化学反应方程式
的热量。请写出丁烷燃烧热的热化学反应方程式___________ 。
(4)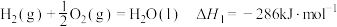
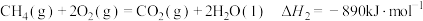
在25℃、101kPa, 和
和 的混合气体
的混合气体 完全燃烧生成
完全燃烧生成 和
和 ,放出热量
,放出热量 的热量。计算该混合气体
的热量。计算该混合气体 和
和 的体积比
的体积比___________ 。
(5)葡萄糖是人体所需能量的重要来源之一,设他在人体组织中完全氧化时的热化学方程式:
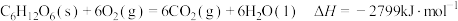 。计算100克葡萄糖在人体组织中完全氧化时产生的热量为
。计算100克葡萄糖在人体组织中完全氧化时产生的热量为___________ 。
(1)下列属于放热反应的是
①
 与
与 反应
反应②
 溶于水
溶于水③

④碳与水蒸气反应
⑤
 与
与 反应
反应(2)用
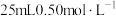 硫酸与
硫酸与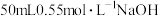 溶液在如图所示的装置中进行中和热的测定。
溶液在如图所示的装置中进行中和热的测定。
①从实验装置上看,图中尚缺少的一种玻璃仪器是
②通过测定,计算出产生的热量为1.42kJ,请写出该反应的中和热的热化学方程式
③若用相同浓度和体积的氨水
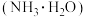 代替NaOH溶液进行上述实验,测得的中和热的数值会
代替NaOH溶液进行上述实验,测得的中和热的数值会(3)家用液化气的成分之一是丁烷
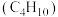 ,当
,当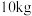 丁烷完全燃烧生成
丁烷完全燃烧生成 和液态水时,放出
和液态水时,放出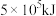 的热量。请写出丁烷燃烧热的热化学反应方程式
的热量。请写出丁烷燃烧热的热化学反应方程式(4)
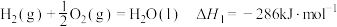
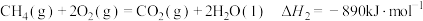
在25℃、101kPa,
 和
和 的混合气体
的混合气体 完全燃烧生成
完全燃烧生成 和
和 ,放出热量
,放出热量 的热量。计算该混合气体
的热量。计算该混合气体 和
和 的体积比
的体积比(5)葡萄糖是人体所需能量的重要来源之一,设他在人体组织中完全氧化时的热化学方程式:
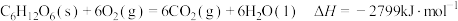 。计算100克葡萄糖在人体组织中完全氧化时产生的热量为
。计算100克葡萄糖在人体组织中完全氧化时产生的热量为
您最近一年使用:0次
名校
8 . 回答下列问题
(1)标准状况下3.4gNH3与标准状况下_______ LH2S气体含有相同数目的氢原子数。
(2)19g某二价金属的氯化物RCl2中含有0.4mol的Cl-,则R的相对原子质量为_______ 。
(3)如图是某品牌饮用矿物质水的标签的部分内容。
请认真阅读标签内容,计算:
①镁离子的物质的量浓度的最大值是_______ 。
②一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过_______ mol。
(4)VLFe2(SO4)3溶液中含Fe3+mg,则溶液中SO 的物质的量浓度为
的物质的量浓度为_______ mol/L。
(5)在RO 中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是_______ 。
(1)标准状况下3.4gNH3与标准状况下
(2)19g某二价金属的氯化物RCl2中含有0.4mol的Cl-,则R的相对原子质量为
(3)如图是某品牌饮用矿物质水的标签的部分内容。
| 配料表:纯净水、硫酸镁、氯化钾 保质期:12个月 主要成分: 钾离子(K+):1.0~27.3mg/L 镁离子(Mg2+):0.1~4.8mg/L 氯离子(Cl-):10~27.3mg/L 硫酸根离子(SO  ):0.4~19.2mg/L ):0.4~19.2mg/L |
①镁离子的物质的量浓度的最大值是
②一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过
(4)VLFe2(SO4)3溶液中含Fe3+mg,则溶液中SO
 的物质的量浓度为
的物质的量浓度为(5)在RO
 中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
您最近一年使用:0次
2023-08-26更新
|
188次组卷
|
2卷引用:辽宁省大连市第八中学2022-2023学年高一上学期12月月考化学试题
名校
9 . “84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶84消毒液,该消毒液通常稀释到100倍(体积比)使用。查阅相关资料和消毒液包装说明得到如图信息:
(1)该84消毒液NaClO物质的量浓度约为_______ (保留1位小数)。
(2)该同学参阅该84消毒液的配方,欲用NaClO固体配制480mL该种84消毒液。下列说法不正确的是_______ (填字母)。
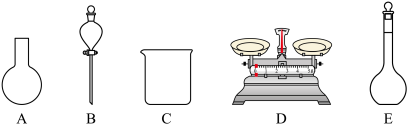
A.如图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.使用前要检查容量瓶是否漏液
C.容量瓶上标有容积、温度和浓度
D.需要称量NaClO固体的质量为149.0g
E.容量瓶用蒸馏水洗净后,须烘干后再使用
(3)一瓶上述84消毒液理论上能吸收空气中_______ L的CO2(标准状况下)而变质。(已知:CO2+NaClO+H2O=NaHCO3+HClO)
(4)84消毒液与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因_______ ,某消毒小组人员用18.4mol·L-1的浓硫酸配制500mL2.3mol·L-1的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为_______ mL。
(5)在配制过程中,下列操作中能使所配溶液的浓度偏高的有_______ (填代号)。
①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
| 84消毒液 (有效成分)NaClO (规格)1000mL (质量分数)25% (密度)1.19g/cm3 |
(1)该84消毒液NaClO物质的量浓度约为
(2)该同学参阅该84消毒液的配方,欲用NaClO固体配制480mL该种84消毒液。下列说法不正确的是

A.如图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.使用前要检查容量瓶是否漏液
C.容量瓶上标有容积、温度和浓度
D.需要称量NaClO固体的质量为149.0g
E.容量瓶用蒸馏水洗净后,须烘干后再使用
(3)一瓶上述84消毒液理论上能吸收空气中
(4)84消毒液与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因
(5)在配制过程中,下列操作中能使所配溶液的浓度偏高的有
①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
您最近一年使用:0次
2023-08-26更新
|
284次组卷
|
2卷引用:辽宁省大连市第八中学2022-2023学年高一上学期12月月考化学试题
10 . 回答下列问题。
(1)标准状况下,0.8g 与
与_______ 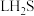 含有相同的氢原子数。
含有相同的氢原子数。
(2)19g某二价金属的氯化物 中含有0.4mol的
中含有0.4mol的 ,则R的摩尔质量为
,则R的摩尔质量为_______ 。
(3)如图是“康师傅”牌饮用矿泉水的标签的部分内容。
请认真阅读标签内容,计算:一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过_____ mol。
(4)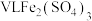 溶液中含
溶液中含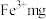 ,则溶液中
,则溶液中 的物质的量浓度为
的物质的量浓度为_______  ,若取出V/3L溶液,又加水稀释到溶液体积为2VL,则此时
,若取出V/3L溶液,又加水稀释到溶液体积为2VL,则此时 的物质的量浓度为
的物质的量浓度为_______ 。
(5)如果定义1mol粒子的集合体的数目约为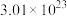 ,那么此时标准状况下,气体摩尔体积的数值约为
,那么此时标准状况下,气体摩尔体积的数值约为_______ L/mol,标准状况下,3.36L 的质量是
的质量是_______ g。
(1)标准状况下,0.8g
 与
与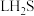 含有相同的氢原子数。
含有相同的氢原子数。(2)19g某二价金属的氯化物
 中含有0.4mol的
中含有0.4mol的 ,则R的摩尔质量为
,则R的摩尔质量为(3)如图是“康师傅”牌饮用矿泉水的标签的部分内容。
| 康师傅饮用矿物质水 净含量:500mL 配料表:纯净水 硫酸镁 氯化钾 保质期:12个月 主要成分: 钾离子(  ):1.0~27.3mg/L ):1.0~27.3mg/L镁离子(  ):0.1~4.8mg/L ):0.1~4.8mg/L氯离子(  ):10~27.3mg/L ):10~27.3mg/L硫酸根离子(  ):0.4~19.2mg/L ):0.4~19.2mg/L |
(4)
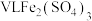 溶液中含
溶液中含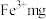 ,则溶液中
,则溶液中 的物质的量浓度为
的物质的量浓度为 ,若取出V/3L溶液,又加水稀释到溶液体积为2VL,则此时
,若取出V/3L溶液,又加水稀释到溶液体积为2VL,则此时 的物质的量浓度为
的物质的量浓度为(5)如果定义1mol粒子的集合体的数目约为
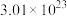 ,那么此时标准状况下,气体摩尔体积的数值约为
,那么此时标准状况下,气体摩尔体积的数值约为 的质量是
的质量是
您最近一年使用:0次



