名校
解题方法
1 . 近年来,“氮排放”逐渐引起人们的重视。氮及其化合物与生产生活及环境息息相关,请回答下列问题:
(1)下列环境问题与氮的氧化物排放无关的是___________。
(2)汽车尾气中存在NO和CO,通过在排气管处加装催化剂,可以使其转化为对环境友好的物质,请写出发生反应的化学方程式___________ 。
(3)硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。
①工业生产中为了盛装大量浓硝酸,可选择___________ 作为罐体材料。
A.Mg B.Al C.Fe D.Cu
②为避免硝酸生产尾气中的NO2污染环境,可以使用具有碱性的碳酸钠溶液吸收,发生反应的离子方程式为___________ 。
③硝酸与金属反应会产生氮氧化物。在含有agHNO3的稀硝酸中,加入bg铁粉充分反应, 铁全部溶解并生成NO,有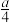 gHNO3被还原,则a:b可能为
gHNO3被还原,则a:b可能为___________ 。
A.2:1 B.3:1 C.4:1 D.8:3
(4)氮化硅(Si3N4)陶瓷材料可用于高温工程的部件、冶金工业等方面的高级耐火材料,可由石英与焦炭在高温的氮气流中制备,反应的化学方程式为___________ 。
(5)氮的同族元素锑(Sb)可形成比纯硫酸更强的酸——氟锑酸(HSbF6),称为超酸。为更好地理解超酸的强酸性,实验小组查阅相关资料了解到:弱酸在强酸性溶剂中表现出碱的性质,如冰醋酸与纯硫酸之间的化学反应方程式为:CH3COOH+H2SO4=[CH3C(OH)2]+[HSO4]-。以此类推,H2SO4与HSbF6之间的化学反应方程式为___________ 。
(1)下列环境问题与氮的氧化物排放无关的是___________。
| A.酸雨 | B.光化学烟雾 | C.臭氧层空洞 | D.白色污染 |
(3)硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。
①工业生产中为了盛装大量浓硝酸,可选择
A.Mg B.Al C.Fe D.Cu
②为避免硝酸生产尾气中的NO2污染环境,可以使用具有碱性的碳酸钠溶液吸收,发生反应的离子方程式为
③硝酸与金属反应会产生氮氧化物。在含有agHNO3的稀硝酸中,加入bg铁粉充分反应, 铁全部溶解并生成NO,有
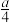 gHNO3被还原,则a:b可能为
gHNO3被还原,则a:b可能为A.2:1 B.3:1 C.4:1 D.8:3
(4)氮化硅(Si3N4)陶瓷材料可用于高温工程的部件、冶金工业等方面的高级耐火材料,可由石英与焦炭在高温的氮气流中制备,反应的化学方程式为
(5)氮的同族元素锑(Sb)可形成比纯硫酸更强的酸——氟锑酸(HSbF6),称为超酸。为更好地理解超酸的强酸性,实验小组查阅相关资料了解到:弱酸在强酸性溶剂中表现出碱的性质,如冰醋酸与纯硫酸之间的化学反应方程式为:CH3COOH+H2SO4=[CH3C(OH)2]+[HSO4]-。以此类推,H2SO4与HSbF6之间的化学反应方程式为
您最近一年使用:0次
2024-04-30更新
|
126次组卷
|
2卷引用:湖北省新高考联考协作体2023-2024学年高一下学期期中考试化学试题(A)
名校
2 . 完成下列问题
(1)现有 、
、 和
和 组成的混合物,某研究性学习小组为了探究其组成情况,加入
组成的混合物,某研究性学习小组为了探究其组成情况,加入 溶液恰好使混合物完全溶解,同时收集到
溶液恰好使混合物完全溶解,同时收集到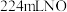 气体(标况)。则产物中硝酸铜的物质的量为
气体(标况)。则产物中硝酸铜的物质的量为___________ 。如原混合物中有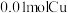 ,则其中
,则其中 与
与 的质量之比为
的质量之比为___________ 。
(2)将一定质量的铜粉加入到 某浓度的稀硝酸中,充分反应后,容器中剩有
某浓度的稀硝酸中,充分反应后,容器中剩有 铜粉,此时共收集到
铜粉,此时共收集到 气体
气体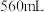 (标准状况)。然后向上述混合物中加入足量稀硫酸至不再反应为止,容器仍剩有铜粉
(标准状况)。然后向上述混合物中加入足量稀硫酸至不再反应为止,容器仍剩有铜粉 ,则
,则 为
为___________ 。
(3)将铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成 的体积和剩余金属的质量如下表(设硝酸的还原产物只有
的体积和剩余金属的质量如下表(设硝酸的还原产物只有 )。
)。
①稀硝酸的物质的量的浓度为___________  。
。
②V=___________ 。
(1)现有
 、
、 和
和 组成的混合物,某研究性学习小组为了探究其组成情况,加入
组成的混合物,某研究性学习小组为了探究其组成情况,加入 溶液恰好使混合物完全溶解,同时收集到
溶液恰好使混合物完全溶解,同时收集到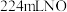 气体(标况)。则产物中硝酸铜的物质的量为
气体(标况)。则产物中硝酸铜的物质的量为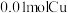 ,则其中
,则其中 与
与 的质量之比为
的质量之比为(2)将一定质量的铜粉加入到
 某浓度的稀硝酸中,充分反应后,容器中剩有
某浓度的稀硝酸中,充分反应后,容器中剩有 铜粉,此时共收集到
铜粉,此时共收集到 气体
气体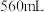 (标准状况)。然后向上述混合物中加入足量稀硫酸至不再反应为止,容器仍剩有铜粉
(标准状况)。然后向上述混合物中加入足量稀硫酸至不再反应为止,容器仍剩有铜粉 ,则
,则 为
为(3)将铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成
 的体积和剩余金属的质量如下表(设硝酸的还原产物只有
的体积和剩余金属的质量如下表(设硝酸的还原产物只有 )。
)。| 编号 | ① | ② | ③ | ④ |
硝酸体积 | 100 | 200 | 300 | 400 |
剩余金属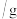 | 18.0 |  | 0 | 0 |
 体积 体积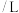 | 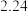 |  | 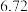 | V |
 。
。②V=
您最近一年使用:0次
名校
解题方法
3 . 电化学广泛应用于工业生产和环境保护上。
(1)全钒液流电池是化学储能领域的一个研究热点,储能容量大、使用寿命长。利用该电池电解处理含 的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
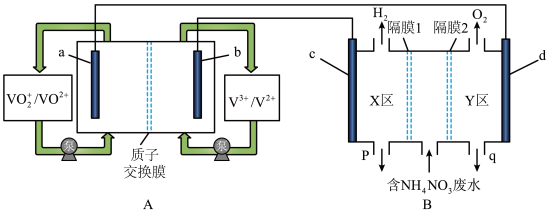
①全钒液流电池放电时,a电极反应式为___________ ,电子的流向由___________ (填“a→导线→d”或“d→导线→a”)。
②隔膜1为___________ 离子交换膜(填“阴”或“阳”),装置B中q口流出液中主要的溶质为___________ (填化学式),d电极的电极反应式为___________ 。
③当装置A中有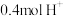 通过质子交换膜时,则装置B中产生气体的总体积为
通过质子交换膜时,则装置B中产生气体的总体积为___________ L(标准状况下),处理___________ 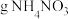 。
。
(2)用电解法可除去硝酸工业产生的尾气NO,并得到 ,工作原理如下图。
,工作原理如下图。
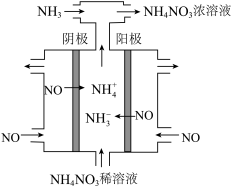
理论上通入 与NO的最佳物质的量之比为
与NO的最佳物质的量之比为___________ 。
(1)全钒液流电池是化学储能领域的一个研究热点,储能容量大、使用寿命长。利用该电池电解处理含
 的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
①全钒液流电池放电时,a电极反应式为
②隔膜1为
③当装置A中有
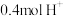 通过质子交换膜时,则装置B中产生气体的总体积为
通过质子交换膜时,则装置B中产生气体的总体积为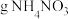 。
。(2)用电解法可除去硝酸工业产生的尾气NO,并得到
 ,工作原理如下图。
,工作原理如下图。
理论上通入
 与NO的最佳物质的量之比为
与NO的最佳物质的量之比为
您最近一年使用:0次
4 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:____
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:____ ___
___ ___=___
___=___ ___
___ ___
___ ___
___ ___
___ 。
。
(1)请完成该离子方程式并配平___________ 。
(2)从物质分类角度来看, 是
是___________ (填字母代号)。
a.酸 b.酸式盐 c.碱 d.非电解质 e.电解质 f.钠盐
(3)用上述反应来处理 开不是最佳方法,其原因是
开不是最佳方法,其原因是___________ 。从环保角度来讲,要将 转化为氮气,所用物质的
转化为氮气,所用物质的___________ 填“氧化性”或“还原性”)应该比KI更___________ (填“强”或“弱”)。
(4)下列方法不能用来区分固体 和NaCl的是___________(填序号)
和NaCl的是___________(填序号)
(5)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 车转化为
车转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列:
表现出的性质与下列:___________ (填序号)反应中 表现出的性质相同。
表现出的性质相同。
A.
B.
C.
(6) 可以与
可以与 反应制备
反应制备 纳米颗粒。若
纳米颗粒。若 与
与 的系数之比为1∶2,配平该反应的离子方程式:
的系数之比为1∶2,配平该反应的离子方程式:___________ 。
____ _____
_____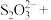 _____
_____ ____
____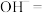 ____
____ ______
______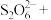 _____
_____
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:____
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:____ ___
___ ___=___
___=___ ___
___ ___
___ ___
___ ___
___ 。
。(1)请完成该离子方程式并配平
(2)从物质分类角度来看,
 是
是a.酸 b.酸式盐 c.碱 d.非电解质 e.电解质 f.钠盐
(3)用上述反应来处理
 开不是最佳方法,其原因是
开不是最佳方法,其原因是 转化为氮气,所用物质的
转化为氮气,所用物质的(4)下列方法不能用来区分固体
 和NaCl的是___________(填序号)
和NaCl的是___________(填序号)| A.分别溶于水,滴加酚酞试液 | B.分别溶于水并滴加 酸化的 酸化的 溶液 溶液 |
| C.分别加强热并收集气体检验 | D.用筷子分别蘸取固体品尝味道 |
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 车转化为
车转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列:
表现出的性质与下列: 表现出的性质相同。
表现出的性质相同。A.

B.

C.

(6)
 可以与
可以与 反应制备
反应制备 纳米颗粒。若
纳米颗粒。若 与
与 的系数之比为1∶2,配平该反应的离子方程式:
的系数之比为1∶2,配平该反应的离子方程式:____
 _____
_____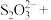 _____
_____ ____
____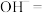 ____
____ ______
______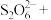 _____
_____
您最近一年使用:0次
名校
5 . 按要求填写下列空白:
(1) 个
个 的质量为
的质量为___________ g。
(2)标况下, 的摩尔质量为
的摩尔质量为___________ ,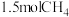 质量为
质量为___________ 。
(3)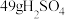 含有
含有___________ 个氢原子,共含有___________ 个原子。
(4)已知标准状况下 的密度为
的密度为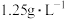 ,X原子最外层有
,X原子最外层有___________ 个电子。
(5)现有下列物质:① 晶体,②石墨,③无水乙醇,④小苏打,⑤熔融
晶体,②石墨,③无水乙醇,④小苏打,⑤熔融 ,⑥醋(乙)酸,⑦液氨,⑧稀硫酸,⑨
,⑥醋(乙)酸,⑦液氨,⑧稀硫酸,⑨ 固体,⑩
固体,⑩ 红褐色胶体其中属于电解质的是:
红褐色胶体其中属于电解质的是:___________ ,能导电的物质是:___________ 。(填序号)
(1)
 个
个 的质量为
的质量为(2)标况下,
 的摩尔质量为
的摩尔质量为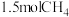 质量为
质量为(3)
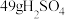 含有
含有(4)已知标准状况下
 的密度为
的密度为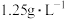 ,X原子最外层有
,X原子最外层有(5)现有下列物质:①
 晶体,②石墨,③无水乙醇,④小苏打,⑤熔融
晶体,②石墨,③无水乙醇,④小苏打,⑤熔融 ,⑥醋(乙)酸,⑦液氨,⑧稀硫酸,⑨
,⑥醋(乙)酸,⑦液氨,⑧稀硫酸,⑨ 固体,⑩
固体,⑩ 红褐色胶体其中属于电解质的是:
红褐色胶体其中属于电解质的是:
您最近一年使用:0次
6 . 请回答下列问题:
(1)已知实验室制备氧气可以用加热高锰酸钾的方法实现,其发生的反应为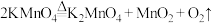 ,氧化产物是
,氧化产物是___________ (填化学式)。
(2)查阅资料可知,铜和浓 共热,发生反应
共热,发生反应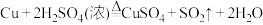 ,该反应中还原剂与氧化剂的物质的量之比为
,该反应中还原剂与氧化剂的物质的量之比为___________ ,其中 在反应中表现的性质为
在反应中表现的性质为___________ 。
(3)已知反应
① ;
;
②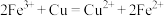 ;
;
③ ;
;
④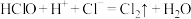 。
。
微粒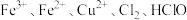 氧化性由强到弱的顺序为
氧化性由强到弱的顺序为___________
(4)请配平下列反应方程式:___________
___________ ___________
___________ (浓)=___________
(浓)=___________ ___________
___________ ___________
___________ ___________
___________
若反应中发生氧化反应的 物质的量为
物质的量为 ,则反应中转移的电子数为
,则反应中转移的电子数为___________ 。
(1)已知实验室制备氧气可以用加热高锰酸钾的方法实现,其发生的反应为
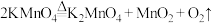 ,氧化产物是
,氧化产物是(2)查阅资料可知,铜和浓
 共热,发生反应
共热,发生反应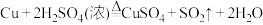 ,该反应中还原剂与氧化剂的物质的量之比为
,该反应中还原剂与氧化剂的物质的量之比为 在反应中表现的性质为
在反应中表现的性质为(3)已知反应
①
 ;
;②
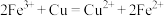 ;
;③
 ;
;④
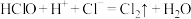 。
。微粒
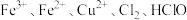 氧化性由强到弱的顺序为
氧化性由强到弱的顺序为(4)请配平下列反应方程式:
___________
 ___________
___________ (浓)=___________
(浓)=___________ ___________
___________ ___________
___________ ___________
___________
若反应中发生氧化反应的
 物质的量为
物质的量为 ,则反应中转移的电子数为
,则反应中转移的电子数为
您最近一年使用:0次
名校
解题方法
7 . 钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
(1)将2.6g CO和0.3g 在足量的氧气中充分燃烧,使生成的
在足量的氧气中充分燃烧,使生成的 和水蒸气通过过量的过氧化钠,上述反应完成后,固体的质量增加了
和水蒸气通过过量的过氧化钠,上述反应完成后,固体的质量增加了___________ g。
(2)向KOH溶液中通入一定量的 ,再继续向溶液中逐滴加入稀盐酸,标准状况下产生的
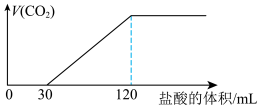
,再继续向溶液中逐滴加入稀盐酸,标准状况下产生的 气体体积与所加的盐酸溶液体积之间的关系如图所示,则原KOH溶液中通入
气体体积与所加的盐酸溶液体积之间的关系如图所示,则原KOH溶液中通入 后,所得溶液中的溶质为
后,所得溶液中的溶质为___________ (写化学式)。其对应的物质的量浓度之比为___________ 。
(3)我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献,下图为联合制碱法的主要过程(部分物质已略去)。
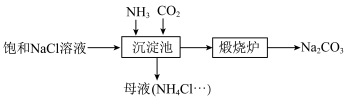
已知:ⅰ. 极易溶于水并生成碱,与酸反应生成盐,如
极易溶于水并生成碱,与酸反应生成盐,如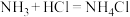 。
。
ⅱ.有关物质的溶解度(20℃)
则沉淀池中主要沉淀物___________ (化学式),发生反应的离子方程式为___________ 。
(1)将2.6g CO和0.3g
 在足量的氧气中充分燃烧,使生成的
在足量的氧气中充分燃烧,使生成的 和水蒸气通过过量的过氧化钠,上述反应完成后,固体的质量增加了
和水蒸气通过过量的过氧化钠,上述反应完成后,固体的质量增加了(2)向KOH溶液中通入一定量的
 ,再继续向溶液中逐滴加入稀盐酸,标准状况下产生的
,再继续向溶液中逐滴加入稀盐酸,标准状况下产生的 气体体积与所加的盐酸溶液体积之间的关系如图所示,则原KOH溶液中通入
气体体积与所加的盐酸溶液体积之间的关系如图所示,则原KOH溶液中通入 后,所得溶液中的溶质为
后,所得溶液中的溶质为
(3)我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献,下图为联合制碱法的主要过程(部分物质已略去)。

已知:ⅰ.
 极易溶于水并生成碱,与酸反应生成盐,如
极易溶于水并生成碱,与酸反应生成盐,如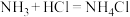 。
。ⅱ.有关物质的溶解度(20℃)
| 物质 | NaCl |  |  |  |
| 溶解度/g | 36.0 | 21.7 | 9.6 | 37.2 |
您最近一年使用:0次
名校
解题方法
8 . 按要求填空:
情境一:在酸性条件下,黄铁矿(FeS2,其中S为-1价)催化氧化的反应转化如图所示。
总反应:2FeS2+7O2+2H2O=2Fe2++4 +4H+
+4H+

(1)已知Ⅲ为非氧化还原反应,分别写出反应Ⅰ、Ⅱ的离子方程式:
①反应Ⅰ:___________ 。
②反应Ⅱ:___________ 。
(2)NO在总反应中的作用是___________ 。
情境二:高纯度LiMn2O4(Li元素的化合价为+1价,O元素的化合价为-2价)是锂电池重要的正极材料。
(3)工业上有一种制取高纯度LiMn2O4的方法如下:
①由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)、硫酸钾和硫酸,发生反应的化学方程式为:___________ 。
②过滤、干燥得到球形二氧化锰,再与氢氧化锂750℃共热5小时得到LiMn2O4、H2O和一种气体。请写出该反应的化学方程式:___________ 。
(4)氢氧化锂容易与二氧化碳反应,工业上常用碳酸锂代替。把分析纯碳酸锂与球形二氧化锰两种粉末,按个数比1:4混合均匀加热。
①升温到515℃时,开始有CO2产生,同时生成固体Li2O。
②升温到566℃时,MnO2分解产生O2,O2的个数恰好与CO2的个数相等,同时得到固体X,固体X的化学式是___________ 。
③升温到720℃时,Li2O、X参加反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的LiMn2O4.,该反应中氧化剂是___________ 。
情境一:在酸性条件下,黄铁矿(FeS2,其中S为-1价)催化氧化的反应转化如图所示。
总反应:2FeS2+7O2+2H2O=2Fe2++4
 +4H+
+4H+
(1)已知Ⅲ为非氧化还原反应,分别写出反应Ⅰ、Ⅱ的离子方程式:
①反应Ⅰ:
②反应Ⅱ:
(2)NO在总反应中的作用是
情境二:高纯度LiMn2O4(Li元素的化合价为+1价,O元素的化合价为-2价)是锂电池重要的正极材料。
(3)工业上有一种制取高纯度LiMn2O4的方法如下:
①由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)、硫酸钾和硫酸,发生反应的化学方程式为:
②过滤、干燥得到球形二氧化锰,再与氢氧化锂750℃共热5小时得到LiMn2O4、H2O和一种气体。请写出该反应的化学方程式:
(4)氢氧化锂容易与二氧化碳反应,工业上常用碳酸锂代替。把分析纯碳酸锂与球形二氧化锰两种粉末,按个数比1:4混合均匀加热。
①升温到515℃时,开始有CO2产生,同时生成固体Li2O。
②升温到566℃时,MnO2分解产生O2,O2的个数恰好与CO2的个数相等,同时得到固体X,固体X的化学式是
③升温到720℃时,Li2O、X参加反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的LiMn2O4.,该反应中氧化剂是
您最近一年使用:0次
2023-11-04更新
|
295次组卷
|
2卷引用:湖北省荆州市沙市中学2023-2024学年高一上学期11月期中考试化学试题
9 . 回答下列问题
(1)标准状况下112mL气体A的质量为0.32g,则A气体的摩尔质量为____ 。
(2)标准状况下有四种气体:①6.72LC2H6;②3.01×1024个HCl分子;③0.2molH2S;④10.2gNH3。各气体中氢原子数的大小顺序为(用①②③④表示):______________ 。
(3)在300mL由NaCl、MgCl2、AlCl3组成的混合液中,部分离子浓度大小如图所示,回答下列问题。

①该混合液中AlCl3的物质的量为____ mol。将该混合液加水稀释至体积为500mL,稀释后溶液中Al3+物质的量浓度为______ mol/L。
②向①中稀释后的溶液中加入过量氢氧化钠溶液,则发生反应的离子方程式为:_________ ;最终可得到沉淀质量为________ 。
(1)标准状况下112mL气体A的质量为0.32g,则A气体的摩尔质量为
(2)标准状况下有四种气体:①6.72LC2H6;②3.01×1024个HCl分子;③0.2molH2S;④10.2gNH3。各气体中氢原子数的大小顺序为(用①②③④表示):
(3)在300mL由NaCl、MgCl2、AlCl3组成的混合液中,部分离子浓度大小如图所示,回答下列问题。

①该混合液中AlCl3的物质的量为
②向①中稀释后的溶液中加入过量氢氧化钠溶液,则发生反应的离子方程式为:
您最近一年使用:0次
10 . 根据要求,回答下列问题:
(1)0.2 L0.5 mol/LFeCl3溶液中的Cl-的物质的量浓度为_____ 。
(2)同质量的 和
和 中所含
中所含 原子个数比为
原子个数比为_____ 。
(3)现有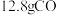 和
和 的混合气体,在标准状况下所占的体积约为
的混合气体,在标准状况下所占的体积约为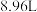 。
。
Ⅰ.该混合气体的平均摩尔质量为_____ 。
Ⅱ.混合气体中碳原子的个数为_____ (用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
Ⅲ.将混合气体依次通过如图装置,最后收集在气球中。
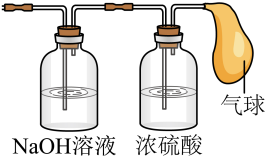
①气球中收集到的气体的质量为_____ ;
②气球中收集到的气体在标准状况下的体积为_____ ;
③气球中收集到的气体的电子总数为_____ (用NA表示阿伏加德罗常数的值)。
(1)0.2 L0.5 mol/LFeCl3溶液中的Cl-的物质的量浓度为
(2)同质量的
 和
和 中所含
中所含 原子个数比为
原子个数比为(3)现有
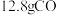 和
和 的混合气体,在标准状况下所占的体积约为
的混合气体,在标准状况下所占的体积约为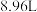 。
。Ⅰ.该混合气体的平均摩尔质量为
Ⅱ.混合气体中碳原子的个数为
 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。Ⅲ.将混合气体依次通过如图装置,最后收集在气球中。

①气球中收集到的气体的质量为
②气球中收集到的气体在标准状况下的体积为
③气球中收集到的气体的电子总数为
您最近一年使用:0次



