解题方法
1 . 如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容。某同学从该试剂瓶中取出24.0g固体,配成1L溶液,请计算
(1)所得氢氧化钠溶液的物质的量浓度________________ 。
(2)从所得氢氧化钠溶液中取出200mL于一烧杯中,恰好和100mL盐酸反应,求盐酸的浓度________________ 。(写出解答步骤)
| 氢氧化钠 化学纯(CP) 500g 品名:氢氧化钠 化学式:NaOH 式量:40.0 |
(2)从所得氢氧化钠溶液中取出200mL于一烧杯中,恰好和100mL盐酸反应,求盐酸的浓度
您最近一年使用:0次
2 . 太空很神秘,水的世界也深不可测,从水作溶剂、水分子运动到水的电离、水与活泼金属反应等等。结合书本知识,回答下列问题:
(1)标准状况下, 的
的 溶液的
溶液的
_______ (填“>”“<”或“=”,下同)12,该温度下,水的离子积常数
_______ 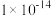 。
。
(2)某温度下,纯水中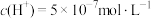 ,则此时纯水中的
,则此时纯水中的
_______  ;若温度不变,滴入稀硫酸使
;若温度不变,滴入稀硫酸使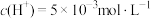 ,则
,则
_______  。
。
(3)T℃下,水的离子积曲线如图所示。

①下列说法正确的是_______ (填字母)。
a.T℃小于
b.A点溶液
c.B点溶液呈碱性
d.保持温度不变,加入少量的酸可以实现从B点到C点的变化
②该温度下,将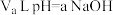 溶液与
溶液与 硫酸混合。
硫酸混合。
若所得混合溶液呈中性,且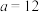 ,
, ,则
,则
_______ ;若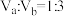 ,且
,且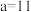 ,
,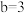 ,则所得混合溶液的
,则所得混合溶液的
_______ 。
(1)标准状况下,
 的
的 溶液的
溶液的

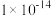 。
。(2)某温度下,纯水中
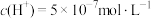 ,则此时纯水中的
,则此时纯水中的
 ;若温度不变,滴入稀硫酸使
;若温度不变,滴入稀硫酸使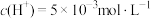 ,则
,则
 。
。(3)T℃下,水的离子积曲线如图所示。

①下列说法正确的是
a.T℃小于

b.A点溶液

c.B点溶液呈碱性
d.保持温度不变,加入少量的酸可以实现从B点到C点的变化
②该温度下,将
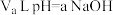 溶液与
溶液与 硫酸混合。
硫酸混合。若所得混合溶液呈中性,且
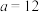 ,
, ,则
,则
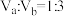 ,且
,且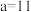 ,
,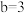 ,则所得混合溶液的
,则所得混合溶液的
您最近一年使用:0次
名校
解题方法
3 . 铝、氧化铝的性质与其他常见金属及氧化物相比,有一定的特殊性。
(1)可用NaOH溶液除去铁粉中的铝粉,反应原理是(用离子方程式表示)___________ ,将2.7gAl分别置于足量的NaOH溶液、稀硫酸中,生成H2的体积之比(同温同压)为___________ 。
(2)证明Al2O3是两性氧化物的常用试剂是___________ (填名称),将ag废铝片置于100mL盐酸中,测得反应过程中生成氢气体积(标准状况)与时间的关系如图所示:0~t1时间段无气体生成的原因是___________ ,若反应后所得溶液中n(Al3+)=0.102mol且盐酸恰好完全反应,则原溶液中c(HCl)=___________ 。
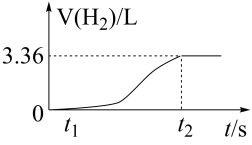
(1)可用NaOH溶液除去铁粉中的铝粉,反应原理是(用离子方程式表示)
(2)证明Al2O3是两性氧化物的常用试剂是

您最近一年使用:0次
2022-06-22更新
|
336次组卷
|
4卷引用:黑龙江省绥化市绥棱县第一中学2021-2022学年高一上学期12月月考化学试题
4 . 一定量的Fe 、Cu的混合物粉末,平均分成五等份,分别向每一份中加入一定量的稀硝酸,实验中收集到的NO气体(唯一还原产物)的体积与所得到剩余固体质量记录如表(所有的气体的体积均在标准状况下测定)
(1)该实验中所用的硝酸的物质的量浓度为_______ mol/L
(2)第1次实验后剩余固体的成分为_______ ,第2次实验后剩余固体的成分为_______ (以上两空均填化学式)
(3)V=_______ L
| 实验序号 | 1 | 2 | 3 | 4 | 5 |
| HNO3溶液的体积(mL) | 100 | 200 | 300 | 400 | 500 |
| 剩余固体的质量(g) | 17.2 | 8 | 0 | 0 | 0 |
| 气体的体积(L) | 2.24 | 4.48 | V | 7.84 | 7.84 |
(1)该实验中所用的硝酸的物质的量浓度为
(2)第1次实验后剩余固体的成分为
(3)V=
您最近一年使用:0次
2021-07-30更新
|
594次组卷
|
2卷引用:黑龙江省望奎县第一中学2022-2023学年高三上学期第一次月考化学试题
解题方法
5 . 在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)⇌3C(g)+nD(g),开始时A为4mol,B为6mol,5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。计算:
(1)5 min末A的物质的量浓度为_______ ,A的转化率为_______ 。
(2)前5 min内用B表示的化学反应速率v(B)为_______ 。
(3)化学方程式中n=_______ 。
(4)此反应在四种不同情况下的反应速率分别为:①v(A)=5 mol·L-1·min-1②v(B)=6 mol·L-1·min-1③v(C)=0.2 mol·L-1·s-1④v(D)=8 mol·L-1·min-1。其中反应速率最快的是_______ (填序号)。
(1)5 min末A的物质的量浓度为
(2)前5 min内用B表示的化学反应速率v(B)为
(3)化学方程式中n=
(4)此反应在四种不同情况下的反应速率分别为:①v(A)=5 mol·L-1·min-1②v(B)=6 mol·L-1·min-1③v(C)=0.2 mol·L-1·s-1④v(D)=8 mol·L-1·min-1。其中反应速率最快的是
您最近一年使用:0次
2021-06-23更新
|
734次组卷
|
2卷引用:黑龙江省绥化市明水县第一中学2020-2021学年高一下学期第二次月考化学试题
6 . 请按要求填写下列空白:
(1)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是11∶4,则A的相对分子质量为________ 。
(2)在V L Al2(SO4)3溶液中,测得含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为___________ mol/L, 的物质的量浓度为
的物质的量浓度为___________ mol/L。
(3)将5.3 g Na2CO3溶于水配成1 L溶液,要使Na+浓度变为0.2 mol/L,需要加入NaCl固体质量为___________ g
(4)实验测得CO和O2混合气体的密度是氢气的15.5倍,其中氧气的体积分数为___________ 。
(5)物质的量相等的乙烯(C2H4)和丙烯(C3H6)的平均摩尔质量为___________
(6)在KCl和CaCl2的混合物中,K+和Ca2+的物质的量之比为2∶1,含1 mol氯离子的该混合物的质量为___________ g。
(1)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是11∶4,则A的相对分子质量为
(2)在V L Al2(SO4)3溶液中,测得含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为
 的物质的量浓度为
的物质的量浓度为(3)将5.3 g Na2CO3溶于水配成1 L溶液,要使Na+浓度变为0.2 mol/L,需要加入NaCl固体质量为
(4)实验测得CO和O2混合气体的密度是氢气的15.5倍,其中氧气的体积分数为
(5)物质的量相等的乙烯(C2H4)和丙烯(C3H6)的平均摩尔质量为
(6)在KCl和CaCl2的混合物中,K+和Ca2+的物质的量之比为2∶1,含1 mol氯离子的该混合物的质量为
您最近一年使用:0次
名校
解题方法
7 . 将7.8 g Na2O2投入水中充分反应,冷却,最终将溶液转移到500 mL容量瓶中定容。则Na2O2的物质的量为____ ;反应后溶液中溶质的化学式为_____ ,其物质的量为_____ ,其物质的量浓度为______ ;反应过程中产生气体在标准状况(SPT)下的体积为______ 。
您最近一年使用:0次
2020-12-07更新
|
164次组卷
|
2卷引用:黑龙江安达市第七中学校2020-2021学年高一上学期期中考试化学试题
解题方法
8 . 已知:lg2=0.3 lg5=0.7。回答下列问题:
(1)室温下,某H2SO4溶液的浓度是0.005mol·L-1,则该溶液的pH=________ 。
(2)室温下,pH=3的盐酸与pH=5的H2SO4溶液等体积混合(忽略体积变化),混合溶液的pH=__________ 。
(3)室温下,pH=2的盐酸和pH=13的NaOH溶液混合(忽略体积变化),混合溶液的pH=11,则盐酸与NaOH溶液的体积比为_________ 。
(1)室温下,某H2SO4溶液的浓度是0.005mol·L-1,则该溶液的pH=
(2)室温下,pH=3的盐酸与pH=5的H2SO4溶液等体积混合(忽略体积变化),混合溶液的pH=
(3)室温下,pH=2的盐酸和pH=13的NaOH溶液混合(忽略体积变化),混合溶液的pH=11,则盐酸与NaOH溶液的体积比为
您最近一年使用:0次
解题方法
9 . 把1mol X气体和0.5mol Y气体混合于2L密闭容器中,发生如下反应:3X(g)+Y(g) nZ(g)+2W(g),2min末生成0.2mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
nZ(g)+2W(g),2min末生成0.2mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
(1)前2min内,用X表示的平均反应速率________ ;
(2)2min末时Y的转化率_______ ;
(3)化学方程式中Z的化学计量数n=______ 。
 nZ(g)+2W(g),2min末生成0.2mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
nZ(g)+2W(g),2min末生成0.2mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:(1)前2min内,用X表示的平均反应速率
(2)2min末时Y的转化率
(3)化学方程式中Z的化学计量数n=
您最近一年使用:0次
2020-10-15更新
|
507次组卷
|
12卷引用:黑龙江省绥化市青冈县第一中学2020-2021学年高二上学期10月月考(筑梦班)化学试题
黑龙江省绥化市青冈县第一中学2020-2021学年高二上学期10月月考(筑梦班)化学试题2014-2015学年四川省资阳市高一下学期期末质量检测化学试卷甘肃省镇原县二中2018-2019学年高二上学期期末考试化学试题新疆昌吉回族自治州玛纳斯县第一中学2018-2019学年高二上学期第一次月考化学试题课时1 化学反应的速率——A学习区 夯实基础(人教版必修2)课时1 化学反应的速率——A学习区 夯实基础(人教版(2019)第二册)课时1 化学反应的快慢——A学习区 夯实基础(鲁科版(2019)第二册)课时1 化学反应的快慢——A学习区 夯实基础(鲁科版必修2)黑龙江省海林市朝鲜族中学2019-2020学年高一下学期期末考试化学试题必修第二册RJ第6章第二节 化学反应的速率与限度 课时1黑龙江省海林市朝鲜族中学2020-2021学年高二上学期第一次月考化学试题(已下线)第13讲 化学反应速率(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)
10-11高一·山东聊城·阶段练习
名校
解题方法
10 . 把1.1g铁,铝混合物溶于200mL 5mol/L的盐酸中,反应后盐酸的浓度变为4.6mol/L(溶液体积变化忽略不计)。则:
(1)反应中消耗HCl的物质的量为___________ ;
(2)该混合物中铝,铁的物质的量分别为___________ 、___________ 。
(1)反应中消耗HCl的物质的量为
(2)该混合物中铝,铁的物质的量分别为
您最近一年使用:0次
2020-10-07更新
|
1190次组卷
|
26卷引用:2011-2012学年黑龙江省庆安三中高一上学期期末考试化学试卷
(已下线)2011-2012学年黑龙江省庆安三中高一上学期期末考试化学试卷(已下线)2011-2012学年山东省临清三中高一第三次月考化学试卷(已下线)2011-2012学年山东济宁鱼台二中高一上学期期末模拟考试化学试卷(已下线)2011-2012学年湖南省蓝山二中高一上学期期末考试化学试卷(已下线)2014秋吉林省长春市第十一高中高一上学期期中化学试卷2015-2016学年广西钦州港经济开发区中学高一上12月月考化学试卷2015-2016学年黑龙江省海林林业局一中高一上学期期末化学试卷2015-2016学年广西钦州市高一下学期期末化学B卷2016-2017学年河南省南阳一中高一上第一次月考化学卷云南省玉溪市民族中学2016-2017学年高一下学期第二次阶段考试化学试题河南省商丘市九校2017-2018学年高一上学期期中联考化学试题高中化学人教版 必修1 第三章 金属及其化合物 1.金属的化学性质 物质的量在化学方程式计算中的应用2018年高一化学(人教版)必修1综合题型练习卷:金属的化学性质人教版(2019)高一必修第一册第三章 铁 金属材料 第二节 金属材料 课时2 物质的量在化学方程式计算中的应用人教版(2019)高一必修第一册 第三章 铁 金属材料 第二节 金属材料高一必修第一册(苏教2019版)专题2 第二单元 溶液组成的定量研究 课时2 化学反应的计算专题2 第二单元 溶液组成的定量研究-高中化学苏教2019版必修第一册(已下线)8.2 铝及其化合物-2020-2021学年秋季班高二上学期化学教材知识点精讲练(沪科版)福建省泉州市培元中学2020-2021学年高一上学期期中考试化学试题新疆石河子第二中学2021-2022学年高一上学期第二次月考化学试卷题(已下线)3.2.2物质的量在化学方程式中的计算-同步学习必备知识浙江省嘉兴市第五高级中学2021-2022学年高一上学期期中考试化学试题云南省玉溪市华宁县第二中学2021-2022年高一下学期开学考试化学试题河北省唐山市丰润区2023-2024学年高一上学期期中考试化学试题海南省琼海市嘉积中学2023-2024学年高一上学期期末考试化学试题A卷(已下线)第03讲 物质的量在化学方程式计算中的应用(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)



