1 . 工业上可以用 和
和 反应生成燃料甲醇,制备甲醇的化学方程式如下:
反应生成燃料甲醇,制备甲醇的化学方程式如下:
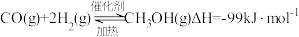
回答下列问题:
1.找到合适的催化剂是实现反应工业化的关键。该反应使用催化剂可以实现的目标有_____。
2.某温度下,将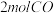 和
和 充入
充入 的密闭容器中,充分反应
的密闭容器中,充分反应 后,达到平衡时测得
后,达到平衡时测得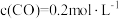 ,则
,则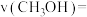
_____ 。
3.将 和
和 按照等物质的量进行反应,测得
按照等物质的量进行反应,测得 在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是_____。
在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是_____。
4.反应中的 ,可由如下反应制得:
,可由如下反应制得: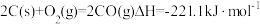 ,判断该反应能否自发进行,并简述原因:
,判断该反应能否自发进行,并简述原因:_____ 。
5.甲醇燃料电池以甲醇为燃料,其工作原理示意图:_____ 极。
(2)写出a极反应式_____ 。
6. ,两种酸的电离平衡常数如表所示:
,两种酸的电离平衡常数如表所示:
(1)写出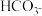 的电离平衡常数表达式
的电离平衡常数表达式
_____ 。
(2)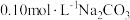 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为_____ 。
(3)向 溶液中加入足量的
溶液中加入足量的 溶液,发生反应的离子方程式是
溶液,发生反应的离子方程式是_____ 。
7.碳酸钙沉淀能溶于盐酸,用平衡移动原理解释其原因:_____ 。
 和
和 反应生成燃料甲醇,制备甲醇的化学方程式如下:
反应生成燃料甲醇,制备甲醇的化学方程式如下: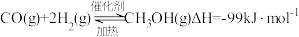
回答下列问题:
1.找到合适的催化剂是实现反应工业化的关键。该反应使用催化剂可以实现的目标有_____。
| A.缩短达到平衡所需时间 | B.增大甲醇的体积分数 |
| C.提高单位时间内甲醇的产量 | D.提高 的平衡转化率 的平衡转化率 |
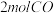 和
和 充入
充入 的密闭容器中,充分反应
的密闭容器中,充分反应 后,达到平衡时测得
后,达到平衡时测得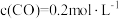 ,则
,则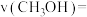
3.将
 和
和 按照等物质的量进行反应,测得
按照等物质的量进行反应,测得 在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是_____。
在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是_____。
A.温度: | B.正反应速率: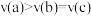 |
C.平衡常数: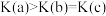 | D.平均摩尔质量: |
 ,可由如下反应制得:
,可由如下反应制得: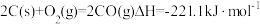 ,判断该反应能否自发进行,并简述原因:
,判断该反应能否自发进行,并简述原因:5.甲醇燃料电池以甲醇为燃料,其工作原理示意图:
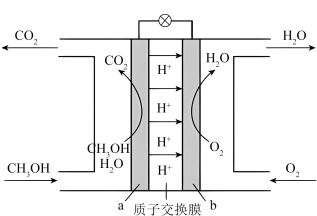
(2)写出a极反应式
6.
 ,两种酸的电离平衡常数如表所示:
,两种酸的电离平衡常数如表所示: |  | |
 | 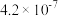 | 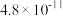 |
 |  |  |
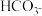 的电离平衡常数表达式
的电离平衡常数表达式
(2)
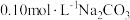 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为(3)向
 溶液中加入足量的
溶液中加入足量的 溶液,发生反应的离子方程式是
溶液,发生反应的离子方程式是7.碳酸钙沉淀能溶于盐酸,用平衡移动原理解释其原因:
您最近一年使用:0次
解题方法
2 . 化学电池的发明,改变了人们的生活方式。
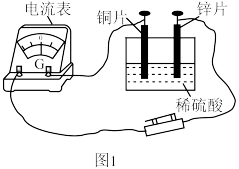
(1)某原电池实验装置如图1。 片作
片作_______ (填“正极”或“负极”)。
② 片上的电极反应为
片上的电极反应为_______ 。
③能证明化学能转化为电能的实验现象是_______ 。
(2)某种氢氧燃料电池的装置如图2所示。
下列说法正确的是_______ (填字母)。
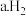 在负极发生反应
在负极发生反应  发生还原反应
发生还原反应
(1)某原电池实验装置如图1。
 片作
片作②
 片上的电极反应为
片上的电极反应为③能证明化学能转化为电能的实验现象是
(2)某种氢氧燃料电池的装置如图2所示。


下列说法正确的是
 在负极发生反应
在负极发生反应  发生还原反应
发生还原反应
您最近一年使用:0次
3 . 随着“碳达峰”、“碳中和”战略的提出,大气中 含量的控制和回收利用已成为当今化学研究的主题,其过程包括
含量的控制和回收利用已成为当今化学研究的主题,其过程包括 的富集、
的富集、 的合成气
的合成气 化、
化、 的甲醇
的甲醇 化、
化、 的甲烷化等。回答下列问题:
的甲烷化等。回答下列问题:
(1) 的富集:
的富集: 含量较高的空气叫富碳空气,捕集其中的
含量较高的空气叫富碳空气,捕集其中的 可通过如下途径实现。
可通过如下途径实现。___________ (用文字叙述)。
(2) 的合成气化:反应原理为
的合成气化:反应原理为
 。已知有关反应的热化学方程式:
。已知有关反应的热化学方程式:
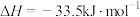 ,
,
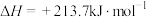 。
。
①
___________  。
。
②利于该反应自发进行的条件为___________ (填“高温”“低温”或“任意条件”)。
(3) 的甲醇化:利用光解海水产生的
的甲醇化:利用光解海水产生的 将
将 转化为甲醇
转化为甲醇
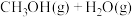
 ],其转化过程如图1所示。
],其转化过程如图1所示。___________ 。
②一定温度下,向体积为 的密闭容器中充入
的密闭容器中充入 和
和 ,发生反应
,发生反应 后到达平衡,此时
后到达平衡,此时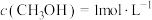 。前
。前 内,
内,
___________  ,该温度下反应的平衡常数
,该温度下反应的平衡常数
___________ (用分数表示)。
③一定温度下,在一个固定体积的密闭容器中仅发生反应ii,下列不能说明反应达到平衡状态的是___________ (填字母)。
A.容器内气体的压强不变
B.容器内混合气体的总物质的量不变
C. 和
和 物质的量之比不变
物质的量之比不变
D.单位时间内,每有 键断裂,同时有
键断裂,同时有 键形成
键形成
(4) 的甲烷化:科学家利用吸收
的甲烷化:科学家利用吸收 后的纯碱水溶液
后的纯碱水溶液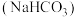 ,通过电解转化为
,通过电解转化为 及
及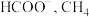 及
及 的产率随电解电压变化曲线如图2所示。
的产率随电解电压变化曲线如图2所示。 转化为
转化为 的电极反应式为
的电极反应式为___________ 。
②工业生产上常采用较高电压,其目的为___________ 。
 含量的控制和回收利用已成为当今化学研究的主题,其过程包括
含量的控制和回收利用已成为当今化学研究的主题,其过程包括 的富集、
的富集、 的合成气
的合成气 化、
化、 的甲醇
的甲醇 化、
化、 的甲烷化等。回答下列问题:
的甲烷化等。回答下列问题:(1)
 的富集:
的富集: 含量较高的空气叫富碳空气,捕集其中的
含量较高的空气叫富碳空气,捕集其中的 可通过如下途径实现。
可通过如下途径实现。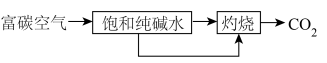
(2)
 的合成气化:反应原理为
的合成气化:反应原理为
 。已知有关反应的热化学方程式:
。已知有关反应的热化学方程式:
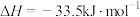 ,
,
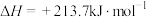 。
。①

 。
。②利于该反应自发进行的条件为
(3)
 的甲醇化:利用光解海水产生的
的甲醇化:利用光解海水产生的 将
将 转化为甲醇
转化为甲醇
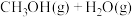
 ],其转化过程如图1所示。
],其转化过程如图1所示。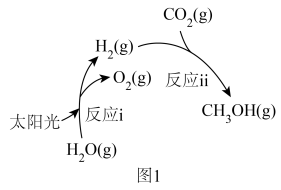
②一定温度下,向体积为
 的密闭容器中充入
的密闭容器中充入 和
和 ,发生反应
,发生反应 后到达平衡,此时
后到达平衡,此时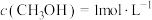 。前
。前 内,
内,
 ,该温度下反应的平衡常数
,该温度下反应的平衡常数
③一定温度下,在一个固定体积的密闭容器中仅发生反应ii,下列不能说明反应达到平衡状态的是
A.容器内气体的压强不变
B.容器内混合气体的总物质的量不变
C.
 和
和 物质的量之比不变
物质的量之比不变D.单位时间内,每有
 键断裂,同时有
键断裂,同时有 键形成
键形成(4)
 的甲烷化:科学家利用吸收
的甲烷化:科学家利用吸收 后的纯碱水溶液
后的纯碱水溶液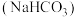 ,通过电解转化为
,通过电解转化为 及
及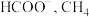 及
及 的产率随电解电压变化曲线如图2所示。
的产率随电解电压变化曲线如图2所示。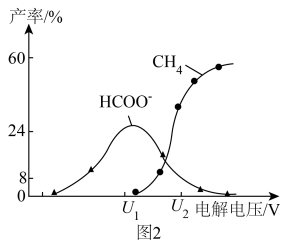
 转化为
转化为 的电极反应式为
的电极反应式为②工业生产上常采用较高电压,其目的为
您最近一年使用:0次
2024-04-19更新
|
148次组卷
|
3卷引用:河北省2024届普通高中高三学业水平选择性考试仿真模拟化学卷(三)
河北省2024届普通高中高三学业水平选择性考试仿真模拟化学卷(三)甘肃省2024届高三普通高中三模化学试卷(已下线)高二化学下学期期末押题卷01-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(江苏专用)
名校
解题方法
4 . 关于氢能源制取和CO2减排和成为研究热点。
(一)热解H2S制H2.根据文献,将H2S和CH4的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
Ⅰ.2H2S(s) 2H2(g)+S2(g);ΔH1=170kJ·mol-1
2H2(g)+S2(g);ΔH1=170kJ·mol-1
Ⅱ.CH4(g)+S2(g) CS2(g)+2H2(g);ΔH2=64kJ·mol-1
CS2(g)+2H2(g);ΔH2=64kJ·mol-1
总反应:Ⅲ.2H2S(g)+CH4(g) CS2(g)+4H2(g)
CS2(g)+4H2(g)
投料按体积之比V(H2S)∶V(CH4)=2∶1,并用N2稀释;常压,不同温度下反应相同时间后,测得H2和CS2体积分数如下表:
(1)①已知ΔG=ΔH-TΔS,当ΔG<0时,反应Ⅲ能自发进行的条件是___________ 。
②在950~1150℃范围内(其他条件不变),S2(g)的体积分数随温度升高的变化是___________ (填“先升高后降低”或“先降低后升高”),分析原因:___________ 。
(二)我国科学家研究LiCO2电池,在获得能量的同时可以达到碳固定的目的。LiCO2电池中,Li为单质锂片。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行。
Ⅰ.2CO2+2e-=C2O
Ⅱ.C2O =CO2+CO
=CO2+CO
Ⅲ.___________
Ⅳ.CO +2Li+=Li2CO3
+2Li+=Li2CO3
(2)写出步骤Ⅲ的离子方程式________ 。
(三)科研的工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2转化为HCOOH,实现碳减排的目标,如图所示。
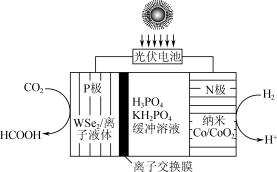
(3)①离子交换膜为质子交换膜,当消耗标准状况下11.2LH2时,P极电解液质量变化情况为___________ 。
②光伏电池中涉及NOCl光化学分解反应,在一定频率(ν)光的照射下机理如下:NOCl+hν→NOCl*、NOCl+NOCl*→2NO+Cl2,其中hν表示一个光子能量,NOCl*表示NOCl的激发态。可知,分解1mol的NOCl需要吸收___________ mol光子。
(四)已知反应CO2(g)+H2(g) HCOOH(g);ΔH<0。温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应CO2(g)+H2(g)
HCOOH(g);ΔH<0。温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应CO2(g)+H2(g) HCOOH(g) K=2。
HCOOH(g) K=2。
(4)实验测得v正=k正c(CO2)c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。温度为T2℃时,k正=1.8k逆,则T2℃>T1℃,请通过计算说明原因:___________ 。
(一)热解H2S制H2.根据文献,将H2S和CH4的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
Ⅰ.2H2S(s)
 2H2(g)+S2(g);ΔH1=170kJ·mol-1
2H2(g)+S2(g);ΔH1=170kJ·mol-1Ⅱ.CH4(g)+S2(g)
 CS2(g)+2H2(g);ΔH2=64kJ·mol-1
CS2(g)+2H2(g);ΔH2=64kJ·mol-1总反应:Ⅲ.2H2S(g)+CH4(g)
 CS2(g)+4H2(g)
CS2(g)+4H2(g)投料按体积之比V(H2S)∶V(CH4)=2∶1,并用N2稀释;常压,不同温度下反应相同时间后,测得H2和CS2体积分数如下表:
| 温度/℃ | 950 | 1000 | 1050 | 1100 | 1150 |
| H2/V(%) | 0.5 | 1.5 | 3.6 | 5.5 | 8.5 |
| CS2/V(%) | 0.0 | 0.0 | 0.1 | 0.4 | 1.8 |
(1)①已知ΔG=ΔH-TΔS,当ΔG<0时,反应Ⅲ能自发进行的条件是
②在950~1150℃范围内(其他条件不变),S2(g)的体积分数随温度升高的变化是
(二)我国科学家研究LiCO2电池,在获得能量的同时可以达到碳固定的目的。LiCO2电池中,Li为单质锂片。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行。
Ⅰ.2CO2+2e-=C2O

Ⅱ.C2O
 =CO2+CO
=CO2+CO
Ⅲ.___________
Ⅳ.CO
 +2Li+=Li2CO3
+2Li+=Li2CO3(2)写出步骤Ⅲ的离子方程式
(三)科研的工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2转化为HCOOH,实现碳减排的目标,如图所示。

(3)①离子交换膜为质子交换膜,当消耗标准状况下11.2LH2时,P极电解液质量变化情况为
②光伏电池中涉及NOCl光化学分解反应,在一定频率(ν)光的照射下机理如下:NOCl+hν→NOCl*、NOCl+NOCl*→2NO+Cl2,其中hν表示一个光子能量,NOCl*表示NOCl的激发态。可知,分解1mol的NOCl需要吸收
(四)已知反应CO2(g)+H2(g)
 HCOOH(g);ΔH<0。温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应CO2(g)+H2(g)
HCOOH(g);ΔH<0。温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应CO2(g)+H2(g) HCOOH(g) K=2。
HCOOH(g) K=2。(4)实验测得v正=k正c(CO2)c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。温度为T2℃时,k正=1.8k逆,则T2℃>T1℃,请通过计算说明原因:
您最近一年使用:0次
解题方法
5 . 碳、氮的单质及其化合物在生产和生活中有广泛应用。
(1)已知在298K时,C(石墨)完全燃烧的热化学方程式:C(石墨)+O2(g)=CO2(g) ∆H=-393.5kJ·mol-1。该反应属于___________ (填“放热”或“吸热”)反应。
(2)—定条件下,在某密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g) ∆H<O。
2NH3(g) ∆H<O。
①若N2(g)的起始浓度为1mol-1•L-1,H2(g)的起始浓度为3mol•L-1,反应进行到2min时,测得H2(g)浓度为2mol•L-1,测2min内v(H2)=___________ mol•L-1•min•L-1。
②当反应达到平衡时,若只升高温度,则平衡向___________ (填“正反应”或“逆反应”)方向移动。
③当反应达到平衡时,若只增大压强,则化学平衡常数K___________ (填"增大”“减小”或“不变”)。
(3)常温下,往0.1mol•L-1NH4Cl溶液中滴入紫色石蕊试液后,溶液变红色,则该溶液pH___________ 7(填“〉”或“<”);c( )
)___________ c(Cl-)(填“〉”或“<”)。
(4)如图所示实验,用石墨电极电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
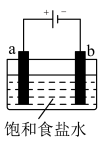
①a电极是电解池的___________ (填“阳极”或“阴极”)。
②溶液中H+向___________ (填“a”或“b”)电极移动。
③生成Cl2的电极反应式:___________ 。
(1)已知在298K时,C(石墨)完全燃烧的热化学方程式:C(石墨)+O2(g)=CO2(g) ∆H=-393.5kJ·mol-1。该反应属于
(2)—定条件下,在某密闭容器中进行反应:N2(g)+3H2(g)
 2NH3(g) ∆H<O。
2NH3(g) ∆H<O。①若N2(g)的起始浓度为1mol-1•L-1,H2(g)的起始浓度为3mol•L-1,反应进行到2min时,测得H2(g)浓度为2mol•L-1,测2min内v(H2)=
②当反应达到平衡时,若只升高温度,则平衡向
③当反应达到平衡时,若只增大压强,则化学平衡常数K
(3)常温下,往0.1mol•L-1NH4Cl溶液中滴入紫色石蕊试液后,溶液变红色,则该溶液pH
 )
)(4)如图所示实验,用石墨电极电解饱和食盐水:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
①a电极是电解池的
②溶液中H+向
③生成Cl2的电极反应式:
您最近一年使用:0次
名校
解题方法
6 . 在加热、加压条件下,利用金属锰的水热反应可将CO2转化为甲酸(HCOOH),转化关系示意图如下:
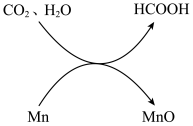
(1)HCOOH的官能团是羧基。HCOOH分子中与碳原子形成共价键的原子的数目是_______ 。
(2)转化过程可认为分两步反应进行:
反应I. Mn + H2O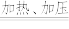 MnO + H2↑; 反应Ⅱ. ……
MnO + H2↑; 反应Ⅱ. ……
写出加热、加压条件下反应Ⅱ的化学方程式:_______ 。
(3)反应一段时间后,生成HCOOH的速率增大,可能的原因是_______ (填字母)。
A.反应放热使温度升高
B.反应I得到的MnO对HCOOH的生成有催化作用
C.H2能将MnO转化为MnO2

(1)HCOOH的官能团是羧基。HCOOH分子中与碳原子形成共价键的原子的数目是
(2)转化过程可认为分两步反应进行:
反应I. Mn + H2O
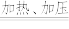 MnO + H2↑; 反应Ⅱ. ……
MnO + H2↑; 反应Ⅱ. ……写出加热、加压条件下反应Ⅱ的化学方程式:
(3)反应一段时间后,生成HCOOH的速率增大,可能的原因是
A.反应放热使温度升高
B.反应I得到的MnO对HCOOH的生成有催化作用
C.H2能将MnO转化为MnO2
您最近一年使用:0次
名校
7 . 为了增强大气污染防治的科学性、针对性和有效性,研究大气颗粒物的化学组成和分布特征具有很重要的意义。水溶性离子是PM2.5的重要组成部分,主要包含SO 、NO
、NO 、NH
、NH 、Cl-、Na+、Ca2+、Mg2+等,这些离子多由化石燃料燃烧、机动车尾气等排放的SO2、NOx、NH3等气体经过复杂的大气物理化学过程二次转化而来。
、Cl-、Na+、Ca2+、Mg2+等,这些离子多由化石燃料燃烧、机动车尾气等排放的SO2、NOx、NH3等气体经过复杂的大气物理化学过程二次转化而来。
(1)常温下,将某地大气污染物样品配制成溶液,测得溶液的pH>7,该溶液显______ 。
A.酸性 B.碱性 C.中性
(2)PM2.5中的SO 主要源自燃煤产生的SO2,写出SO2转化为H2SO4的化学方程式
主要源自燃煤产生的SO2,写出SO2转化为H2SO4的化学方程式______ 、______ 。
硫氧化率(SOR)和氮氧化率(NOR)通常用来分别表示气体污染物SO2和NO2向SO 和NO
和NO 的转化程度。SOR和NOR的计算公式为:
的转化程度。SOR和NOR的计算公式为:
SOR=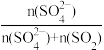
NOR=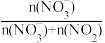
已知PM2.5中SO 主要以(NH4)2SO4形式存在,NO
主要以(NH4)2SO4形式存在,NO 主要以NH4NO3形式存在。(NH4)2SO4比NH4NO3更稳定;NH4NO3和HNO3加热或光照均易分解。
主要以NH4NO3形式存在。(NH4)2SO4比NH4NO3更稳定;NH4NO3和HNO3加热或光照均易分解。
某地SOR和NOR的数据如表所示:
(3)由表中数据可知,SOR和NOR差异最大的季节是______ 。
A.春季 B.夏季 C.秋季 D.冬季
结合相关化学原理推测该季节产生这种差异可能的原因。______ 。
(4)设r=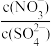 ,r值可以较好地反映机动车等移动源污染与燃煤等固定源污染的相对大小。已知某地PM2.5浓度及r值随季节变化如图所示。根据该图分析,造成秋冬季节PM2.5偏高的首要原因是
,r值可以较好地反映机动车等移动源污染与燃煤等固定源污染的相对大小。已知某地PM2.5浓度及r值随季节变化如图所示。根据该图分析,造成秋冬季节PM2.5偏高的首要原因是______ 。
假如你是城市管理者,请你提出一条有针对性的措施,以缓解秋冬季节PM2.5污染较严重的问题______ 。
 、NO
、NO 、NH
、NH 、Cl-、Na+、Ca2+、Mg2+等,这些离子多由化石燃料燃烧、机动车尾气等排放的SO2、NOx、NH3等气体经过复杂的大气物理化学过程二次转化而来。
、Cl-、Na+、Ca2+、Mg2+等,这些离子多由化石燃料燃烧、机动车尾气等排放的SO2、NOx、NH3等气体经过复杂的大气物理化学过程二次转化而来。(1)常温下,将某地大气污染物样品配制成溶液,测得溶液的pH>7,该溶液显
A.酸性 B.碱性 C.中性
(2)PM2.5中的SO
 主要源自燃煤产生的SO2,写出SO2转化为H2SO4的化学方程式
主要源自燃煤产生的SO2,写出SO2转化为H2SO4的化学方程式硫氧化率(SOR)和氮氧化率(NOR)通常用来分别表示气体污染物SO2和NO2向SO
 和NO
和NO 的转化程度。SOR和NOR的计算公式为:
的转化程度。SOR和NOR的计算公式为:SOR=
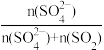
NOR=
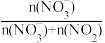
已知PM2.5中SO
 主要以(NH4)2SO4形式存在,NO
主要以(NH4)2SO4形式存在,NO 主要以NH4NO3形式存在。(NH4)2SO4比NH4NO3更稳定;NH4NO3和HNO3加热或光照均易分解。
主要以NH4NO3形式存在。(NH4)2SO4比NH4NO3更稳定;NH4NO3和HNO3加热或光照均易分解。某地SOR和NOR的数据如表所示:
| 季节 | 春季 | 夏季 | 秋季 | 冬季 | 平均 |
| SOR | 0.29 | 0.42 | 0.28 | 0.26 | 0.31 |
| NOR | 0.21 | 0.14 | 0.23 | 0.25 | 0.21 |
A.春季 B.夏季 C.秋季 D.冬季
结合相关化学原理推测该季节产生这种差异可能的原因。
(4)设r=
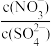 ,r值可以较好地反映机动车等移动源污染与燃煤等固定源污染的相对大小。已知某地PM2.5浓度及r值随季节变化如图所示。根据该图分析,造成秋冬季节PM2.5偏高的首要原因是
,r值可以较好地反映机动车等移动源污染与燃煤等固定源污染的相对大小。已知某地PM2.5浓度及r值随季节变化如图所示。根据该图分析,造成秋冬季节PM2.5偏高的首要原因是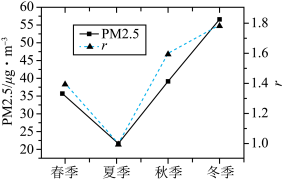
假如你是城市管理者,请你提出一条有针对性的措施,以缓解秋冬季节PM2.5污染较严重的问题
您最近一年使用:0次
2023-04-15更新
|
142次组卷
|
3卷引用:2023年上海市普通高中学业水平合格性考试 化学 调研卷
解题方法
8 . 回答下列问题
(1)在 、
、 下,
下,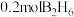 (气态高能燃料)在氧气中完全燃烧,生成固态三氧化二硼和液态水,放出
(气态高能燃料)在氧气中完全燃烧,生成固态三氧化二硼和液态水,放出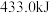 的热量,写出该反应的热化学方程式:
的热量,写出该反应的热化学方程式:_____________________ 。
(2)在一定条件下, 和
和 反应生成
反应生成 的热化学方程式为
的热化学方程式为
①将 和
和 充入
充入 密闭容器中进行反应,一定条件下,达到平衡时放出的热量
密闭容器中进行反应,一定条件下,达到平衡时放出的热量_________ (填“>”“<”或“=”)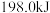 ;若反应进行到
;若反应进行到 时,
时, 的转化率为
的转化率为 ,则
,则 内,
内, 的平均反应速率为
的平均反应速率为__________  。
。
②上述反应达到平衡状态的标志是_______________ (填字母)。
A.反应速率 B.反应停止,容器内压强不再发生变化
B.反应停止,容器内压强不再发生变化
C. 的浓度不再发生变化 D.混合气体的平均相对分子质量不再改变
的浓度不再发生变化 D.混合气体的平均相对分子质量不再改变
(1)在
 、
、 下,
下,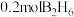 (气态高能燃料)在氧气中完全燃烧,生成固态三氧化二硼和液态水,放出
(气态高能燃料)在氧气中完全燃烧,生成固态三氧化二硼和液态水,放出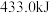 的热量,写出该反应的热化学方程式:
的热量,写出该反应的热化学方程式:(2)在一定条件下,
 和
和 反应生成
反应生成 的热化学方程式为
的热化学方程式为
①将
 和
和 充入
充入 密闭容器中进行反应,一定条件下,达到平衡时放出的热量
密闭容器中进行反应,一定条件下,达到平衡时放出的热量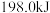 ;若反应进行到
;若反应进行到 时,
时, 的转化率为
的转化率为 ,则
,则 内,
内, 的平均反应速率为
的平均反应速率为 。
。②上述反应达到平衡状态的标志是
A.反应速率
 B.反应停止,容器内压强不再发生变化
B.反应停止,容器内压强不再发生变化C.
 的浓度不再发生变化 D.混合气体的平均相对分子质量不再改变
的浓度不再发生变化 D.混合气体的平均相对分子质量不再改变
您最近一年使用:0次
9 . 化学既能指导人们科学生活,也能指导人们治理环境污染等。
(1)没有擦干的铸铁锅易生锈,是因为发生了______________ (填“吸氧”或“析氢”)腐蚀。
(2)下列金属的防护方法中,正确的是_____________ (填字母)。
A.在铁制的下水道上焊上铜块
B.衣架和电线的外面包上一层塑料层
C.在自行车的钢圈上刷油漆,以防生锈
(3)汽车尾气中含有CO和NO等有毒气体,在催化剂的作用下,使CO和NO反应转化成 和一种无毒的单质气体,该反应的化学方程式是
和一种无毒的单质气体,该反应的化学方程式是__________________________ 。
(4)钢铁厂、电镀厂在生产过程中会产生酸性废水,一般用_____________(填字母)来进行中和处理。
(5)近几年冬季,雾霾天气有所减少.导致雾霾出现的主要原因是____________ (填字母)。
A. B.
B. C.PM2.5
C.PM2.5
(6)垃圾的再生利用是垃圾资源化的最佳途径,以下垃圾处理方法中正确的是_____________(填字母)。
(1)没有擦干的铸铁锅易生锈,是因为发生了
(2)下列金属的防护方法中,正确的是
A.在铁制的下水道上焊上铜块
B.衣架和电线的外面包上一层塑料层
C.在自行车的钢圈上刷油漆,以防生锈
(3)汽车尾气中含有CO和NO等有毒气体,在催化剂的作用下,使CO和NO反应转化成
 和一种无毒的单质气体,该反应的化学方程式是
和一种无毒的单质气体,该反应的化学方程式是(4)钢铁厂、电镀厂在生产过程中会产生酸性废水,一般用_____________(填字母)来进行中和处理。
A. | B. | C. | D. |
A.
 B.
B. C.PM2.5
C.PM2.5(6)垃圾的再生利用是垃圾资源化的最佳途径,以下垃圾处理方法中正确的是_____________(填字母)。
| A.废旧电池无须处理,集中深埋即可 | B.厨余垃圾直接倒入下水道 |
| C.废旧玻璃可回收熔炼,再生利用 | D.废旧纸张可直接露天焚烧 |
您最近一年使用:0次
解题方法
10 . 利用 催化氮气合成氨气,并生成CO、
催化氮气合成氨气,并生成CO、 等燃料气的方程式如下所示:
等燃料气的方程式如下所示:
反应①:
反应②:
(1)氮原子核外电子排布式为:_______ 。
(2)比较C、N、O原子的半径大小:_______ 。
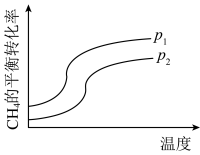
(3)反应①的进程如图所示,则 和
和 的大小为:
的大小为:_______ 。
(4)某一2L恒温恒容装置,反应前充入3mol甲烷,10min后,甲烷为1.2mol,求前10min氮气的反应速率为:_______ 。
(5)写出反应①和反应②的总反应方程式:_______ 。
(6)这个制取氨气的方法和工业制取氨气相比,优点是:_______ 、_______ 。
 催化氮气合成氨气,并生成CO、
催化氮气合成氨气,并生成CO、 等燃料气的方程式如下所示:
等燃料气的方程式如下所示:反应①:

反应②:

(1)氮原子核外电子排布式为:
(2)比较C、N、O原子的半径大小:
(3)反应①的进程如图所示,则
 和
和 的大小为:
的大小为:
(4)某一2L恒温恒容装置,反应前充入3mol甲烷,10min后,甲烷为1.2mol,求前10min氮气的反应速率为:
(5)写出反应①和反应②的总反应方程式:
(6)这个制取氨气的方法和工业制取氨气相比,优点是:
您最近一年使用:0次



