解题方法
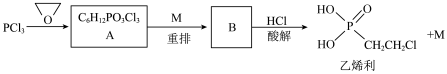
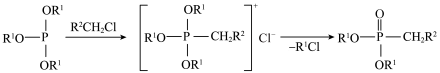
1 . 乙烯利广泛应用于农作物的增产和储存。一种制备乙烯利的方法如图。 分子的空间结构名称是
分子的空间结构名称是_____________ 。
(2)乙烯利中 的化合价为
的化合价为 ,
,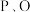 和C的电负性由大到小的顺序是
和C的电负性由大到小的顺序是_____________ 。
(3)A的结构简式是_____________ 。
(4) 的名称是
的名称是_____________ 。
(5)利用以下方法可测定乙烯利的纯度。
已知:ⅰ.乙烯利在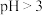 的溶液中能释放乙烯,同时产生磷酸盐等;
的溶液中能释放乙烯,同时产生磷酸盐等;
ⅱ.磷酸体系中含磷微粒的物质的量分数与溶液 的关系如图所示;
的关系如图所示;
ⅲ.百里香酚蓝在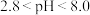 为黄色,在
为黄色,在 为蓝色。
为蓝色。 乙烯利样品于锥形瓶中,加水溶解。
乙烯利样品于锥形瓶中,加水溶解。
步骤Ⅱ:滴加几滴百里香酚蓝作指示剂,溶液为黄色。用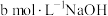 溶液滴定至溶液恰好变为蓝色,消耗
溶液滴定至溶液恰好变为蓝色,消耗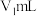 。杂质和乙烯利均与
。杂质和乙烯利均与 反应,其中乙烯利发生反应:
反应,其中乙烯利发生反应:
步骤Ⅳ:再用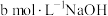 溶液滴定至溶液恰好变为蓝色,消耗
溶液滴定至溶液恰好变为蓝色,消耗 。
。
①步骤Ⅲ中乙烯利二钠与水反应的化学方程式是_____________ 。
②样品中乙烯利的纯度为_____________ (用质量分数表示,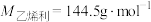 )。
)。
 分子的空间结构名称是
分子的空间结构名称是(2)乙烯利中
 的化合价为
的化合价为 ,
, 和C的电负性由大到小的顺序是
和C的电负性由大到小的顺序是(3)A的结构简式是
(4)
 的名称是
的名称是(5)利用以下方法可测定乙烯利的纯度。
已知:ⅰ.乙烯利在
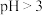 的溶液中能释放乙烯,同时产生磷酸盐等;
的溶液中能释放乙烯,同时产生磷酸盐等;ⅱ.磷酸体系中含磷微粒的物质的量分数与溶液
 的关系如图所示;
的关系如图所示;ⅲ.百里香酚蓝在
 为黄色,在
为黄色,在 为蓝色。
为蓝色。
 乙烯利样品于锥形瓶中,加水溶解。
乙烯利样品于锥形瓶中,加水溶解。步骤Ⅱ:滴加几滴百里香酚蓝作指示剂,溶液为黄色。用
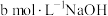 溶液滴定至溶液恰好变为蓝色,消耗
溶液滴定至溶液恰好变为蓝色,消耗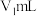 。杂质和乙烯利均与
。杂质和乙烯利均与 反应,其中乙烯利发生反应:
反应,其中乙烯利发生反应: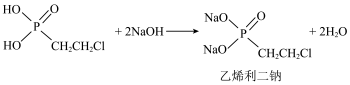
步骤Ⅳ:再用
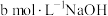 溶液滴定至溶液恰好变为蓝色,消耗
溶液滴定至溶液恰好变为蓝色,消耗 。
。①步骤Ⅲ中乙烯利二钠与水反应的化学方程式是
②样品中乙烯利的纯度为
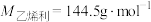 )。
)。
您最近一年使用:0次
解题方法
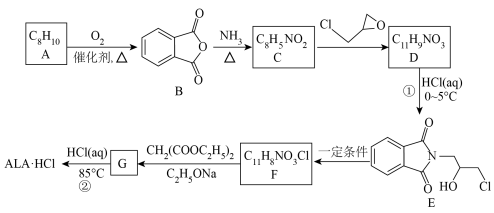
2 . 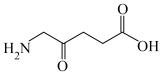
 广泛用于医学和农业合成
广泛用于医学和农业合成 的一种路线如图。
的一种路线如图。
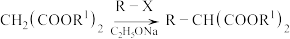 (
( 表示卤原子)
表示卤原子)ⅱ.
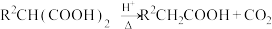
(1)A为苯的同系物,A的结构简式是
(2)
 的化学方程式是
的化学方程式是(3)
 的反应类型是
的反应类型是(4)
 需要强碱性物质参与反应。
需要强碱性物质参与反应。 .从结构角度分析:由于
.从结构角度分析:由于 比
比 更难解离出
更难解离出 ,故
,故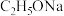 的碱性强于
的碱性强于 。
。 .
. 的化学方程式是
的化学方程式是(5)反应②中同时还生成
 、
、(6)对比①②,推测①采用低温的目的是
您最近一年使用:0次
3 . 硒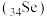 是一种应用广泛的元素。
是一种应用广泛的元素。
Ⅰ.检测细胞体内的
风湿性关节炎与细胞体内产生的 有关。一种含
有关。一种含 的荧光探针分子
的荧光探针分子 检测
检测 及再生的转化如图。
及再生的转化如图。 位于元素周期表中
位于元素周期表中_____________ 区(填“ ”“
”“ ”“
”“ ”或“
”或“ ”)。
”)。
② 的结构式是
的结构式是_____________ 。
(2)在 中,
中, 转化为
转化为 。
。 ”在
”在 中标出所有的手性碳原子
中标出所有的手性碳原子__________ 。
② 中,
中, 与
与 的物质的量之比为
的物质的量之比为_________________ 。
Ⅱ.应用于光电领域
 可作为新型镁电池的正极材料,其晶胞结构如图所示。
可作为新型镁电池的正极材料,其晶胞结构如图所示。_________________ 。
②晶胞中“ ”表示
”表示_________________ (填离子符号)。
(4)新型镁电池放电时,图1晶胞中 位置不变,
位置不变, 嵌入的同时
嵌入的同时 被挤出。生成的
被挤出。生成的 晶体结构与
晶体结构与 晶体相似,其中
晶体相似,其中 位于图1晶胞的
位于图1晶胞的_____________________ (填序号)。
 .棱心
.棱心  .面心
.面心  .体心
.体心  .顶点
.顶点
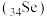 是一种应用广泛的元素。
是一种应用广泛的元素。Ⅰ.检测细胞体内的

风湿性关节炎与细胞体内产生的
 有关。一种含
有关。一种含 的荧光探针分子
的荧光探针分子 检测
检测 及再生的转化如图。
及再生的转化如图。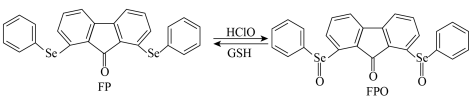
 位于元素周期表中
位于元素周期表中 ”“
”“ ”“
”“ ”或“
”或“ ”)。
”)。②
 的结构式是
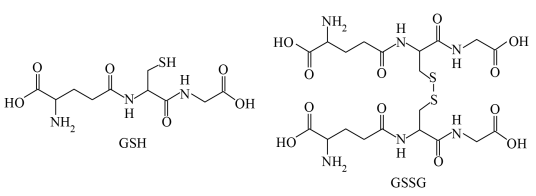
的结构式是(2)在
 中,
中, 转化为
转化为 。
。
 ”在
”在 中标出所有的手性碳原子
中标出所有的手性碳原子②
 中,
中, 与
与 的物质的量之比为
的物质的量之比为Ⅱ.应用于光电领域
 可作为新型镁电池的正极材料,其晶胞结构如图所示。
可作为新型镁电池的正极材料,其晶胞结构如图所示。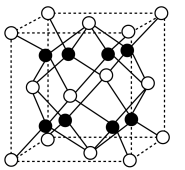
②晶胞中“
 ”表示
”表示(4)新型镁电池放电时,图1晶胞中
 位置不变,
位置不变, 嵌入的同时
嵌入的同时 被挤出。生成的
被挤出。生成的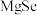 晶体结构与
晶体结构与 晶体相似,其中
晶体相似,其中 位于图1晶胞的
位于图1晶胞的 .棱心
.棱心  .面心
.面心  .体心
.体心  .顶点
.顶点
您最近一年使用:0次
解题方法
4 .  和
和 都具有广泛的用途。
都具有广泛的用途。
Ⅰ.工业上用软锰矿(主要含 )和硫锰矿(主要含
)和硫锰矿(主要含 )联合制备
)联合制备 的流程如图。
的流程如图。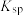
(1)为提高浸出速率,可采取的措施有_________________ (答出两条即可)。
(2)浸出过程中产生的 对
对 与
与 的反应起催化作用,机理如下。
的反应起催化作用,机理如下。
ⅰ.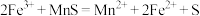 ;
;
ⅱ._________________ (离子方程式)。
(3)流程图中采用①和②共同除去浸出液中金属阳离子杂质,解释不能单独使用①去除这些杂质离子的原因:_____________ 。
(4)滤渣2的主要成分是_________________ 。
Ⅱ.以 溶液为原料,用图1装置(
溶液为原料,用图1装置( 均为惰性电极)同步制备
均为惰性电极)同步制备 和
和 。
。_________________ 。
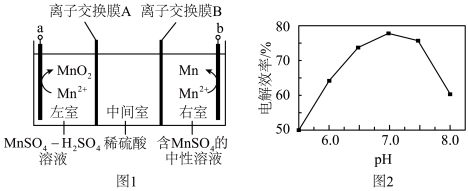
(6)图1中 电极上
电极上 的电解效率
的电解效率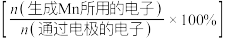 与溶液
与溶液 的关系如图2所示。随
的关系如图2所示。随 的增大,电解效率先增大后减小的原因是
的增大,电解效率先增大后减小的原因是_________________ 。
 和
和 都具有广泛的用途。
都具有广泛的用途。Ⅰ.工业上用软锰矿(主要含
 )和硫锰矿(主要含
)和硫锰矿(主要含 )联合制备
)联合制备 的流程如图。
的流程如图。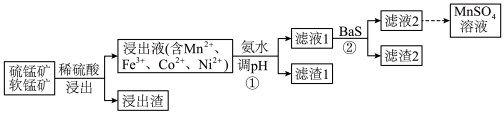
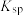
| 硫化物 |  |  |  |  (易溶) (易溶) |
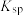 | 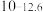 | 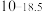 |  | |
| 氢氧化物 |  |  |  |  |
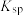 | 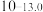 | 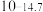 | 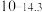 | 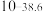 |
(1)为提高浸出速率,可采取的措施有
(2)浸出过程中产生的
 对
对 与
与 的反应起催化作用,机理如下。
的反应起催化作用,机理如下。ⅰ.
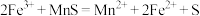 ;
;ⅱ.
(3)流程图中采用①和②共同除去浸出液中金属阳离子杂质,解释不能单独使用①去除这些杂质离子的原因:
(4)滤渣2的主要成分是
Ⅱ.以
 溶液为原料,用图1装置(
溶液为原料,用图1装置(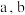 均为惰性电极)同步制备
均为惰性电极)同步制备 和
和 。
。
(6)图1中
 电极上
电极上 的电解效率
的电解效率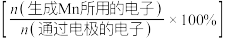 与溶液
与溶液 的关系如图2所示。随
的关系如图2所示。随 的增大,电解效率先增大后减小的原因是
的增大,电解效率先增大后减小的原因是
您最近一年使用:0次
5 . 研究从含锌资源中获取Zn的途径具有重要意义。
Ⅰ.工业上酸浸提锌
氧化锌矿中含有ZnO、 、FeO、PbO、
、FeO、PbO、 、CaO、
、CaO、 等。
等。
ⅰ.几种难溶电解质的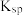
ⅱ.浸出液中主要金属阳离子浓度
(1)浸出渣的主要成分有 、
、 和
和 。PbO和
。PbO和 反应的离子方程式是
反应的离子方程式是___________ 。
(2)加入试剂a的目的是___________ 。
(3)电解前,含 溶液中铁和铝的离子浓度均需小于
溶液中铁和铝的离子浓度均需小于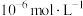 ,应调节pH的范围是(忽略①和②导致的体积变化)
,应调节pH的范围是(忽略①和②导致的体积变化)___________ 。
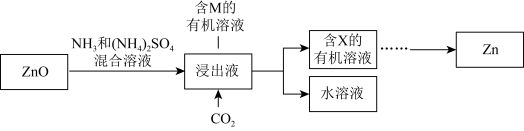
Ⅱ.实验室中氨浸提锌
ⅲ.

ⅳ.M的结构简式如图所示,R为 ,两个羟基中、酚羟基酸性较强。
,两个羟基中、酚羟基酸性较强。 浸取ZnO发生反应的离子方程式是
浸取ZnO发生反应的离子方程式是___________ 。
(5)M能与 形成稳定的配合物X,相关反应为
形成稳定的配合物X,相关反应为 。
。
①补全图中X的结构并用“…”标出氢键_______ 。 的萃取,原因可能是
的萃取,原因可能是___________ 。
(6)从平衡移动的角度解释 能提高有机溶液中X含量的原因:
能提高有机溶液中X含量的原因:___________ 。
Ⅰ.工业上酸浸提锌
氧化锌矿中含有ZnO、
 、FeO、PbO、
、FeO、PbO、 、CaO、
、CaO、 等。
等。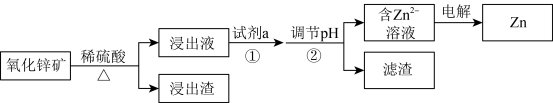
ⅰ.几种难溶电解质的
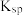
| 难溶电解质 |  |  |  |  |
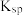 |  |  | 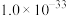 |  |
| 粒子 |  |  和Fe 和Fe | Al |
| 浓度(mol/L) | 0.3 | 0.1 | 0.1 |
(1)浸出渣的主要成分有
 、
、 和
和 。PbO和
。PbO和 反应的离子方程式是
反应的离子方程式是(2)加入试剂a的目的是
(3)电解前,含
 溶液中铁和铝的离子浓度均需小于
溶液中铁和铝的离子浓度均需小于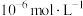 ,应调节pH的范围是(忽略①和②导致的体积变化)
,应调节pH的范围是(忽略①和②导致的体积变化)Ⅱ.实验室中氨浸提锌
ⅲ.


ⅳ.M的结构简式如图所示,R为
 ,两个羟基中、酚羟基酸性较强。
,两个羟基中、酚羟基酸性较强。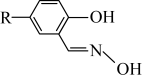
 浸取ZnO发生反应的离子方程式是
浸取ZnO发生反应的离子方程式是(5)M能与
 形成稳定的配合物X,相关反应为
形成稳定的配合物X,相关反应为 。
。①补全图中X的结构并用“…”标出氢键
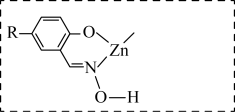
 的萃取,原因可能是
的萃取,原因可能是(6)从平衡移动的角度解释
 能提高有机溶液中X含量的原因:
能提高有机溶液中X含量的原因:
您最近一年使用:0次
6 . 柠檬酸铁铵和铁氰化钾在紫外线照射下产生普鲁士蓝(PB),可用于染色和能源行业。
(1)制备柠檬酸铁铵的原料有铁盐、氨水和柠檬酸。
①基态 的价层电子轨道表示式是
的价层电子轨道表示式是___________ 。
② 的VSEPR模型名称是
的VSEPR模型名称是___________ 。
(2)避光条件下,柠檬酸铁铵与铁氰化钾反应得到普鲁士黄(PY),其晶胞形状为立方体,结构如图所示。 均与
均与 形成配位键。结合电子式,解释
形成配位键。结合电子式,解释 在PY中作配体的原因:
在PY中作配体的原因:___________ 。
②已知PY中相邻 之间的距离为a nm,
之间的距离为a nm, 表示阿伏加德罗常数的值,PY的密度为
表示阿伏加德罗常数的值,PY的密度为___________
 (用代数式表示,
(用代数式表示, )。
)。
(3)在紫外线照射下,PY中部分 转化为
转化为 ,同时
,同时 嵌入,PY转变为PB.PB晶胞结构如图所示,其中
嵌入,PY转变为PB.PB晶胞结构如图所示,其中 周围最近且等距的
周围最近且等距的 有12个。图中“
有12个。图中“ ”位置被
”位置被 或
或 占据,用“
占据,用“ ”补全PB晶胞结构中Ⅰ和Ⅱ两个小立方体中的
”补全PB晶胞结构中Ⅰ和Ⅱ两个小立方体中的
___________ 。[PB晶胞( 未画出)]
未画出)] 能很容易地嵌入和脱嵌,因此PB可作为钾离子电池的正极材料。充电过程中,推测
能很容易地嵌入和脱嵌,因此PB可作为钾离子电池的正极材料。充电过程中,推测 会从PB中脱嵌出来,理由是
会从PB中脱嵌出来,理由是___________ 。
(1)制备柠檬酸铁铵的原料有铁盐、氨水和柠檬酸。
①基态
 的价层电子轨道表示式是
的价层电子轨道表示式是②
 的VSEPR模型名称是
的VSEPR模型名称是(2)避光条件下,柠檬酸铁铵与铁氰化钾反应得到普鲁士黄(PY),其晶胞形状为立方体,结构如图所示。
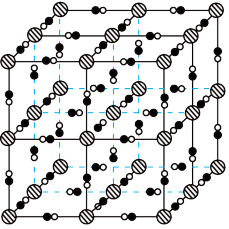
 均与
均与 形成配位键。结合电子式,解释
形成配位键。结合电子式,解释 在PY中作配体的原因:
在PY中作配体的原因:②已知PY中相邻
 之间的距离为a nm,
之间的距离为a nm, 表示阿伏加德罗常数的值,PY的密度为
表示阿伏加德罗常数的值,PY的密度为 (用代数式表示,
(用代数式表示, )。
)。(3)在紫外线照射下,PY中部分
 转化为
转化为 ,同时
,同时 嵌入,PY转变为PB.PB晶胞结构如图所示,其中
嵌入,PY转变为PB.PB晶胞结构如图所示,其中 周围最近且等距的
周围最近且等距的 有12个。图中“
有12个。图中“ ”位置被
”位置被 或
或 占据,用“
占据,用“ ”补全PB晶胞结构中Ⅰ和Ⅱ两个小立方体中的
”补全PB晶胞结构中Ⅰ和Ⅱ两个小立方体中的
 未画出)]
未画出)]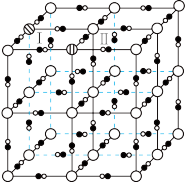
 能很容易地嵌入和脱嵌,因此PB可作为钾离子电池的正极材料。充电过程中,推测
能很容易地嵌入和脱嵌,因此PB可作为钾离子电池的正极材料。充电过程中,推测 会从PB中脱嵌出来,理由是
会从PB中脱嵌出来,理由是
您最近一年使用:0次
解题方法
7 . 利用零价铁(Fe)耦合过硫酸盐( )和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基
)和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基 和HO·产生的机理如图所示。
和HO·产生的机理如图所示。 的结构式是
的结构式是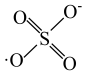 ,则
,则 的结构式是
的结构式是___________ 。
(2)过程ⅰ中反应的离子方程式是___________ 。
(3)过程ⅱ会导致溶液酸性增强,其中硫元素在反应前后均为+6价。该过程参与反应的物质还有(填化学式)___________ 。
(4)探究零价铁和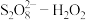 混合氧化剂体系降解水样中有机化合物M的能力。
混合氧化剂体系降解水样中有机化合物M的能力。
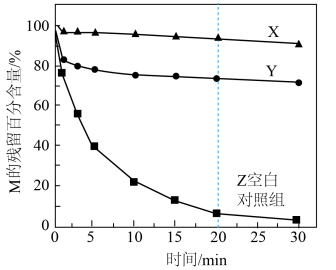
Ⅰ.通过加入甲醇或叔丁醇探究不同自由基降解M的能力。测得M的残留百分含量随时间变化如图所示。 ,叔丁醇只消耗HO·
,叔丁醇只消耗HO·
a.X中加入的是___________ (填“甲醇”或“叔丁醇")。
b.0~20min,Z中降解M的自由基主要是HO·,判断依据是___________ 。
Ⅱ.探究混合氧化剂中 的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的
的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的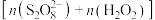 相同,其他条件不变。在相同时间内测得的实验数据如图所示。
相同,其他条件不变。在相同时间内测得的实验数据如图所示。
a.从①到④,TOC去除率升高的原因是___________ 。
b.从④到⑦,TOC去除率下降的原因是___________ 。
 )和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基
)和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基 和HO·产生的机理如图所示。
和HO·产生的机理如图所示。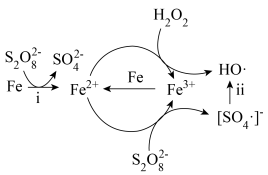
 的结构式是
的结构式是 ,则
,则 的结构式是
的结构式是(2)过程ⅰ中反应的离子方程式是
(3)过程ⅱ会导致溶液酸性增强,其中硫元素在反应前后均为+6价。该过程参与反应的物质还有(填化学式)
(4)探究零价铁和
 混合氧化剂体系降解水样中有机化合物M的能力。
混合氧化剂体系降解水样中有机化合物M的能力。Ⅰ.通过加入甲醇或叔丁醇探究不同自由基降解M的能力。测得M的残留百分含量随时间变化如图所示。
 ,叔丁醇只消耗HO·
,叔丁醇只消耗HO·a.X中加入的是
b.0~20min,Z中降解M的自由基主要是HO·,判断依据是
Ⅱ.探究混合氧化剂中
 的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的
的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的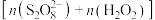 相同,其他条件不变。在相同时间内测得的实验数据如图所示。
相同,其他条件不变。在相同时间内测得的实验数据如图所示。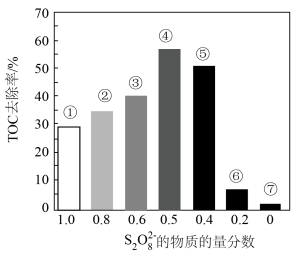
a.从①到④,TOC去除率升高的原因是
b.从④到⑦,TOC去除率下降的原因是
您最近一年使用:0次
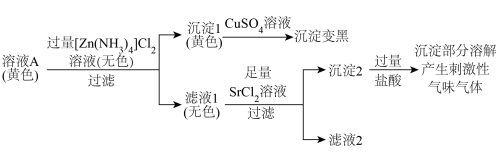
8 .  溶液久置变为黄色(记为溶液A)。探究溶液A中阴离子的种类。
溶液久置变为黄色(记为溶液A)。探究溶液A中阴离子的种类。
已知:
ⅰ.
ⅱ.某些盐的溶解性(注: 、
、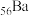 同主族)
同主族)
ⅲ. 、
、 、
、 、
、 、ZnS均可被
、ZnS均可被 氧化。
氧化。
(1)查阅资料可知,溶液变黄是因为生成了 ,
, 转化为
转化为 时,溶液的pH会
时,溶液的pH会___________ (填“升高”或“降低”)。
(2)探究溶液A中含硫粒子的种类。 和
和___________ (填离子符号)。
②向少量含淀粉的稀碘水中滴加滤液2(已调至中性),___________ (填现象),证实溶液A中有 。
。
③加入过量 溶液的目的是
溶液的目的是___________ 。
(3)利用如下实验可测定 中x的值。
中x的值。
【实验原理】 ,其中
,其中 和
和 的化学计量数之比等于
的化学计量数之比等于___________ 。通过测定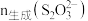 和
和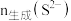 可确定x的值。
可确定x的值。
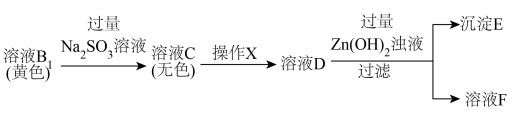
【实验过程】
实验Ⅰ 的目的是除去
的目的是除去 ,相关离子方程式是
,相关离子方程式是___________ 。
②实验Ⅱ中操作X是加入___________ (补全试剂和操作)。
③用 标准溶液滴定
标准溶液滴定___________ (填序号,下同),可确定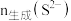 ;再用
;再用 标准溶液滴定
标准溶液滴定___________ ,可确定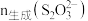 。(说明:滴定过程中需调节pH)
。(说明:滴定过程中需调节pH)
a.溶液A b.溶液 c.沉淀E d.溶液F
c.沉淀E d.溶液F
【数据处理】计算x的值。
 溶液久置变为黄色(记为溶液A)。探究溶液A中阴离子的种类。
溶液久置变为黄色(记为溶液A)。探究溶液A中阴离子的种类。已知:
ⅰ.

ⅱ.某些盐的溶解性(注:
 、
、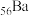 同主族)
同主族)| 盐 | ZnS(白色) | CuS(黑色) | SrS | 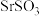 |  | 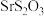 |
| 溶解性 | 难溶 | 极难溶 | 易溶 | 难溶 | 难溶 | 易溶 |
 、
、 、
、 、
、 、ZnS均可被
、ZnS均可被 氧化。
氧化。(1)查阅资料可知,溶液变黄是因为生成了
 ,
, 转化为
转化为 时,溶液的pH会
时,溶液的pH会(2)探究溶液A中含硫粒子的种类。
 和
和②向少量含淀粉的稀碘水中滴加滤液2(已调至中性),
 。
。③加入过量
 溶液的目的是
溶液的目的是(3)利用如下实验可测定
 中x的值。
中x的值。【实验原理】
 ,其中
,其中 和
和 的化学计量数之比等于
的化学计量数之比等于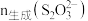 和
和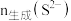 可确定x的值。
可确定x的值。【实验过程】
实验Ⅰ

 的目的是除去
的目的是除去 ,相关离子方程式是
,相关离子方程式是②实验Ⅱ中操作X是加入
③用
 标准溶液滴定
标准溶液滴定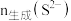 ;再用
;再用 标准溶液滴定
标准溶液滴定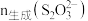 。(说明:滴定过程中需调节pH)
。(说明:滴定过程中需调节pH)a.溶液A b.溶液
 c.沉淀E d.溶液F
c.沉淀E d.溶液F【数据处理】计算x的值。
您最近一年使用:0次
9 . 脱落酸是一种抑制植物生长的激素,其衍生物I的合成路线如下。___________ 。
(2)D的结构简式是___________ 。
(3)E→F过程中,E中的___________ (填官能团名称,下同)变为F中的___________ 。
(4)H→I过程中, Cr2+转化为Cr3+,则参与反应的有机化合物H与Cr2+的物质的量之比是___________ 。
(5)依据上述合成路线的原理,利用其中原料,设计如下路线,合成有机化合物N,其结构简式如图所示,___________ 。
②试剂和条件:a是___________ ,c是___________ 。
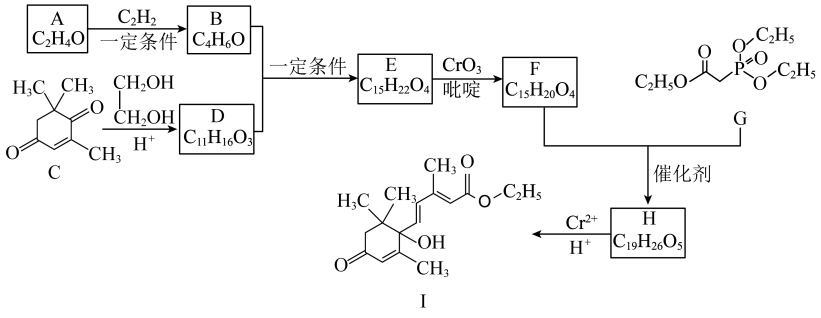
ⅰ.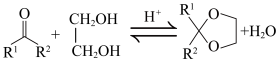
ⅱ.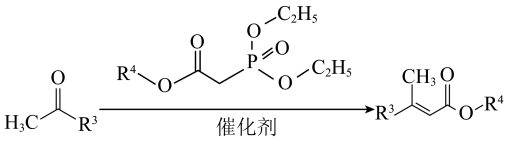
(2)D的结构简式是
(3)E→F过程中,E中的
(4)H→I过程中, Cr2+转化为Cr3+,则参与反应的有机化合物H与Cr2+的物质的量之比是
(5)依据上述合成路线的原理,利用其中原料,设计如下路线,合成有机化合物N,其结构简式如图所示,
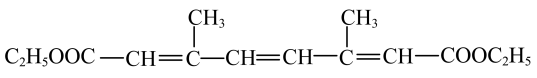 。
。
②试剂和条件:a是
您最近一年使用:0次
名校
解题方法
10 . (一)我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为___________ ;单晶硅的晶体类型为___________ 。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。
(2)CO2分子中存在___________ 个 键和
键和___________ 个 键。
键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是___________ 。
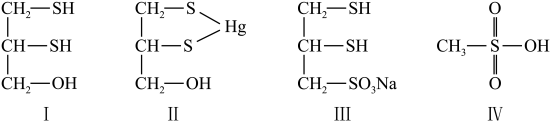
(二)很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。___________ 。
(5)H2S、CH4、H2O的沸点由高到低顺序为___________ 。
(6)汞的原子序数为80,位于元素周期表第___________ 周期第ⅡB族。
(7)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有___________ 。
A.在I中S原子采取sp3杂化 B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180° D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(8)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是___________ 。
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为
(2)CO2分子中存在
 键和
键和 键。
键。(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是
(二)很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
(5)H2S、CH4、H2O的沸点由高到低顺序为
(6)汞的原子序数为80,位于元素周期表第
(7)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有
A.在I中S原子采取sp3杂化 B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180° D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(8)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是
您最近一年使用:0次



