解题方法
1 . 将钴酞菁和三氯化铝复合嵌接在碳纳米管上,可制得一种高效催化剂。
(1)碳的几种单质如图所示。___________ 。
②下列说法正确的是_____ 。
a.金刚石中碳碳原子间是σ键
b.C60熔化时破坏的作用力是共价键
c.以上四种单质均能导电
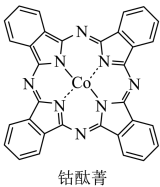
(2)钴酞菁是配位化合物,其分子结构如图所示。____________ 。
(3)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图1所示。AlF3结构属立方晶系,晶胞如图2所示。________ 。
②AlCl3的熔点为192℃,远低于AlF3的熔点1090℃的原因是_____________ 。
③AlF3晶体距离F最近的阳离子有_____ 个。
④AlF3的晶胞形状为正方体,边长为anm,该晶体密度为_____________ g•cm﹣3。(列出计算式,阿伏加德罗常数用NA表示,1nm=10﹣7cm)
(1)碳的几种单质如图所示。
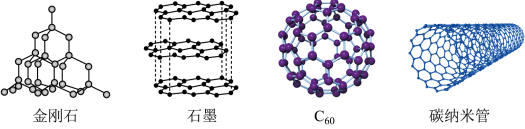
②下列说法正确的是
a.金刚石中碳碳原子间是σ键
b.C60熔化时破坏的作用力是共价键
c.以上四种单质均能导电
(2)钴酞菁是配位化合物,其分子结构如图所示。
(3)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图1所示。AlF3结构属立方晶系,晶胞如图2所示。
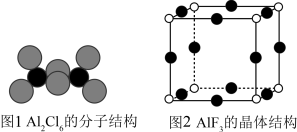
②AlCl3的熔点为192℃,远低于AlF3的熔点1090℃的原因是
③AlF3晶体距离F最近的阳离子有
④AlF3的晶胞形状为正方体,边长为anm,该晶体密度为
您最近一年使用:0次
2 . 原子结构、元素性质、元素在周期表中的位置之间存在密切的相互关系。如图是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
(1)a的原子结构示意图为___________ 。
(2)基态b原子核外电子占据的最高能级符号为_______ ,该能级的电子云轮廓图形状为 _______ 形。
(3)元素c位于周期表的_____ 区。
(4)元素b、d、e中电负性最大的是_______ (用元素符号表示)。
(5)基态f原子的价层电子排布式为___________ 。
(6)气态c原子失去核外不同电子所需能量如下:
①元素c的最高化合价为 _______ 。
②c原子的逐级电离能越来越大的原因是__________ 。
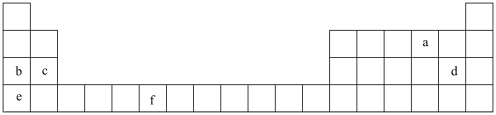
(1)a的原子结构示意图为
(2)基态b原子核外电子占据的最高能级符号为
(3)元素c位于周期表的
(4)元素b、d、e中电负性最大的是
(5)基态f原子的价层电子排布式为
(6)气态c原子失去核外不同电子所需能量如下:
| 电离能 | I1(第一电离能) | I2(第二电离能) | I3(第三电离能) |
| 能量/kJ•mol﹣1 | 737.7 | 1450.7 | 7732.7 |
②c原子的逐级电离能越来越大的原因是
您最近一年使用:0次
解题方法
3 . 某实验小组同学依据资料深入探究Fe3+在水溶液中的行为。
资料:ⅰ.Fe3+在水溶液中以[Fe(H2O)6]3的形式存在
ⅱ.[Fe(H2O)6]3+发生如下水解反应:[Fe(H2O)6]3++nH2O⇌[Fe(H2O)6(OH)n]3﹣n+nH3O+(n=0~6);
ⅲ.[FeCl4(H2O)2]﹣为黄色。
(1)配离子[Fe(H2O)6]3+的中心离子是_________ ,配体是 ________ ,配位数是 _____ 。
【实验一】分别向等浓度的Fe(NO3)3和FeCl3溶液中滴加硝酸,观察颜色变化。
(2)②中溶液褪色的原因是___________ 。
(3)③中溶液呈棕黄色与[FeCl4(H2O)2]﹣有关,支持此结论的实验现象是____________ 。
【实验二】分别以实验一①、③中的试剂作为待测液,用色度计测定其透光率。溶液透光率随温度变化曲线图如图(t1开始加热,t2停止加热;溶液颜色越深,透光率越低)。_______ (填“变浅”“变深”或“不变”)。
(5)由实验二,可以得出如下结论:
【结论1】FeCl3溶液中存在可逆反应:[Fe(H2O)6]3++4Cl﹣⇌[FeCl4(H2O)2]﹣+4H2O
得出此结论的理由是____________ 。
【结论2】结论1中反应的ΔH_______ (填“>0”或“<0”)。
(6)实验小组同学重新设计了一个实验,验证(5)中结论1。
实验方案:取①中溶液,____________________ (请描述必要的实验操作和现象)。
资料:ⅰ.Fe3+在水溶液中以[Fe(H2O)6]3的形式存在
ⅱ.[Fe(H2O)6]3+发生如下水解反应:[Fe(H2O)6]3++nH2O⇌[Fe(H2O)6(OH)n]3﹣n+nH3O+(n=0~6);
ⅲ.[FeCl4(H2O)2]﹣为黄色。
(1)配离子[Fe(H2O)6]3+的中心离子是
【实验一】分别向等浓度的Fe(NO3)3和FeCl3溶液中滴加硝酸,观察颜色变化。
| Ⅰ | ⅠI |
|
|
(2)②中溶液褪色的原因是
(3)③中溶液呈棕黄色与[FeCl4(H2O)2]﹣有关,支持此结论的实验现象是
【实验二】分别以实验一①、③中的试剂作为待测液,用色度计测定其透光率。溶液透光率随温度变化曲线图如图(t1开始加热,t2停止加热;溶液颜色越深,透光率越低)。

(5)由实验二,可以得出如下结论:
【结论1】FeCl3溶液中存在可逆反应:[Fe(H2O)6]3++4Cl﹣⇌[FeCl4(H2O)2]﹣+4H2O
得出此结论的理由是
【结论2】结论1中反应的ΔH
(6)实验小组同学重新设计了一个实验,验证(5)中结论1。
实验方案:取①中溶液,
您最近一年使用:0次
解题方法
4 .  是一种常用的氧化剂。某实验小组利用氯气氧化
是一种常用的氧化剂。某实验小组利用氯气氧化 制备
制备 并对其性质进行探究。
并对其性质进行探究。
【 的制备】
的制备】
(1)用下图装置制备 (加热和夹持装置已略去),装置B的作用是
(加热和夹持装置已略去),装置B的作用是___________ 。 ;
;___________ 。
【 的性质探究】
的性质探究】
资料:i. 在强酸性条件下被还原为
在强酸性条件下被还原为 ,在近中性条件下被还原成
,在近中性条件下被还原成 。
。
ii.单质硫可溶于 溶液,溶液呈淡黄色。
溶液,溶液呈淡黄色。
某小组研究 溶液与
溶液与 溶液反应,探究过程如下。
溶液反应,探究过程如下。
(3)①甲同学取实验Ⅰ中少量溶液进行实验,检测有 ,得出
,得出 被氧化成
被氧化成 的结论,乙同学否定了该结论,理由是
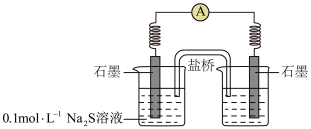
的结论,乙同学否定了该结论,理由是___________ 。
②同学讨论后,设计了如下实验,证实该条件下 的确可以将
的确可以将 氧化成
氧化成 。
。___________ 。
b.连通后电流计指针偏转,一段时间后,___________ (填操作和现象)。
(4)实验I的现象与资料i不相符,其原因是新生成的产物( )与过量的反应物(
)与过量的反应物( )发生反应,该反应的离子方程式是
)发生反应,该反应的离子方程式是___________ 。
(5)实验II的现象与资料也不完全相符,丙同学猜想原因与(4)中所述原因相似,其原因是___________ ,请设计验证此猜想的实验方案___________ 。
(6)反思:反应物相同而现象不同,表明物质变化不仅与其自身的性质有关,还与___________ 等因素有关。
 是一种常用的氧化剂。某实验小组利用氯气氧化
是一种常用的氧化剂。某实验小组利用氯气氧化 制备
制备 并对其性质进行探究。
并对其性质进行探究。【
 的制备】
的制备】(1)用下图装置制备
 (加热和夹持装置已略去),装置B的作用是
(加热和夹持装置已略去),装置B的作用是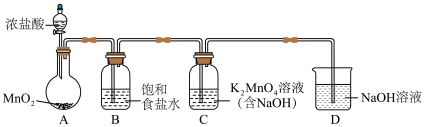
 ;
;【
 的性质探究】
的性质探究】资料:i.
 在强酸性条件下被还原为
在强酸性条件下被还原为 ,在近中性条件下被还原成
,在近中性条件下被还原成 。
。ii.单质硫可溶于
 溶液,溶液呈淡黄色。
溶液,溶液呈淡黄色。某小组研究
 溶液与
溶液与 溶液反应,探究过程如下。
溶液反应,探究过程如下。| 实验序号 | 实验过程 | 实验现象 |
| Ⅰ |
| 紫色变浅( ),生成棕褐色沉淀( ),生成棕褐色沉淀( ) ) |
| Ⅱ |
| 溶液呈淡黄色( ),生成浅粉色沉淀(MnS) ),生成浅粉色沉淀(MnS) |
(3)①甲同学取实验Ⅰ中少量溶液进行实验,检测有
 ,得出
,得出 被氧化成
被氧化成 的结论,乙同学否定了该结论,理由是
的结论,乙同学否定了该结论,理由是②同学讨论后,设计了如下实验,证实该条件下
 的确可以将
的确可以将 氧化成
氧化成 。
。
b.连通后电流计指针偏转,一段时间后,
(4)实验I的现象与资料i不相符,其原因是新生成的产物(
 )与过量的反应物(
)与过量的反应物( )发生反应,该反应的离子方程式是
)发生反应,该反应的离子方程式是(5)实验II的现象与资料也不完全相符,丙同学猜想原因与(4)中所述原因相似,其原因是
(6)反思:反应物相同而现象不同,表明物质变化不仅与其自身的性质有关,还与
您最近一年使用:0次
解题方法
5 . 草酸钴( )可用于催化剂的制备,用水钻矿(主要成分为
)可用于催化剂的制备,用水钻矿(主要成分为 ,含有少量
,含有少量 、
、 、
、 、
、 、
、 、
、 杂质)制备草酸钴工艺流程如图所示:
杂质)制备草酸钴工艺流程如图所示: 不能直接被
不能直接被 浸出;
浸出;
②酸性条件下, 转化为
转化为 ,但
,但 不会氧化
不会氧化 ;
;
③部分阳离子以氢氧化物形式沉淀时溶液的 如表所示:
如表所示:
(1)酸浸时,为提高矿石的溶解速率可采取的一种措施为___________ 。
(2)浸出过程中 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(3)向“浸出液”中加入 的作用是
的作用是___________ 。
(4)加入 调节溶液
调节溶液 至5.2,过滤所得到的沉淀成分为
至5.2,过滤所得到的沉淀成分为___________ 。
(5)滤液I“除镁、钙”是将镁、钙离子转化为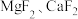 沉淀。已知在该操作温度下,
沉淀。已知在该操作温度下,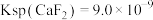 ,若使
,若使 沉淀完全[c(Ca2+)≤10-5mol/L],所需
沉淀完全[c(Ca2+)≤10-5mol/L],所需 浓度不低于
浓度不低于___________  。
。
(6)在萃取除锰时,先向除杂后的溶液中加入有机酸萃取剂,金属离子的萃取率与溶液 的关系如图,萃取应选择的
的关系如图,萃取应选择的 范围是
范围是___________ 。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5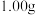 样品,将其用适当试剂转化,得到草酸铵[
样品,将其用适当试剂转化,得到草酸铵[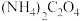 ]溶液,再用过量稀硫酸酸化,用
]溶液,再用过量稀硫酸酸化,用
 溶液滴定,已知
溶液滴定,已知 在酸性条件下被还原为
在酸性条件下被还原为 ,达到滴定终点时,用去
,达到滴定终点时,用去 溶液
溶液 。所得草酸钴样品中
。所得草酸钴样品中 的纯度为
的纯度为___________ [已知: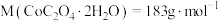 ]。
]。
 )可用于催化剂的制备,用水钻矿(主要成分为
)可用于催化剂的制备,用水钻矿(主要成分为 ,含有少量
,含有少量 、
、 、
、 、
、 、
、 、
、 杂质)制备草酸钴工艺流程如图所示:
杂质)制备草酸钴工艺流程如图所示:
 不能直接被
不能直接被 浸出;
浸出;②酸性条件下,
 转化为
转化为 ,但
,但 不会氧化
不会氧化 ;
;③部分阳离子以氢氧化物形式沉淀时溶液的
 如表所示:
如表所示:| 沉淀物 |  |  |  |  |  |
开始沉淀时的 | 2.7 | 7.6 | 4.0 | 7.6 | 7.7 |
完全沉淀时的 | 3.7 | 9.6 | 5.2 | 9.2 | 9.8 |
(2)浸出过程中
 发生反应的离子方程式为
发生反应的离子方程式为(3)向“浸出液”中加入
 的作用是
的作用是(4)加入
 调节溶液
调节溶液 至5.2,过滤所得到的沉淀成分为
至5.2,过滤所得到的沉淀成分为(5)滤液I“除镁、钙”是将镁、钙离子转化为
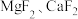 沉淀。已知在该操作温度下,
沉淀。已知在该操作温度下,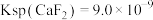 ,若使
,若使 沉淀完全[c(Ca2+)≤10-5mol/L],所需
沉淀完全[c(Ca2+)≤10-5mol/L],所需 浓度不低于
浓度不低于 。
。(6)在萃取除锰时,先向除杂后的溶液中加入有机酸萃取剂,金属离子的萃取率与溶液
 的关系如图,萃取应选择的
的关系如图,萃取应选择的 范围是
范围是A.2.0~2.5 B.3.0~3.5 C.4.0~4.5

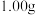 样品,将其用适当试剂转化,得到草酸铵[
样品,将其用适当试剂转化,得到草酸铵[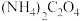 ]溶液,再用过量稀硫酸酸化,用
]溶液,再用过量稀硫酸酸化,用
 溶液滴定,已知
溶液滴定,已知 在酸性条件下被还原为
在酸性条件下被还原为 ,达到滴定终点时,用去
,达到滴定终点时,用去 溶液
溶液 。所得草酸钴样品中
。所得草酸钴样品中 的纯度为
的纯度为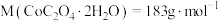 ]。
]。
您最近一年使用:0次
解题方法
6 . 氮元素能与金属或者非金属元素形成种类繁多、应用广泛的化合物。
(1)基态N原子的价层电子轨道表示式是___________ 。
(2)与碳氢化合物类似,N、H两元素之间也可以形成氮烷、氮烯。
①在最简单的氮烯分子中,N的杂化方式是___________ 。
② 具有很强的还原性,是常用的火箭推进剂,它在常温常压下为无色液体。判断
具有很强的还原性,是常用的火箭推进剂,它在常温常压下为无色液体。判断 是否溶于水并说明理由
是否溶于水并说明理由___________ 。
(3)配合物 可用作广谱杀菌剂,其中Cu属于
可用作广谱杀菌剂,其中Cu属于___________ 区元素,该配合物中的配位原子是___________ ,配位数是___________ 。
(4) 的某种晶体结构中,原子间均以单键结合,其硬度比金刚石大,原因是
的某种晶体结构中,原子间均以单键结合,其硬度比金刚石大,原因是___________ 。
(5) 和
和 形成的化合物是一种重要的半导体材料。其某种晶胞形状为立方体,边长为
形成的化合物是一种重要的半导体材料。其某种晶胞形状为立方体,边长为 ,结构如图所示。
,结构如图所示。 最近的
最近的 有
有___________ 个。
②已知阿伏加德罗常数为 ,氮化镓(GaN)的摩尔质量为
,氮化镓(GaN)的摩尔质量为 ,该晶体的密度表达式为
,该晶体的密度表达式为___________  (
(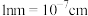 )。
)。
(1)基态N原子的价层电子轨道表示式是
(2)与碳氢化合物类似,N、H两元素之间也可以形成氮烷、氮烯。
①在最简单的氮烯分子中,N的杂化方式是
②
 具有很强的还原性,是常用的火箭推进剂,它在常温常压下为无色液体。判断
具有很强的还原性,是常用的火箭推进剂,它在常温常压下为无色液体。判断 是否溶于水并说明理由
是否溶于水并说明理由(3)配合物
 可用作广谱杀菌剂,其中Cu属于
可用作广谱杀菌剂,其中Cu属于(4)
 的某种晶体结构中,原子间均以单键结合,其硬度比金刚石大,原因是
的某种晶体结构中,原子间均以单键结合,其硬度比金刚石大,原因是(5)
 和
和 形成的化合物是一种重要的半导体材料。其某种晶胞形状为立方体,边长为
形成的化合物是一种重要的半导体材料。其某种晶胞形状为立方体,边长为 ,结构如图所示。
,结构如图所示。
 最近的
最近的 有
有②已知阿伏加德罗常数为
 ,氮化镓(GaN)的摩尔质量为
,氮化镓(GaN)的摩尔质量为 ,该晶体的密度表达式为
,该晶体的密度表达式为 (
(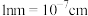 )。
)。
您最近一年使用:0次
名校
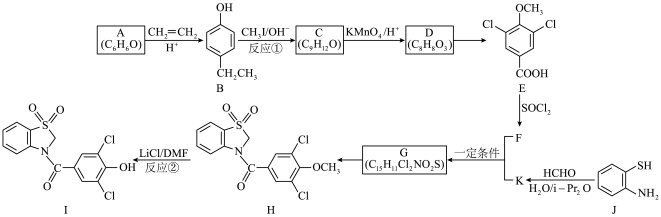
7 . 多丁纳德(化合物I)是一种治疗痛风的药物,以下为其合成路线之一(部分条件已略去)。___________ 。
(2)A→B的反应类型是___________ 。
(3)C的结构简式是___________ 。
(4)D→E的反应试剂和条件是___________ 。
(5)在D的同分异构体中,同时满足下列条件的结构简式是___________ 。
①含有苯环
②遇 溶液显紫色
溶液显紫色
③与 溶液反应放出
溶液反应放出
④核磁共振氢谱显示为五组峰,且峰面积比为2:2:2:1:1
(6)已知K的分子式为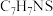 ,F+K→G的方程式是
,F+K→G的方程式是___________ 。
(7)设计反应①和反应②的目的是___________ 。
(8)J→K的反应还可能生成高分子M,写出M的一种结构简式___________ 。
已知: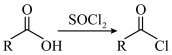
(2)A→B的反应类型是
(3)C的结构简式是
(4)D→E的反应试剂和条件是
(5)在D的同分异构体中,同时满足下列条件的结构简式是
①含有苯环
②遇
 溶液显紫色
溶液显紫色③与
 溶液反应放出
溶液反应放出
④核磁共振氢谱显示为五组峰,且峰面积比为2:2:2:1:1
(6)已知K的分子式为
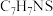 ,F+K→G的方程式是
,F+K→G的方程式是(7)设计反应①和反应②的目的是
(8)J→K的反应还可能生成高分子M,写出M的一种结构简式
您最近一年使用:0次
2024-04-10更新
|
335次组卷
|
2卷引用:北京市房山区2024届高三一模化学试题
名校
解题方法
8 . 大气中 含量的控制和
含量的控制和 资源化利用具有重要意义。
资源化利用具有重要意义。
(1) 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:
Ⅰ: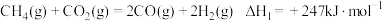
Ⅱ: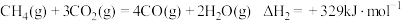
反应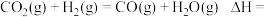
___________
(2)工业上可利用 制备
制备 :
:
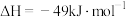
① 时,该反应的平衡常数
时,该反应的平衡常数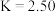 ,该温度下某时刻测得体系内四种物质的浓度均为
,该温度下某时刻测得体系内四种物质的浓度均为 ,则此时
,则此时
___________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②提高反应速率且增大 的平衡产率,可采取的措施
的平衡产率,可采取的措施___________ 。
A.升高反应温度
B.使用合适的催化剂
C.增大体系压强
D.从平衡体系中及时分离出
(3)一种捕获 并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以
并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以 为载气,将恒定组成的
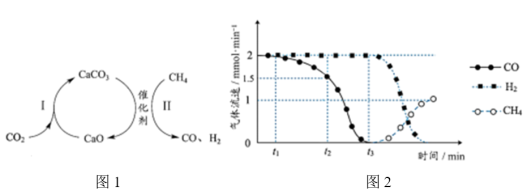
为载气,将恒定组成的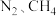 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳,推测发生了副反应(反应Ⅲ):
,在催化剂上有积碳,推测发生了副反应(反应Ⅲ): 。
。___________ 。
② 时间段内,反应Ⅱ速率减小至0的原因
时间段内,反应Ⅱ速率减小至0的原因___________ 。
③ 时刻,反应II和反应Ⅲ生成
时刻,反应II和反应Ⅲ生成 的速率之比为
的速率之比为___________ 。
(4)在铜基配合物的催化作用下,利用电化学原理可将 转化为碳基燃料(包括
转化为碳基燃料(包括 、烷烃和羧酸等),其装置原理如图所示。
、烷烃和羧酸等),其装置原理如图所示。___________ 。
②当有 通过质子交换膜时,理论上最多生成
通过质子交换膜时,理论上最多生成 的质量为
的质量为___________ 。
 含量的控制和
含量的控制和 资源化利用具有重要意义。
资源化利用具有重要意义。(1)
 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:Ⅰ:
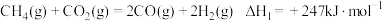
Ⅱ:
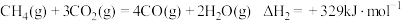
反应
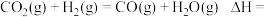
(2)工业上可利用
 制备
制备 :
:
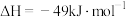
①
 时,该反应的平衡常数
时,该反应的平衡常数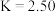 ,该温度下某时刻测得体系内四种物质的浓度均为
,该温度下某时刻测得体系内四种物质的浓度均为 ,则此时
,则此时
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②提高反应速率且增大
 的平衡产率,可采取的措施
的平衡产率,可采取的措施A.升高反应温度
B.使用合适的催化剂
C.增大体系压强
D.从平衡体系中及时分离出

(3)一种捕获
 并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以
并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳,推测发生了副反应(反应Ⅲ):
,在催化剂上有积碳,推测发生了副反应(反应Ⅲ): 。
。
②
 时间段内,反应Ⅱ速率减小至0的原因
时间段内,反应Ⅱ速率减小至0的原因③
 时刻,反应II和反应Ⅲ生成
时刻,反应II和反应Ⅲ生成 的速率之比为
的速率之比为(4)在铜基配合物的催化作用下,利用电化学原理可将
 转化为碳基燃料(包括
转化为碳基燃料(包括 、烷烃和羧酸等),其装置原理如图所示。
、烷烃和羧酸等),其装置原理如图所示。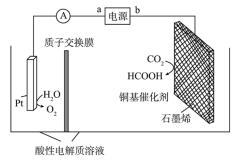
②当有
 通过质子交换膜时,理论上最多生成
通过质子交换膜时,理论上最多生成 的质量为
的质量为
您最近一年使用:0次
2024-04-10更新
|
293次组卷
|
2卷引用:北京市房山区2024届高三一模化学试题
解题方法
9 . 某小组用如下装置(夹持装置已略去)制备并探究  的性质。
的性质。
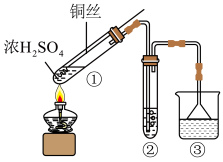
(1)制备 的化学方程式是
的化学方程式是___________ 。
(2)①中控制生成 多少的操作是
多少的操作是___________ 。
(3)②用于探究 的性质,依据下列试剂和现象
的性质,依据下列试剂和现象不能 得出相应结论的是___________ 。
(4)③用于处理 尾气,可选用的试剂是
尾气,可选用的试剂是___________
(5)铜在此反应中作还原剂,证据是:反应结束后,将少量①中溶液倒入水中,溶液呈___________ 色。
 的性质。
的性质。
(1)制备
 的化学方程式是
的化学方程式是(2)①中控制生成
 多少的操作是
多少的操作是(3)②用于探究
 的性质,依据下列试剂和现象
的性质,依据下列试剂和现象| ②中试剂 | 现象 | 结论 | |
| a | 品红溶液 | 红色褪去 |  有漂白性 有漂白性 |
| b |  溶液 溶液 | 紫色褪去 |  有还原性 有还原性 |
| c |  溶液 溶液 | 溶液变浑浊,有淡黄色固体生成 |  有酸性 有酸性 |
(4)③用于处理
 尾气,可选用的试剂是
尾气,可选用的试剂是(5)铜在此反应中作还原剂,证据是:反应结束后,将少量①中溶液倒入水中,溶液呈
您最近一年使用:0次
10 . 为探究  与
与  的反应,某小组同学选用三种不同的铁盐溶液(
的反应,某小组同学选用三种不同的铁盐溶液( 均约为1)进行了如下实验。
均约为1)进行了如下实验。
【查阅资料】
ⅰ.氯化亚铜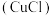 是难溶于水的白色固体。
是难溶于水的白色固体。
ⅱ. 与
与 可发生反应,生成棕色的
可发生反应,生成棕色的 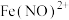 。
。
【分析解释】
(1)实验Ⅰ中发生反应的离子方程式是___________ 。
(2)为探究实验Ⅱ中白色固体的组成,小组同学设计并完成了以下实验。
步骤1:取少量洗涤后的白色固体于试管中,向其中滴加稀硝酸,观察到固体溶解,溶液变为蓝色,液面上方有少量红棕色气体生成。
步骤2:向步骤1所得溶液中滴加 溶液,生成白色沉淀。
溶液,生成白色沉淀。
①能证明实验Ⅱ白色固体中含有+1价铜的现象是___________
②步骤2中滴加 溶液的目的是
溶液的目的是___________ 。
通过以上实验,证明了实验Ⅱ中白色固体为 。
。
(3)小组同学对实验Ⅲ中的氧化剂进行了探究和分析。
①甲同学取少量棕色溶液,向其中滴加2滴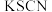 溶液,溶液变为红色,由此推断
溶液,溶液变为红色,由此推断 没有参与氧化反应。乙同学认为该推断不合理,理由是
没有参与氧化反应。乙同学认为该推断不合理,理由是___________
②乙同学认为溶液呈棕色与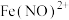 有关,
有关, 和
和 均参与了氧化反应,请设计简单实验进行验证
均参与了氧化反应,请设计简单实验进行验证___________
【反思评价】
(4)综合上述实验,说明 与
与  的反应与
的反应与___________ 等因素有关。
 与
与  的反应,某小组同学选用三种不同的铁盐溶液(
的反应,某小组同学选用三种不同的铁盐溶液( 均约为1)进行了如下实验。
均约为1)进行了如下实验。| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 向盛有 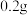 铜片的试管中加入 铜片的试管中加入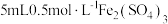 溶液 溶液 | 铜片部分溶解,溶液变为蓝色 |
| Ⅱ | 向盛有 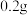 铜片的试管中加入 铜片的试管中加入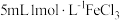 溶液 溶液 | 铜片部分溶解,溶液黄色变浅,铜片表面有白色固体出现 |
| Ⅲ | 向盛有 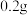 铜片的试管中加入 铜片的试管中加入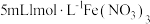 溶液 溶液 | 铜片部分溶解,溶液变为棕色,实验过程中未见气泡产生 |
ⅰ.氯化亚铜
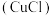 是难溶于水的白色固体。
是难溶于水的白色固体。ⅱ.
 与
与 可发生反应,生成棕色的
可发生反应,生成棕色的 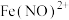 。
。【分析解释】
(1)实验Ⅰ中发生反应的离子方程式是
(2)为探究实验Ⅱ中白色固体的组成,小组同学设计并完成了以下实验。
步骤1:取少量洗涤后的白色固体于试管中,向其中滴加稀硝酸,观察到固体溶解,溶液变为蓝色,液面上方有少量红棕色气体生成。
步骤2:向步骤1所得溶液中滴加
 溶液,生成白色沉淀。
溶液,生成白色沉淀。①能证明实验Ⅱ白色固体中含有+1价铜的现象是
②步骤2中滴加
 溶液的目的是
溶液的目的是通过以上实验,证明了实验Ⅱ中白色固体为
 。
。(3)小组同学对实验Ⅲ中的氧化剂进行了探究和分析。
①甲同学取少量棕色溶液,向其中滴加2滴
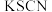 溶液,溶液变为红色,由此推断
溶液,溶液变为红色,由此推断 没有参与氧化反应。乙同学认为该推断不合理,理由是
没有参与氧化反应。乙同学认为该推断不合理,理由是②乙同学认为溶液呈棕色与
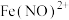 有关,
有关, 和
和 均参与了氧化反应,请设计简单实验进行验证
均参与了氧化反应,请设计简单实验进行验证【反思评价】
(4)综合上述实验,说明
 与
与  的反应与
的反应与
您最近一年使用:0次







