名校
1 . 工业上常以甘蔗为原料制糖,同时得到大量的甘蔗渣。某制糖厂对甘蔗渣进行综合利用的生产流程如图。
请回答下列问题:
(1)A也可由戊烷裂化裂解制得。写出一氯代物只有一种的戊烷同分异构体的结构简式___________ 。D中所含官能团的名称为___________ 。
(2)在F的同系物中最简单的有机物的空间结构为___________ 。与F互为同系物且含有5个碳原子的同分异构体共有___________ 种。
(3)写出物质N在人体组织中为生命活动提供能量的氧化反应方程式:___________ 。
(4)写出下列编号对应反应的化学反应方程式,并按要求注明⑥的反应类型:
②___________ ;
④___________ ;
⑥___________ ,___________ (填反应类型)。
(5)反应④制取E的装置如图所示。___________ (填字母)。
a.X溶液为饱和 溶液
溶液
b.实验时,先加浓硫酸,再加无水乙醇和冰醋酸
c.一段时间后,观察到X溶液的液面上有一层无色有特殊香味的油状液体
d.实验结束时,采用蒸发的方法将乙酸乙酯从混合物中分离出来
ii.图中球形干燥管的作用是___________ 。

请回答下列问题:
(1)A也可由戊烷裂化裂解制得。写出一氯代物只有一种的戊烷同分异构体的结构简式
(2)在F的同系物中最简单的有机物的空间结构为
(3)写出物质N在人体组织中为生命活动提供能量的氧化反应方程式:
(4)写出下列编号对应反应的化学反应方程式,并按要求注明⑥的反应类型:
②
④
⑥
(5)反应④制取E的装置如图所示。
a.X溶液为饱和
 溶液
溶液b.实验时,先加浓硫酸,再加无水乙醇和冰醋酸
c.一段时间后,观察到X溶液的液面上有一层无色有特殊香味的油状液体
d.实验结束时,采用蒸发的方法将乙酸乙酯从混合物中分离出来
ii.图中球形干燥管的作用是
您最近一年使用:0次
名校
解题方法
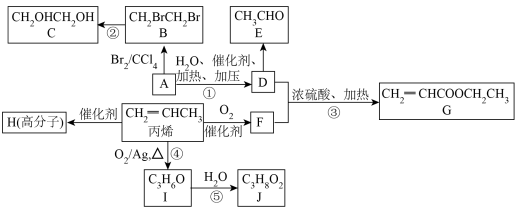
2 . A是一种重要的有机化工原料,其产量通常用来衡量一个国家石油化学工业的发展水平。结合下图物质间转化关系回答下列问题:___________ ,G中含氧官能团的名称为___________ 。
(2)高分子化合物H是一种常见的合成纤维—丙纶,其结构简式为___________ 。
(3)反应③的化学方程式为___________ ,反应类型为___________ 。
(4)反应⑤的化学方程式为___________ 。
(5)F与氢气发生加成反应的产物为K,写出K的同分异构体中属于酯的一种物质的结构简式:___________ 。
(6)15.2 g J与足量的金属Na完全反应,生成标准状况下氢气的体积为___________ L。
已知:CH2=CH2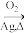
 ,
, +H2O
+H2O CH2OHCH2OH。
CH2OHCH2OH。
(2)高分子化合物H是一种常见的合成纤维—丙纶,其结构简式为
(3)反应③的化学方程式为
(4)反应⑤的化学方程式为
(5)F与氢气发生加成反应的产物为K,写出K的同分异构体中属于酯的一种物质的结构简式:
(6)15.2 g J与足量的金属Na完全反应,生成标准状况下氢气的体积为
您最近一年使用:0次
7日内更新
|
133次组卷
|
3卷引用:河南省南阳市第一中学校2023-2024学年高一下学期5月月考化学试题
名校
解题方法
3 . 甲醇是重要的化工原料,利用合成气(CO、 、
、 )在催化剂的作用下合成甲醇。在体积为1L的恒容密闭容器中,充入1.0 mol
)在催化剂的作用下合成甲醇。在体积为1L的恒容密闭容器中,充入1.0 mol  和3.0 mol
和3.0 mol  ,在一定条件下发生反应:
,在一定条件下发生反应: ,测得
,测得 和
和 的物质的量随时间的变化如图所示。回答下列问题:
的物质的量随时间的变化如图所示。回答下列问题:___________ mol⋅L ⋅min
⋅min ,此时v(正)
,此时v(正)___________ v(逆)(填“>”“<”或“=”)。
②下列措施能增大反应速率的是___________ (填字母)。
A.升高温度 B.降低压强 C.减小 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂
(2)反应达到平衡时, 的转化率为
的转化率为___________ , 的体积分数为
的体积分数为___________ 。
(3)下列描述中能说明上述反应达到平衡状态的是___________(填字母)。
(4)化石燃料燃烧产生的 是主要的温室气体之一,使用电化学方法能够对
是主要的温室气体之一,使用电化学方法能够对 进行吸收。利用活泼金属与
进行吸收。利用活泼金属与 的反应,能够构建金属
的反应,能够构建金属 电池。其中一种
电池。其中一种 电池的模型如下图所示(图中
电池的模型如下图所示(图中 是固体):
是固体):___________ (填“正”或“负”)极,正极电极反应式为___________ 。
②该电池中每转移2 mol电子,能够吸收___________ mol  。
。
 、
、 )在催化剂的作用下合成甲醇。在体积为1L的恒容密闭容器中,充入1.0 mol
)在催化剂的作用下合成甲醇。在体积为1L的恒容密闭容器中,充入1.0 mol  和3.0 mol
和3.0 mol  ,在一定条件下发生反应:
,在一定条件下发生反应: ,测得
,测得 和
和 的物质的量随时间的变化如图所示。回答下列问题:
的物质的量随时间的变化如图所示。回答下列问题: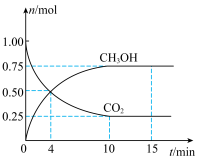
 ⋅min
⋅min ,此时v(正)
,此时v(正)②下列措施能增大反应速率的是
A.升高温度 B.降低压强 C.减小
 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂(2)反应达到平衡时,
 的转化率为
的转化率为 的体积分数为
的体积分数为(3)下列描述中能说明上述反应达到平衡状态的是___________(填字母)。
A. 、 、 、 、 、 、 四种物质的浓度相等 四种物质的浓度相等 |
| B.混合气体的密度不随时间的变化而变化 |
| C.混合气体的总压强不随时间的变化而变化 |
D.单位时间内消耗3 mol  的同时生成1 mol 的同时生成1 mol  |
(4)化石燃料燃烧产生的
 是主要的温室气体之一,使用电化学方法能够对
是主要的温室气体之一,使用电化学方法能够对 进行吸收。利用活泼金属与
进行吸收。利用活泼金属与 的反应,能够构建金属
的反应,能够构建金属 电池。其中一种
电池。其中一种 电池的模型如下图所示(图中
电池的模型如下图所示(图中 是固体):
是固体):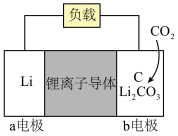
②该电池中每转移2 mol电子,能够吸收
 。
。
您最近一年使用:0次
7日内更新
|
70次组卷
|
3卷引用:河南省南阳市第一中学校2023-2024学年高一下学期5月月考化学试题
名校
解题方法
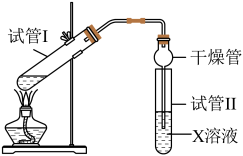
4 . 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制取乙酸乙酯的主要步骤如下:
I.在甲试管(如图)中先加入3 mL乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸和2 mL乙酸,再加入几片碎瓷片;
Ⅱ.按图连接好装置(装置气密性良好),小火均匀地加热3~5min;
Ⅲ.待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。___________ 。
②与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是___________ 。
③试管乙中的饱和碳酸钠溶液的作用是___________ ,
(2)欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器是___________ 。
(3)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学再次利用(1)中装置进行了以下4个实验。实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后,充分振荡乙试管,再测有机层的厚度,实验记录如下:
①实验D的目的是与实验C相对照,证明H⁺对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是___________ mL和___________ 1mol⋅L 。
。
②若加入的乙酸为120 g,乙醇为138 g,发生酯化反应得到132 g乙酸乙酯,试计算该反应的产品的产率为___________ (产率 )。
)。
I.在甲试管(如图)中先加入3 mL乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸和2 mL乙酸,再加入几片碎瓷片;
Ⅱ.按图连接好装置(装置气密性良好),小火均匀地加热3~5min;
Ⅲ.待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。
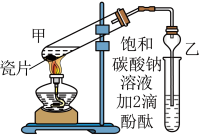
②与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是
③试管乙中的饱和碳酸钠溶液的作用是
(2)欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器是
(3)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学再次利用(1)中装置进行了以下4个实验。实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后,充分振荡乙试管,再测有机层的厚度,实验记录如下:
| 实验编号 | 甲试管中试剂 | 乙试管中试剂 | 有机层的厚度/cm |
| A | 2 mL乙醇、1 mL乙酸、3 mL 18 mol·L 浓硫酸 浓硫酸 | 饱和 溶液 溶液 | 3.0 |
| B | 2 mL乙醇、1 mL乙酸、3 mL  | 0.1 | |
| C | 2 mL乙醇、1 mL乙酸、3 mL 1 mol·L  溶液 溶液 | 0.6 | |
| D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
 。
。②若加入的乙酸为120 g,乙醇为138 g,发生酯化反应得到132 g乙酸乙酯,试计算该反应的产品的产率为
 )。
)。
您最近一年使用:0次
7日内更新
|
41次组卷
|
2卷引用:河南省南阳市第一中学校2023-2024学年高一下学期5月月考化学试题
名校
解题方法
5 . 元素周期表与元素周期律在化学学习研究中有很重要的作用。Q、W、X、Y、Z、M是元素周期表中原子序数依次增大的六种短周期主族元素,这六种元素的信息如下表所示。
回答下列问题:
(1)Y在元素周期表中的位置是___________ 。
(2)X的元素符号为___________ ,写出元素W的常见单质和元素X的单质在加热条件下生成的物质L与W的简单氢化物发生反应的化学方程式:___________ 。
(3)元素N与元素M同主族,且N元素位于M元素的下一周期,则常温下元素N的单质颜色为___________ ,M、N的简单气态氢化物的稳定性:___________>___________(填化学式)___________ 。
(4)下列对于Q元素及其化合物的推断正确的是___________ (填字母)。
A.Q的最低负价与最高正价的代数和为0
B.Q的简单氢化物的稳定性强于W的简单氢化物的稳定性
C.Q的氧化物均有毒
(5)探寻物质性质的差异性是学习化学的重要方法之一,Q、Z、M三种元素的最高价氧化物对应的水化物中酸性最强的是___________ (填化学式)。Z的最高价氧化物对应的水化物的水溶液与Y的最高价氧化物对应的水化物发生反应的离子方程式为___________ 。
| 元素 | 信息 |
| Q | 元素Q的一种单质可用于制作铅笔芯 |
| W | 元素W的一种单质可用于供给呼吸 |
| X | X元素的最高价氧化物对应的水化物在第三周期中碱性最强 |
| Y | 元素Y与X同周期,其最高价氧化物对应的水化物表现出两性 |
| Z | 元素Z与W同族 |
| M | M元素的最高化合价为+7价 |
(1)Y在元素周期表中的位置是
(2)X的元素符号为
(3)元素N与元素M同主族,且N元素位于M元素的下一周期,则常温下元素N的单质颜色为
(4)下列对于Q元素及其化合物的推断正确的是
A.Q的最低负价与最高正价的代数和为0
B.Q的简单氢化物的稳定性强于W的简单氢化物的稳定性
C.Q的氧化物均有毒
(5)探寻物质性质的差异性是学习化学的重要方法之一,Q、Z、M三种元素的最高价氧化物对应的水化物中酸性最强的是
您最近一年使用:0次
7日内更新
|
42次组卷
|
2卷引用:河南省南阳市第一中学校2023-2024学年高一下学期5月月考化学试题
6 . 为了除去某NaCl固体样品中含有的 、
、 和
和 杂质,某化学小组选用
杂质,某化学小组选用 溶液、稀盐酸、
溶液、稀盐酸、 溶液三种试剂设计了如下流程。
溶液三种试剂设计了如下流程。______ 、____ 、____ 。
(2)沉淀C的成分是____ 。
(3)写出加入碳酸钠溶液后发生反应的化学方程式________ 。(写出一个即可)
 、
、 和
和 杂质,某化学小组选用
杂质,某化学小组选用 溶液、稀盐酸、
溶液、稀盐酸、 溶液三种试剂设计了如下流程。
溶液三种试剂设计了如下流程。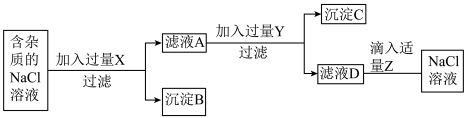
(2)沉淀C的成分是
(3)写出加入碳酸钠溶液后发生反应的化学方程式
您最近一年使用:0次
名校
解题方法
7 . 锑白 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的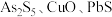 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: ;
;
②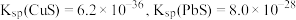 。
。
回答下列问题:
(1)“粉碎”辉锑矿的目的是___________ 。
(2)“滤渣Ⅰ”的主要成分除不溶性杂质外还有S、___________ (填化学式); 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为___________ 。
(3)“除砷”时,反应中氧化剂与还原剂的物质的量之比为___________ (P转化为最高价态)。
(4)若浸取液中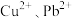 的浓度均为
的浓度均为 ,则c(S2-)≥
,则c(S2-)≥___________  才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时
才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时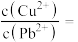
___________ 。
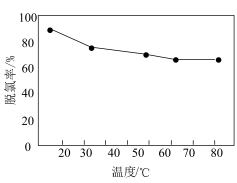
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:___________ 。
(6)锑可用于制备超亮光电极材料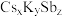 ,其晶胞结构如图所示,晶体a的化学式为
,其晶胞结构如图所示,晶体a的化学式为___________ ,晶体b中与 距离最近的
距离最近的 的个数为
的个数为___________ 。
 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的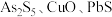 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: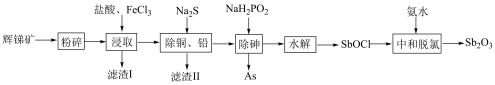
 ;
;②
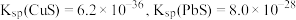 。
。回答下列问题:
(1)“粉碎”辉锑矿的目的是
(2)“滤渣Ⅰ”的主要成分除不溶性杂质外还有S、
 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为(3)“除砷”时,反应中氧化剂与还原剂的物质的量之比为
(4)若浸取液中
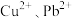 的浓度均为
的浓度均为 ,则c(S2-)≥
,则c(S2-)≥ 才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时
才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时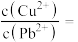
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:
(6)锑可用于制备超亮光电极材料
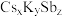 ,其晶胞结构如图所示,晶体a的化学式为
,其晶胞结构如图所示,晶体a的化学式为 距离最近的
距离最近的 的个数为
的个数为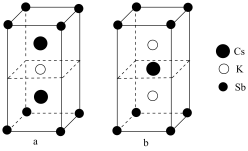
您最近一年使用:0次
名校
8 . 化合物M是一种功能高分子材料。实验室由A制备M的一种合成路线如图所示:
(1)A的结构简式为___________ (任写一种);B中所含手性碳的数目为___________ ;由C生成D时,C中碳原子的杂化方式是否改变:___________ (填“是”或“否”)。
(2)Q是E的同分异构体。同时满足下列条件的Q的结构有___________ 种(不考虑立体异构)。
i.含有2个酚羟基。
ii.核磁共振氢谱中有5组吸收峰。
(3)由G生成M的化学方程式为___________ 。
(4)根据化合物F的结构特征,分析预测其可能的化学性质,完成下表。
(5)参照上述合成路线和信息,以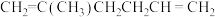 和甲醇为原料(其他试剂任选),分三步可合成化合物(
和甲醇为原料(其他试剂任选),分三步可合成化合物(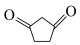 ),由此回答下列问题。
),由此回答下列问题。
①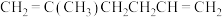 的化学名称为
的化学名称为___________ 。
②第二步反应生成的有机产物的结构简式为___________ 。
③第三步反应的化学方程式为___________ 。

已知:①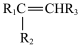
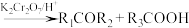 ;
;
②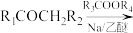
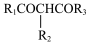 。
。
(1)A的结构简式为
(2)Q是E的同分异构体。同时满足下列条件的Q的结构有
i.含有2个酚羟基。
ii.核磁共振氢谱中有5组吸收峰。
(3)由G生成M的化学方程式为
(4)根据化合物F的结构特征,分析预测其可能的化学性质,完成下表。
| 序号 | 反应试剂、条件 | 有机产物的结构简式 | 反应类型 |
| a | 足量浓氢溴酸,加热 | ||
| b | 足量乙酸、浓硫酸,加热 |
(5)参照上述合成路线和信息,以
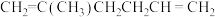 和甲醇为原料(其他试剂任选),分三步可合成化合物(
和甲醇为原料(其他试剂任选),分三步可合成化合物( ),由此回答下列问题。
),由此回答下列问题。①
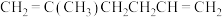 的化学名称为
的化学名称为②第二步反应生成的有机产物的结构简式为
③第三步反应的化学方程式为
您最近一年使用:0次
名校
9 .  是一种重要的工业化学品。某研究小组利用如图所示装置制备
是一种重要的工业化学品。某研究小组利用如图所示装置制备 ,并进行相关探究。
,并进行相关探究。
(1)装置A中发生反应的化学方程式为___________ 。
(2)装置B的作用为___________ ;干燥管中的试剂为___________ (任写一种)。
【查阅资料】Ⅰ.常温下镁和水反应现象不明显,镁和水反应会在镁条表面形成致密的 膜,阻碍反应进一步发生;
膜,阻碍反应进一步发生;
Ⅱ.镁与饱和 溶液剧烈反应产生大量气体和白色沉淀;
溶液剧烈反应产生大量气体和白色沉淀;
Ⅲ. 质地紧密,
质地紧密, 质地疏松,该实验条件下,
质地疏松,该实验条件下, 对
对 膜没有作用。
膜没有作用。
【预测】 溶液中的某种组分破坏了
溶液中的某种组分破坏了 与
与 反应生成的
反应生成的 膜。
膜。
【实验设计】用砂纸擦去镁条表面氧化膜,取表面积和质量相同的镁条(2cm)进行实验,测量产生气泡的速率。
(3)测得实验结果 ,得出结论:
,得出结论:___________ ;请结合必要的文字和化学用语解释得出该结论的原因为___________ 。
(4)另一同学经查阅资料发现 也能破坏
也能破坏 膜,于是进行如下探究:
膜,于是进行如下探究:
测得实验结果
___________ 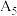 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(5)观察实验4和5发现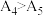 ,请解释其原因
,请解释其原因___________ 。
(6)加热 可以得到纯碱,写出纯碱在生产或生活中的一种应用:
可以得到纯碱,写出纯碱在生产或生活中的一种应用:___________ 。
 是一种重要的工业化学品。某研究小组利用如图所示装置制备
是一种重要的工业化学品。某研究小组利用如图所示装置制备 ,并进行相关探究。
,并进行相关探究。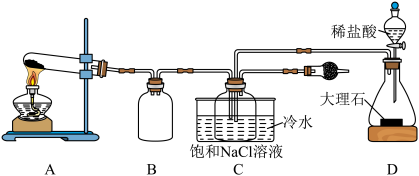
(1)装置A中发生反应的化学方程式为
(2)装置B的作用为
【查阅资料】Ⅰ.常温下镁和水反应现象不明显,镁和水反应会在镁条表面形成致密的
 膜,阻碍反应进一步发生;
膜,阻碍反应进一步发生;Ⅱ.镁与饱和
 溶液剧烈反应产生大量气体和白色沉淀;
溶液剧烈反应产生大量气体和白色沉淀;Ⅲ.
 质地紧密,
质地紧密, 质地疏松,该实验条件下,
质地疏松,该实验条件下, 对
对 膜没有作用。
膜没有作用。【预测】
 溶液中的某种组分破坏了
溶液中的某种组分破坏了 与
与 反应生成的
反应生成的 膜。
膜。【实验设计】用砂纸擦去镁条表面氧化膜,取表面积和质量相同的镁条(2cm)进行实验,测量产生气泡的速率。
| 实验序号 | 实验装置 | 添加试剂及用量 | 产生气泡速率(mL/min) |
| 1 |
| 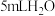 |  |
| 2 | 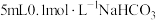 |  | |
| 3 | 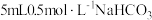 |  | |
| 4 | 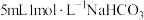 |  |
(3)测得实验结果
 ,得出结论:
,得出结论:(4)另一同学经查阅资料发现
 也能破坏
也能破坏 膜,于是进行如下探究:
膜,于是进行如下探究:| 实验序号 | 实验装置 | 添加试剂及用量 | 产生气泡速率(mL/min) |
| 5 |
| 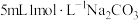 | 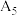 |
| 6 | 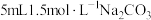 | 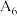 |
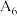
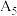 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(5)观察实验4和5发现
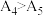 ,请解释其原因
,请解释其原因(6)加热
 可以得到纯碱,写出纯碱在生产或生活中的一种应用:
可以得到纯碱,写出纯碱在生产或生活中的一种应用:
您最近一年使用:0次
10 . 氨溴索(G)是 -内酰胺类的抗生素,可以治疗多种细菌感染。一种合成路线如下:
-内酰胺类的抗生素,可以治疗多种细菌感染。一种合成路线如下:_____ 。
(2)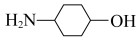 中的官能团名称是
中的官能团名称是______ 。
(3)反应③的化学方程式_________ 。
(4)反应⑤的反应类型是_______ 。
(5)B的芳香族同分异构体中,满足下列条件的有_____ 种;其中核磁共振氢谱有4组吸收峰且峰面积之比为2∶2∶2∶1的结构简式为_________ 。
①能发生银镜反应;②能水解;③1mol最多能与2molNaOH反应。
(6)写出以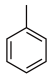 为原料制备
为原料制备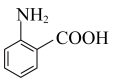 的合成路线
的合成路线_______ (无机试剂任选)。
 -内酰胺类的抗生素,可以治疗多种细菌感染。一种合成路线如下:
-内酰胺类的抗生素,可以治疗多种细菌感染。一种合成路线如下: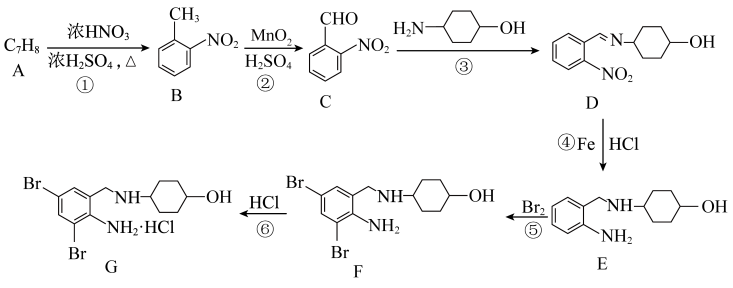
(2)
 中的官能团名称是
中的官能团名称是(3)反应③的化学方程式
(4)反应⑤的反应类型是
(5)B的芳香族同分异构体中,满足下列条件的有
①能发生银镜反应;②能水解;③1mol最多能与2molNaOH反应。
(6)写出以
 为原料制备
为原料制备 的合成路线
的合成路线
您最近一年使用:0次