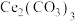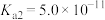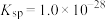名校
1 . 氯化亚铁在冶金、医药制造、媒染剂等方面有着较为广泛的用途,氯化亚铁可以对许多分子进行激活反应,成为一种新型“明星分子”。回答下列问题:
(1)由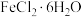 固体粗略配制
固体粗略配制 溶液,称取
溶液,称取___________ g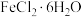 固体在
固体在___________ (填试剂)中溶解后,加水稀释为 ,最后加入少量铁粉。
,最后加入少量铁粉。
(2)“无汞定铁法”标定 溶液浓度:
溶液浓度:
①将___________ (填酸式或碱式)滴定管先水洗,再润洗,最后盛装 标准
标准 溶液,其下一步操作是
溶液,其下一步操作是___________ ,……正确安装滴定管。
②用移液管准确量取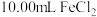 溶液注入锥形瓶中,并加入
溶液注入锥形瓶中,并加入 硫酸和几滴二苯胺磺酸钠。二苯胺磺酸钠的作用是
硫酸和几滴二苯胺磺酸钠。二苯胺磺酸钠的作用是___________ 。
③用 标准溶液滴定,当锥形瓶中溶液颜色从绿色变为紫红色即为滴定终点,平行滴定三次,平均消耗
标准溶液滴定,当锥形瓶中溶液颜色从绿色变为紫红色即为滴定终点,平行滴定三次,平均消耗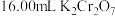 标准溶液,写出滴定反应的离子方程式
标准溶液,写出滴定反应的离子方程式___________ 。 溶液的标定浓度为
溶液的标定浓度为___________ 。
(3)取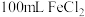 溶液加热、蒸干、灼烧至质量不变。固体质量为
溶液加热、蒸干、灼烧至质量不变。固体质量为___________ 。
(4)已知:亚硫酰氯( )沸点为
)沸点为 ,遇水极易水解。实验室利用
,遇水极易水解。实验室利用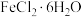 固体和亚硫酰氯(
固体和亚硫酰氯( )制备新型“明星分子”
)制备新型“明星分子” 固体的装置如下图所示:
固体的装置如下图所示: 后,先加热装置
后,先加热装置___________ (填“a”或“b”)。
②装置c、d连接在一起共同起到的作用___________ 。
③硬质玻璃试管b中发生反应的化学方程式___________ 。
④装置e中试剂为 的酸性
的酸性 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为___________ 。
(1)由
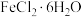 固体粗略配制
固体粗略配制 溶液,称取
溶液,称取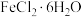 固体在
固体在 ,最后加入少量铁粉。
,最后加入少量铁粉。(2)“无汞定铁法”标定
 溶液浓度:
溶液浓度:①将
 标准
标准 溶液,其下一步操作是
溶液,其下一步操作是②用移液管准确量取
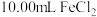 溶液注入锥形瓶中,并加入
溶液注入锥形瓶中,并加入 硫酸和几滴二苯胺磺酸钠。二苯胺磺酸钠的作用是
硫酸和几滴二苯胺磺酸钠。二苯胺磺酸钠的作用是③用
 标准溶液滴定,当锥形瓶中溶液颜色从绿色变为紫红色即为滴定终点,平行滴定三次,平均消耗
标准溶液滴定,当锥形瓶中溶液颜色从绿色变为紫红色即为滴定终点,平行滴定三次,平均消耗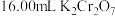 标准溶液,写出滴定反应的离子方程式
标准溶液,写出滴定反应的离子方程式 溶液的标定浓度为
溶液的标定浓度为(3)取
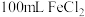 溶液加热、蒸干、灼烧至质量不变。固体质量为
溶液加热、蒸干、灼烧至质量不变。固体质量为(4)已知:亚硫酰氯(
 )沸点为
)沸点为 ,遇水极易水解。实验室利用
,遇水极易水解。实验室利用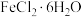 固体和亚硫酰氯(
固体和亚硫酰氯( )制备新型“明星分子”
)制备新型“明星分子” 固体的装置如下图所示:
固体的装置如下图所示: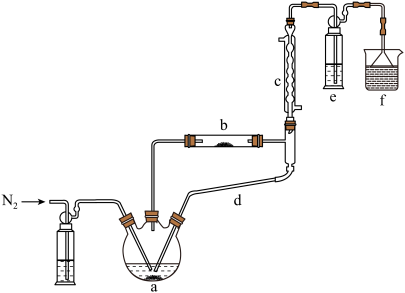
 后,先加热装置
后,先加热装置②装置c、d连接在一起共同起到的作用
③硬质玻璃试管b中发生反应的化学方程式
④装置e中试剂为
 的酸性
的酸性 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为
您最近一年使用:0次
2024-05-18更新
|
220次组卷
|
2卷引用:河南省焦作市博爱县第一中学2023-2024学年高三下学期5月月考化学试题
名校
解题方法
2 . 某处工厂排出的烟道气中含氮氧化物(主要为NO、 )、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图:
)、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图: 混合气体按一定比例被
混合气体按一定比例被 溶液完全吸收生成
溶液完全吸收生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式______________ ;若反应后尾气无残留,则参加反应的 、NO物质的量比值为
、NO物质的量比值为_____ (填字母)。
a.≥1 b.≤1 c.任意值
(2)可使用适量酸性 溶液,将溶液中的
溶液,将溶液中的 全部氧化为
全部氧化为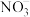 ,发生反应的离子方程式是
,发生反应的离子方程式是_______________ 。
(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性 溶液来处理。
溶液来处理。 氧化NO生成
氧化NO生成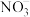 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是_______________ 。
(4)有氧条件下,NO在催化剂作用下可被 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示:
作用下的脱硝反应机理如图所示: 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是___________ 。
(5)羟基自由基( )也可以用于脱硫脱硝。如图表示光催化氧化技术可生成
)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成 ﹔光照时,价带失去电子产生有强氧化性的空穴,价带上
﹔光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为
直接转化为 ;描述产生
;描述产生 的另一种过程:
的另一种过程:______________ 。 等杂质,可以采用
等杂质,可以采用 测定含量。称取
测定含量。称取 该亚硝酸钠产品溶于水配制成
该亚硝酸钠产品溶于水配制成 的样品溶液。取
的样品溶液。取 该样品溶液于锥形瓶中,用稀
该样品溶液于锥形瓶中,用稀 酸化后,再向锥形瓶中滴加
酸化后,再向锥形瓶中滴加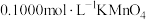 溶液,至恰好完全反应时,消耗
溶液,至恰好完全反应时,消耗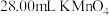 溶液。计算该产品中
溶液。计算该产品中 的质量分数
的质量分数__________ 。(写出计算过程)
 )、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图:
)、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图: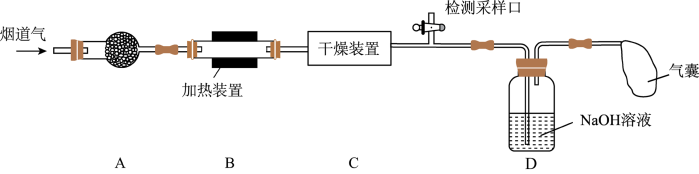
 混合气体按一定比例被
混合气体按一定比例被 溶液完全吸收生成
溶液完全吸收生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式 、NO物质的量比值为
、NO物质的量比值为a.≥1 b.≤1 c.任意值
(2)可使用适量酸性
 溶液,将溶液中的
溶液,将溶液中的 全部氧化为
全部氧化为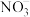 ,发生反应的离子方程式是
,发生反应的离子方程式是(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性
 溶液来处理。
溶液来处理。 氧化NO生成
氧化NO生成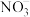 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是(4)有氧条件下,NO在催化剂作用下可被
 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示:
作用下的脱硝反应机理如图所示: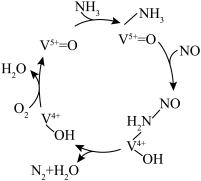
 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是(5)羟基自由基(
 )也可以用于脱硫脱硝。如图表示光催化氧化技术可生成
)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成 ﹔光照时,价带失去电子产生有强氧化性的空穴,价带上
﹔光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为
直接转化为 ;描述产生
;描述产生 的另一种过程:
的另一种过程: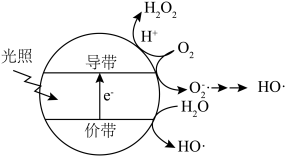
 等杂质,可以采用
等杂质,可以采用 测定含量。称取
测定含量。称取 该亚硝酸钠产品溶于水配制成
该亚硝酸钠产品溶于水配制成 的样品溶液。取
的样品溶液。取 该样品溶液于锥形瓶中,用稀
该样品溶液于锥形瓶中,用稀 酸化后,再向锥形瓶中滴加
酸化后,再向锥形瓶中滴加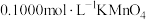 溶液,至恰好完全反应时,消耗
溶液,至恰好完全反应时,消耗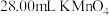 溶液。计算该产品中
溶液。计算该产品中 的质量分数
的质量分数
您最近一年使用:0次
2024-05-03更新
|
259次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高一下学期4月期中考试化学试题
解题方法
3 . 三草酸合铁酸钾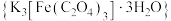 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解: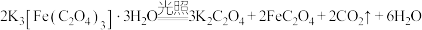 。回答下列问题:
。回答下列问题:
(1)基态 原子的电子排布式为
原子的电子排布式为___________ ,基态 与
与 中未成对电子的数目之比为
中未成对电子的数目之比为___________ 。
(2)三草酸合铁酸钾所含元素中,第一电离能最大的是___________ (填元素符号,下同),电负性最大的是___________ 。
(3)1个 与1个
与1个 分子中
分子中 键数目之比为
键数目之比为___________ , 分子的立体构型为
分子的立体构型为___________ 。
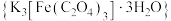 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解: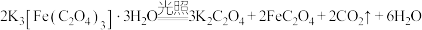 。回答下列问题:
。回答下列问题:(1)基态
 原子的电子排布式为
原子的电子排布式为 与
与 中未成对电子的数目之比为
中未成对电子的数目之比为(2)三草酸合铁酸钾所含元素中,第一电离能最大的是
(3)1个
 与1个
与1个 分子中
分子中 键数目之比为
键数目之比为 分子的立体构型为
分子的立体构型为
您最近一年使用:0次
解题方法
4 . 含硼物质在生产生活中有着广泛应用。回答下列问题:
(1)一种BN晶体硬度仅次于金刚石,是一种超硬材料,常用作刀具材料和磨料。该BN晶体属于_______ 晶体,熔点比晶体硼_______ (填“高”或“低”)。
(2)N-甲基咪唑的结构为 ,它的某种衍生物与
,它的某种衍生物与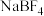 形成的离子化合物
形成的离子化合物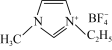 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
(1)一种BN晶体硬度仅次于金刚石,是一种超硬材料,常用作刀具材料和磨料。该BN晶体属于
(2)N-甲基咪唑的结构为
 ,它的某种衍生物与
,它的某种衍生物与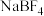 形成的离子化合物
形成的离子化合物 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。①离子化合物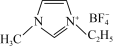 熔点低的原因是
熔点低的原因是
②分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。
)。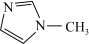 中存在大π键,其分子中的大π键可表示为
中存在大π键,其分子中的大π键可表示为
③1mol离子化合物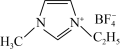 中,阿伏加德罗常数的值为
中,阿伏加德罗常数的值为 ,则根据价电子对互斥(
,则根据价电子对互斥( )理论,空间结构为四面体的原子共有
)理论,空间结构为四面体的原子共有
您最近一年使用:0次
5 . 目前,全世界镍(Ni)的消费量仅次于铜、铝、铅、锌,居有色金属第五位,镍行业发展蕴藏着巨大的潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于___________ 晶体;基态Ni原子的电子排布式为___________ 。
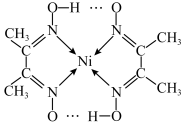
(2)某配合物结构如图所示,分子内含有的作用力有___________ (填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键___________ 。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于
(2)某配合物结构如图所示,分子内含有的作用力有
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
您最近一年使用:0次
解题方法
6 . 镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有___________ 。
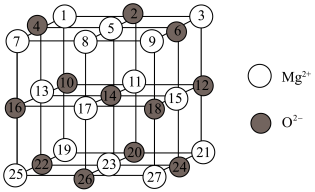
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误:___________ 。___________ 。
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
解释表中氟化物熔点差异的原因:___________ 。
(5)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:___________ 键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异___________ 。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误:
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:

| 氧化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
(5)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合
 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b: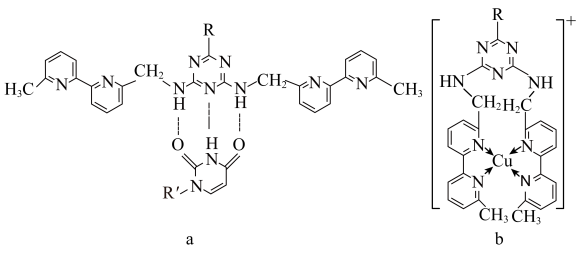
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异
您最近一年使用:0次
7 . 现有部分前四周期元素的性质或原子结构如下表:
(1)B单质分子中,含有___________ 个 键和
键和___________ 个 键,元素B的气态氢化物的空间型为
键,元素B的气态氢化物的空间型为___________ 。
(2)C单质的熔点___________ A单质的熔点(填“高于”或“低于”),其原因是:___________
(3)写出元素D基态原子的电子排布式:___________ 。
| 元素编号 | 元素性质或原子结构 |
| A | 第三周期中的半导体材料 |
| B | L层s电子数比p电子数少1 |
| C | 第三周期主族元素中其第一电离能最大 |
| D | 前四周期呀中其未成对电子数最多 |
 键和
键和 键,元素B的气态氢化物的空间型为
键,元素B的气态氢化物的空间型为(2)C单质的熔点
(3)写出元素D基态原子的电子排布式:
您最近一年使用:0次
名校
解题方法
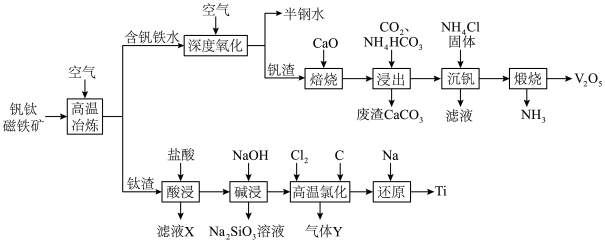
8 . 稀有金属钒和钛在钢铁、化工、航空航天等领域应用广泛。从钒钛磁铁矿中提取钒、钛的工艺流程图如下: 、
、 、
、 和
和 等。
等。
②“高温氯化”后的产物中含少量的 、
、 、
、 、
、 杂质,相关物质的沸点如下表:
杂质,相关物质的沸点如下表:
回答下列问题:
(1)钛在周期表中的位置为___________ ,上述获得钛单质的“还原”工序中需要通入氩气的目的是___________ 。
(2)滤液X中含有的主要金属离子有___________ 。
(3)“高温氯化”工序生成 和一种可燃性气体Y,该反应的化学方程式为
和一种可燃性气体Y,该反应的化学方程式为___________ ; 的粗产品可以通过分馏提纯,但收集的
的粗产品可以通过分馏提纯,但收集的 中总是混有
中总是混有 的原因是
的原因是___________ 。
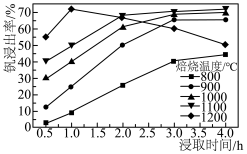
(4)钒的浸出率随焙烧温度和浸取时间的变化如图所示,则“焙烧”时最适合的反应条件为___________ 。 转化成
转化成 进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为
进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为___________ 。
(6)采用USTB工艺电解制备高纯钛,过程以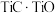 固体为阳极、碳棒为阴极,
固体为阳极、碳棒为阴极, 熔融盐为电解质。阳极产生
熔融盐为电解质。阳极产生 与
与 ,阴极只发生
,阴极只发生 的还原反应。请写出电池阳极反应的电极反应式:
的还原反应。请写出电池阳极反应的电极反应式:___________ 。
 、
、 、
、 和
和 等。
等。②“高温氯化”后的产物中含少量的
 、
、 、
、 、
、 杂质,相关物质的沸点如下表:
杂质,相关物质的沸点如下表:| 化合物 |  |  |  |  |  |
| 沸点/℃ | 136 | 310 | 56.5 | 180 | 127 |
(1)钛在周期表中的位置为
(2)滤液X中含有的主要金属离子有
(3)“高温氯化”工序生成
 和一种可燃性气体Y,该反应的化学方程式为
和一种可燃性气体Y,该反应的化学方程式为 的粗产品可以通过分馏提纯,但收集的
的粗产品可以通过分馏提纯,但收集的 中总是混有
中总是混有 的原因是
的原因是(4)钒的浸出率随焙烧温度和浸取时间的变化如图所示,则“焙烧”时最适合的反应条件为
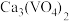 转化成
转化成 进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为
进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为(6)采用USTB工艺电解制备高纯钛,过程以
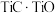 固体为阳极、碳棒为阴极,
固体为阳极、碳棒为阴极, 熔融盐为电解质。阳极产生
熔融盐为电解质。阳极产生 与
与 ,阴极只发生
,阴极只发生 的还原反应。请写出电池阳极反应的电极反应式:
的还原反应。请写出电池阳极反应的电极反应式:
您最近一年使用:0次
2024-04-22更新
|
469次组卷
|
4卷引用:河南省焦作市博爱县第一中学2023-2024学年高三下学期5月月考化学试题
名校
解题方法
9 . 硒 是人体必需微量元素之一,含硒化合物在药物和材料等领域具有广泛的应用。乙烷硒啉是一种抗癌新药,其结构式如下图所示:
是人体必需微量元素之一,含硒化合物在药物和材料等领域具有广泛的应用。乙烷硒啉是一种抗癌新药,其结构式如下图所示:_______ 区。
(2) 与S同主族,则基态硒原子的核外电子排布式为
与S同主族,则基态硒原子的核外电子排布式为_______ 。
(3) 、O、N的第一电离能由大到小的顺序为
、O、N的第一电离能由大到小的顺序为_______ 。
(4)比较键角大小:气态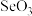 分子
分子_______ 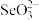 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是_______ 。
(5)根据价层电子对互斥理论,可以推知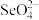 的空间构型为
的空间构型为_______ (用文字描述),其中 原子采用的轨道杂化方式为
原子采用的轨道杂化方式为_______ 。
(6)甲硒醇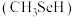 可增加抗癌效力,下表中有机物沸点不同的原因是
可增加抗癌效力,下表中有机物沸点不同的原因是_______ 。
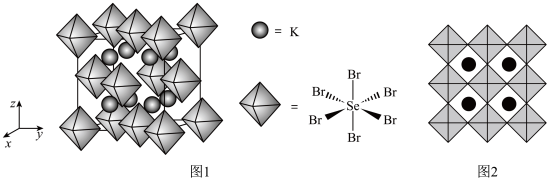
(7)化合物X是通过理论计算的方法筛选出的潜在热电材料之一,其晶胞结构如题图1,沿x、y、z轴方向的投影均为题图2。则X的化学式为_______ 。
 是人体必需微量元素之一,含硒化合物在药物和材料等领域具有广泛的应用。乙烷硒啉是一种抗癌新药,其结构式如下图所示:
是人体必需微量元素之一,含硒化合物在药物和材料等领域具有广泛的应用。乙烷硒啉是一种抗癌新药,其结构式如下图所示: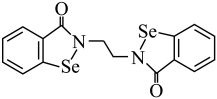
(2)
 与S同主族,则基态硒原子的核外电子排布式为
与S同主族,则基态硒原子的核外电子排布式为(3)
 、O、N的第一电离能由大到小的顺序为
、O、N的第一电离能由大到小的顺序为(4)比较键角大小:气态
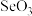 分子
分子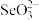 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是(5)根据价层电子对互斥理论,可以推知
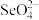 的空间构型为
的空间构型为 原子采用的轨道杂化方式为
原子采用的轨道杂化方式为(6)甲硒醇
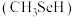 可增加抗癌效力,下表中有机物沸点不同的原因是
可增加抗癌效力,下表中有机物沸点不同的原因是| 有机物 | 甲醇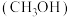 | 甲硫醇 | 甲硒醇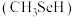 |
| 沸点/℃ | 64.7 | 5.95 | 25.05 |
(7)化合物X是通过理论计算的方法筛选出的潜在热电材料之一,其晶胞结构如题图1,沿x、y、z轴方向的投影均为题图2。则X的化学式为
您最近一年使用:0次
2024-04-19更新
|
298次组卷
|
3卷引用:河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
10 . 碳酸铈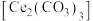 ]是一种稀土材料,工业上常以氟碳铈矿(主要成分为
]是一种稀土材料,工业上常以氟碳铈矿(主要成分为 、
、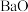 、
、 )为原料制备碳酸铈,其工艺流程如图所示:
)为原料制备碳酸铈,其工艺流程如图所示:
①“酸浸”后铈元素主要以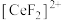 的形式存在;
的形式存在;
② 在空气中易被氧化为
在空气中易被氧化为 ,两者均能形成氢氧化物沉淀。
,两者均能形成氢氧化物沉淀。
(1)“焙烧”时,从焙烧室的底部通入空气的目的是____________________ 。
(2)“滤渣1”的主要成分为__________ 。
(3)“还原”时,加入硫脲( )的目的是将
)的目的是将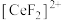 还原为
还原为 ,硫脲被氧化为
,硫脲被氧化为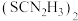 。
。
①该反应的离子方程式为____________________ 。
②硫脲属于__________ (填“极性”或“非极性”)分子,该分子中键角
__________ 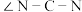 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(4)“碱转酸浸”在加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为______________________________________________________________________ 。
(5)若“沉淀”后,溶液的pH为6,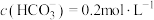 ,此时
,此时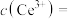
__________ 。已知常温下:
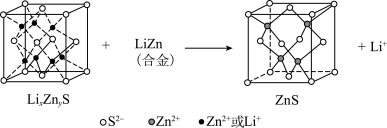
(6)某研究小组利用硫化锌锂电池电解含Ce(Ⅱ)的溶液,可将Ce(Ⅱ)转化为Ce(Ⅳ)。该硫化锌锂电池放电时,负极材料晶胞组成变化如图所示: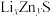 中,
中,
__________ 。
②ZnS晶胞中, 填充在
填充在 构成的部分正四面体空隙中,
构成的部分正四面体空隙中, 和
和 之间的核间距为apm,设
之间的核间距为apm,设 为阿伏加德罗常数的值,则晶体密度为
为阿伏加德罗常数的值,则晶体密度为__________  (列出计算式,ZnS的摩尔质量为
(列出计算式,ZnS的摩尔质量为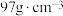 )。
)。
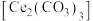 ]是一种稀土材料,工业上常以氟碳铈矿(主要成分为
]是一种稀土材料,工业上常以氟碳铈矿(主要成分为 、
、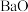 、
、 )为原料制备碳酸铈,其工艺流程如图所示:
)为原料制备碳酸铈,其工艺流程如图所示: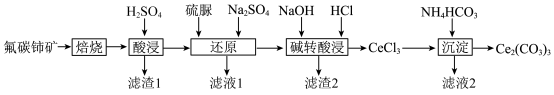
①“酸浸”后铈元素主要以
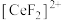 的形式存在;
的形式存在;②
 在空气中易被氧化为
在空气中易被氧化为 ,两者均能形成氢氧化物沉淀。
,两者均能形成氢氧化物沉淀。(1)“焙烧”时,从焙烧室的底部通入空气的目的是
(2)“滤渣1”的主要成分为
(3)“还原”时,加入硫脲(
 )的目的是将
)的目的是将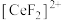 还原为
还原为 ,硫脲被氧化为
,硫脲被氧化为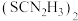 。
。①该反应的离子方程式为
②硫脲属于

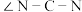 (填“>”“<”或“=”)
(填“>”“<”或“=”)(4)“碱转酸浸”在加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为
(5)若“沉淀”后,溶液的pH为6,
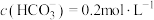 ,此时
,此时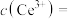
|
| |
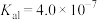 |
|
|
(6)某研究小组利用硫化锌锂电池电解含Ce(Ⅱ)的溶液,可将Ce(Ⅱ)转化为Ce(Ⅳ)。该硫化锌锂电池放电时,负极材料晶胞组成变化如图所示:
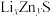 中,
中,
②ZnS晶胞中,
 填充在
填充在 构成的部分正四面体空隙中,
构成的部分正四面体空隙中, 和
和 之间的核间距为apm,设
之间的核间距为apm,设 为阿伏加德罗常数的值,则晶体密度为
为阿伏加德罗常数的值,则晶体密度为 (列出计算式,ZnS的摩尔质量为
(列出计算式,ZnS的摩尔质量为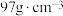 )。
)。
您最近一年使用:0次
2024-04-15更新
|
322次组卷
|
3卷引用:河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题