20-21高一上·全国·期末
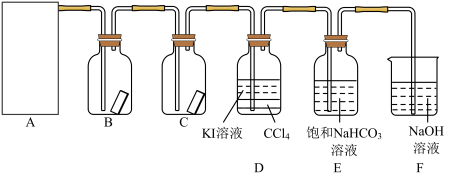
1 . 已知反应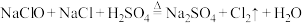 ,为探究氯气的性质,某同学设计了如图所示的实验装置。
,为探究氯气的性质,某同学设计了如图所示的实验装置。
试回答下列问题:
(1)在该实验中,以下可用于制取氯气的装置是_______ (填字母)。
(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是_______ ,请提出合理的改进方法:_______ 。
(3)写出氯气与 溶液反应的离子方程式:
溶液反应的离子方程式:_______ ,该反应中氧化剂与还原剂的物质的量之比为_______ 。为验证尾气吸收后的溶液中存在 ,正确的操作是
,正确的操作是_______ 。
(4)氯气通入饱和 溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明
溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明 与
与 反应的产物中含有
反应的产物中含有_______ (填化学式)。
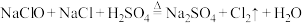 ,为探究氯气的性质,某同学设计了如图所示的实验装置。
,为探究氯气的性质,某同学设计了如图所示的实验装置。
试回答下列问题:
(1)在该实验中,以下可用于制取氯气的装置是

(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是
(3)写出氯气与
 溶液反应的离子方程式:
溶液反应的离子方程式: ,正确的操作是
,正确的操作是(4)氯气通入饱和
 溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明
溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明 与
与 反应的产物中含有
反应的产物中含有
您最近一年使用:0次
2024-03-04更新
|
52次组卷
|
7卷引用:期末模拟卷(一)-2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)
(已下线)期末模拟卷(一)-2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)(已下线)第二章单元检测 (测)--2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)内蒙古自治区通辽市科尔沁左翼中旗实验高级中学2023-2024学年高一上学期1月期末化学试题重庆市巫山县官渡中学2020-2021学年高一下学期第一次月考化学试题四川省天府新区太平中学2022-2023学年高一上学期期末考试化学试题四川省宜宾市叙州区第二中学校2022-2023学年高一下学期开学考试化学试题安徽省宿州市泗县第一中学2023-2024学年高一下学期开学考试化学试题
2 . 二氧化氯( )是国际公认的新一代高效、广谱、安全杀菌保鲜剂。
)是国际公认的新一代高效、广谱、安全杀菌保鲜剂。 沸点为11℃,性质不稳定,温度较高或浓度较大时易爆炸,通常用化学方法将其稳定在水溶液中,使用时再释放出来。实验室制备
沸点为11℃,性质不稳定,温度较高或浓度较大时易爆炸,通常用化学方法将其稳定在水溶液中,使用时再释放出来。实验室制备 并转化为“稳定态二氧化氯(
并转化为“稳定态二氧化氯( )”的装置如下(夹持装置省略):
)”的装置如下(夹持装置省略):
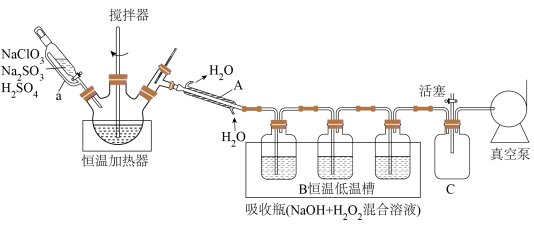
回答下列问题:
(1)仪器A的名称为___________ ,恒压分液漏斗导管a的作用是___________ ;恒温加热器内三颈瓶中发生反应生成 的化学方程式为
的化学方程式为___________ 。
(2)三个吸收瓶( 混合溶液)中发生反应的离子方程式为
混合溶液)中发生反应的离子方程式为___________ ,装置B“恒温低温槽”选择低温的原因是___________ 。
(3)装置C的作用是___________ 。
(4) 溶液中存在
溶液中存在 、
、 、
、 、
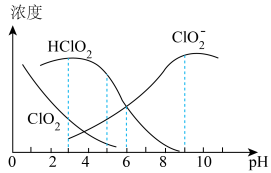
、 等四种含氧元素的微粒。经测定,25℃时
等四种含氧元素的微粒。经测定,25℃时 溶液中部分含氯元素微粒的浓度随pH变化情况如图所示(
溶液中部分含氯元素微粒的浓度随pH变化情况如图所示( 没有标出),则25℃时
没有标出),则25℃时 的电离平衡常数为
的电离平衡常数为
___________ ;pH=5时含氯元素的微粒浓度由大到小的关系为___________ 。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力。
的氧化能力。 的有效氯含量为
的有效氯含量为___________ g。(计算结果保留两位小数)
 )是国际公认的新一代高效、广谱、安全杀菌保鲜剂。
)是国际公认的新一代高效、广谱、安全杀菌保鲜剂。 沸点为11℃,性质不稳定,温度较高或浓度较大时易爆炸,通常用化学方法将其稳定在水溶液中,使用时再释放出来。实验室制备
沸点为11℃,性质不稳定,温度较高或浓度较大时易爆炸,通常用化学方法将其稳定在水溶液中,使用时再释放出来。实验室制备 并转化为“稳定态二氧化氯(
并转化为“稳定态二氧化氯( )”的装置如下(夹持装置省略):
)”的装置如下(夹持装置省略):
回答下列问题:
(1)仪器A的名称为
 的化学方程式为
的化学方程式为(2)三个吸收瓶(
 混合溶液)中发生反应的离子方程式为
混合溶液)中发生反应的离子方程式为(3)装置C的作用是
(4)
 溶液中存在
溶液中存在 、
、 、
、 、
、 等四种含氧元素的微粒。经测定,25℃时
等四种含氧元素的微粒。经测定,25℃时 溶液中部分含氯元素微粒的浓度随pH变化情况如图所示(
溶液中部分含氯元素微粒的浓度随pH变化情况如图所示( 没有标出),则25℃时
没有标出),则25℃时 的电离平衡常数为
的电离平衡常数为

(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力。
的氧化能力。 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
解题方法
3 . 铜、锌原子结构的特殊性,决定了它们的单质及其化合物在化工生产中发挥着重要的作用,回答下列问题。
(1)基态锌原子的价电子排布式为___________ ,基态 的核外电子存在
的核外电子存在___________ 种不同的空间运动状态。
(2)当黄铜受到氨腐蚀时,会出现“龟裂”现象,生成四氨合铜配合物。
① 中各非金属元素电负性由大到小的顺序为
中各非金属元素电负性由大到小的顺序为___________ ;阴离子中心原子的杂化轨道类型是___________ ,空间构型为___________ 。
② 中
中 的键角比独立
的键角比独立 的键角
的键角___________ (填“大”“小”或“相等”),原因是___________ 。
(3) 的熔点为872℃,
的熔点为872℃, 的熔点为275℃,
的熔点为275℃, 和
和 熔点差异大的原因为
熔点差异大的原因为___________ 。
(4)立方ZnS晶体常用作半导体材料,其晶胞结构如图甲所示,密度为 。
。
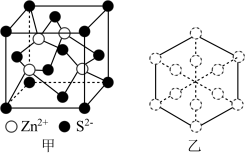
①两个S原子之间的最短距离为___________ nm(已知 为阿伏加德罗常数的值,用含
为阿伏加德罗常数的值,用含 、d的代数式表示)。
、d的代数式表示)。
②若ZnS晶胞沿体对角线方向投影,所得的Zn原子投影外围图形为正六边形,如图乙所示,则S原子的投影外围图形为___________ 。
(1)基态锌原子的价电子排布式为
 的核外电子存在
的核外电子存在(2)当黄铜受到氨腐蚀时,会出现“龟裂”现象,生成四氨合铜配合物。
①
 中各非金属元素电负性由大到小的顺序为
中各非金属元素电负性由大到小的顺序为②
 中
中 的键角比独立
的键角比独立 的键角
的键角(3)
 的熔点为872℃,
的熔点为872℃, 的熔点为275℃,
的熔点为275℃, 和
和 熔点差异大的原因为
熔点差异大的原因为(4)立方ZnS晶体常用作半导体材料,其晶胞结构如图甲所示,密度为
 。
。
①两个S原子之间的最短距离为
 为阿伏加德罗常数的值,用含
为阿伏加德罗常数的值,用含 、d的代数式表示)。
、d的代数式表示)。②若ZnS晶胞沿体对角线方向投影,所得的Zn原子投影外围图形为正六边形,如图乙所示,则S原子的投影外围图形为
您最近一年使用:0次
4 . 利用太阳能等可再生能源,通过光催化、光电催化或电解水制氢来进行二氧化碳加氢制甲醇,发生的主要反应是 ,请回答下列有关问题。
,请回答下列有关问题。
(1)常压下,二氧化碳加氢制甲醇反应时的能量变化如图1所示,则该反应的反应热
___________ 。

(2)若二氧化碳加氢制甲醇反应在恒温恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到 时刻达到平衡状态的是___________(填字母序号)。
时刻达到平衡状态的是___________(填字母序号)。
(3) ℃,在容积(均为2L)相同的a,b两个密闭容器中分别均投入
℃,在容积(均为2L)相同的a,b两个密闭容器中分别均投入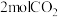 和
和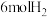 ,进行二氧化碳加氢制甲醇的反应。容器a中保持压强不变,容器b保持容积不变,容器b中甲醇的体积分数与时间关系如图2所示。
,进行二氧化碳加氢制甲醇的反应。容器a中保持压强不变,容器b保持容积不变,容器b中甲醇的体积分数与时间关系如图2所示。
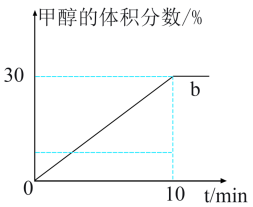
①容器b中0~10min氢气的平均反应速率
___________  ;
; ℃,反应的平衡常数为
℃,反应的平衡常数为___________ 。
②达到平衡后容器a中 的平衡转化率
的平衡转化率___________ 75%(填“>”“<”或“=”)。
③若起始时,容器b中其他条件不变,加入催化剂,则反应情况会由曲线b变为曲线c,则请在图2中画出曲线c的趋势___________ 。
(4)二氧化碳加氢制甲醇的反应历程如图3所示,方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:eV);其中,TS表示过渡态、*表示吸附在催化剂上的微粒。
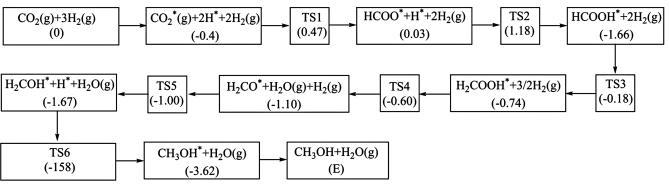
则生成甲醇的决速步骤的反应方程式为___________ 。
 ,请回答下列有关问题。
,请回答下列有关问题。(1)常压下,二氧化碳加氢制甲醇反应时的能量变化如图1所示,则该反应的反应热


(2)若二氧化碳加氢制甲醇反应在恒温恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到
 时刻达到平衡状态的是___________(填字母序号)。
时刻达到平衡状态的是___________(填字母序号)。A.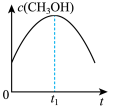 | B. | C.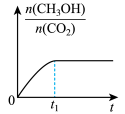 | D.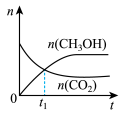 |
(3)
 ℃,在容积(均为2L)相同的a,b两个密闭容器中分别均投入
℃,在容积(均为2L)相同的a,b两个密闭容器中分别均投入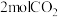 和
和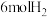 ,进行二氧化碳加氢制甲醇的反应。容器a中保持压强不变,容器b保持容积不变,容器b中甲醇的体积分数与时间关系如图2所示。
,进行二氧化碳加氢制甲醇的反应。容器a中保持压强不变,容器b保持容积不变,容器b中甲醇的体积分数与时间关系如图2所示。
①容器b中0~10min氢气的平均反应速率

 ;
; ℃,反应的平衡常数为
℃,反应的平衡常数为②达到平衡后容器a中
 的平衡转化率
的平衡转化率③若起始时,容器b中其他条件不变,加入催化剂,则反应情况会由曲线b变为曲线c,则请在图2中画出曲线c的趋势
(4)二氧化碳加氢制甲醇的反应历程如图3所示,方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:eV);其中,TS表示过渡态、*表示吸附在催化剂上的微粒。

则生成甲醇的决速步骤的反应方程式为
您最近一年使用:0次
解题方法
5 . 中国载人潜水器“奋斗者”号,在西太平洋马里亚纳海沟成功下潜突破10000米,达到10909米,创造了中国载人深潜的新纪录。“奋斗者”号抗压关键——坚固、宽大的球形载人仓是由钛合金制成的。以钛铁矿[主要成分钛酸亚铁( )]为主要原料冶炼金属钛,同时还可得到副产物绿矾,其生产的工艺流程如图所示:
)]为主要原料冶炼金属钛,同时还可得到副产物绿矾,其生产的工艺流程如图所示:
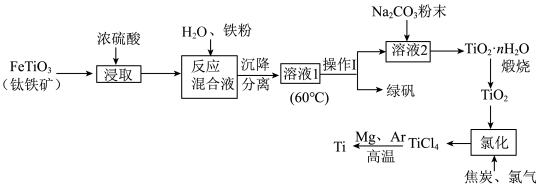
已知:钛铁矿与浓硫酸发生反应的化学方程式为 ;
; 易水解,只能存于强酸性溶液中。
易水解,只能存于强酸性溶液中。
回答下列问题:
(1) 中Ti的化合价为
中Ti的化合价为___________ ;反应混合液中加入铁粉的目的是___________ 。
(2)溶液1经“操作I”可得副产品绿矾,则操作I的名称为___________ ;在此操作过程中,需控制溶液的温度,若溶液1的温度过高,会使最终钛的产率___________ (填“升高”或“降低”),理由是___________ 。
(3)溶液2中含有的主要离子是 ,加入
,加入 粉末可得到固体
粉末可得到固体 ,请结合原理和化学用语解释其原因:
,请结合原理和化学用语解释其原因:___________ 。
(4)“氯化”是焦炭、氯气在高温下发生反应制取 ,并得到一种可燃性气体,其化学方程式为
,并得到一种可燃性气体,其化学方程式为___________ 。
(5)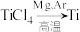 反应后得到Mg、
反应后得到Mg、 、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,蒸馏时需加热的温度应略高于
、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,蒸馏时需加热的温度应略高于___________ ℃即可。
(6)钛酸锂( )是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池的总反应为
)是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池的总反应为 ,则放电时其负极反应式为
,则放电时其负极反应式为___________ 。
 )]为主要原料冶炼金属钛,同时还可得到副产物绿矾,其生产的工艺流程如图所示:
)]为主要原料冶炼金属钛,同时还可得到副产物绿矾,其生产的工艺流程如图所示:
已知:钛铁矿与浓硫酸发生反应的化学方程式为
 ;
; 易水解,只能存于强酸性溶液中。
易水解,只能存于强酸性溶液中。回答下列问题:
(1)
 中Ti的化合价为
中Ti的化合价为(2)溶液1经“操作I”可得副产品绿矾,则操作I的名称为
(3)溶液2中含有的主要离子是
 ,加入
,加入 粉末可得到固体
粉末可得到固体 ,请结合原理和化学用语解释其原因:
,请结合原理和化学用语解释其原因:(4)“氯化”是焦炭、氯气在高温下发生反应制取
 ,并得到一种可燃性气体,其化学方程式为
,并得到一种可燃性气体,其化学方程式为(5)
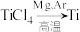 反应后得到Mg、
反应后得到Mg、 、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,蒸馏时需加热的温度应略高于
、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,蒸馏时需加热的温度应略高于| 物质 |  | Mg |  | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(6)钛酸锂(
 )是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池的总反应为
)是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池的总反应为 ,则放电时其负极反应式为
,则放电时其负极反应式为
您最近一年使用:0次
6 . 北京时间10月7日,2020年诺贝尔化学奖揭晓。法国科学家Emmanuelle Charpentier和美国科学家JenniferA.Doudna获奖,以表彰她们“开发出一种基因组编辑方法”。利用CRISPR/Cas9“基因剪刀”,现在可以在几周的时间内改变生命密码。研究表明,该“基因剪刀”中的Cas9蛋白质可以水解产生20种氨基酸,其中含量最多的一种氨基酸是赖氨酸(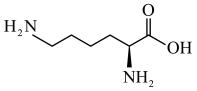 )。工业上制备赖氨酸有很多方法:
)。工业上制备赖氨酸有很多方法:
(1)由葡萄糖在一定的条件下进行耗氧发酵,生成赖氨酸的化学方程式为 。该反应的理论产率是
。该反应的理论产率是___________ (精确到0.1%,已知理论产率=目标产物的质量/反应物的质量,产物和反应物均只指有机物)。
(2)由尼龙-6生产过程中的废料(A)经过下列途径也可制备赖氨酸(E)。
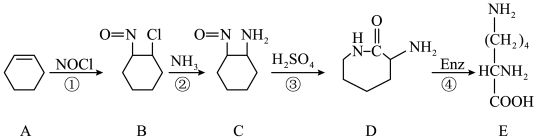
①物质A的名称是___________ ,赖氨酸中官能团的名称是___________ 。
②反应①的类型是___________ 。
③反应②的化学方程式为___________ 。
④C、D两种物质的关系是___________ 。
⑤E的同分异构体很多,同时满足下列条件的E的同分异构体有___________ 种(不含立体异构)。
A.能发生银镜反应和水解反应 B.分子中含两个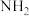 但不含
但不含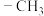
其中一氯取代物有三种的结构简式是___________ 。
(3)工业上也可用己内酰胺为原料,通过下述途径生产赖氨酸。

请补充完整该合成路线___________ 。
 )。工业上制备赖氨酸有很多方法:
)。工业上制备赖氨酸有很多方法:(1)由葡萄糖在一定的条件下进行耗氧发酵,生成赖氨酸的化学方程式为
 。该反应的理论产率是
。该反应的理论产率是(2)由尼龙-6生产过程中的废料(A)经过下列途径也可制备赖氨酸(E)。

①物质A的名称是
②反应①的类型是
③反应②的化学方程式为
④C、D两种物质的关系是
⑤E的同分异构体很多,同时满足下列条件的E的同分异构体有
A.能发生银镜反应和水解反应 B.分子中含两个
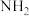 但不含
但不含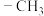
其中一氯取代物有三种的结构简式是
(3)工业上也可用己内酰胺为原料,通过下述途径生产赖氨酸。

请补充完整该合成路线
您最近一年使用:0次
7 . 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为________________ mol.L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_______________(填字母)。
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol.L-1的稀盐酸。
①该学生需要量取_______________ mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面________
b定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水________
(4)①假设该同学成功配制了0.400mol.L-1的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取_______________ mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是_______________ 。(填字母)
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19g.cm-3 HCl的质量分数:36.5% |
(1)该浓盐酸中HCl的物质的量浓度为
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_______________(填字母)。
| A.溶液中HCl的物质的量 | B.溶液的物质的量浓度 |
| C.溶液中Cl-的数目 | D.溶液的密度 |
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol.L-1的稀盐酸。
①该学生需要量取
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面
b定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
(4)①假设该同学成功配制了0.400mol.L-1的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
您最近一年使用:0次
2024-01-07更新
|
20次组卷
|
2卷引用:内蒙古自治区赤峰四中2021-2022学年高一上学期第一次月考化学试题
13-14高二·全国·单元测试
名校
解题方法
8 . 某校化学研究性学习小组欲设计实验验证Fe、Cu金属活动性的相对强弱,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
(1)方案I:有人提出将大小相等的铁片和铜片分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为_________ 。
(2)方案II:有人利用Fe、Cu作电极设计成原电池,以确定它们活动性的相对强弱。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式_________ 。
正极反应式:_________ ;负极反应式:_________ 。
(3)方案III:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性相对强弱的简单实验方案(与方案I、II不能雷同):_________ ,用离子方程式表示其反应原理:________ 。
(1)方案I:有人提出将大小相等的铁片和铜片分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为
(2)方案II:有人利用Fe、Cu作电极设计成原电池,以确定它们活动性的相对强弱。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式
(3)方案III:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性相对强弱的简单实验方案(与方案I、II不能雷同):
您最近一年使用:0次
2023-08-27更新
|
109次组卷
|
15卷引用:2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷
(已下线)2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷2015-2016学年辽宁省沈阳铁路实验中学高一下期中化学试卷2016-2017学年河南省南阳市宛东五校高二上第一次联考化学试卷【全国市级联考】河南省南阳市2017-2018学年高一下学期期末考试化学试题(已下线)2018年11月25日 《每日一题》人教选修4-每周一测(已下线)2019年11月24日《每日一题》高二化学人教版(选修4)—— 每周一测苏教版高一化学必修2专题2《化学反应与能量转化》测试卷(已下线)专题05 化学能与电能(核心精讲)-【新教材精创】2019-2020学年高一化学新教材知识讲学(必修第二册)(已下线)专题05 化学能与电能(核心素养卷)-【新教材精创】2019-2020学年高一化学新教材知识讲学(必修第二册)内蒙古通辽市科尔沁左翼中旗实验高级中学2023-2024学年高三下学期4月月考理综试题-高中化学(人教版2019)必修第二册 第六章 化学反应与能量 第一节 化学反应与能量变化云南省瑞丽市第一民族中学2021-2022学年高二上学期期末考试化学试题上海市同济中学2021-2022学年高一下学期期末考试化学试卷 作业(四) 原电池的工作原理海南省琼海市嘉积中学2023-2024学年高三上学期期末考试化学试题A卷
9 . 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:

(1)I、II、III、IV装置可盛放的试剂是:I___________ ;II___________ ;III___________ ;IV___________ (将下列有关试剂的序号填入空格内)。
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是___________ 。
(3)使用装置II的目的是___________ 。
(4)使用装置III的目的是___________ 。
(5)确定含有乙烯的现象是___________ 。

(1)I、II、III、IV装置可盛放的试剂是:I
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是
(3)使用装置II的目的是
(4)使用装置III的目的是
(5)确定含有乙烯的现象是
您最近一年使用:0次
2023-06-29更新
|
69次组卷
|
18卷引用:内蒙古北京八中乌兰察布分校2016-2017学年高一下学期第二次调考化学试题
内蒙古北京八中乌兰察布分校2016-2017学年高一下学期第二次调考化学试题(已下线)2012年人教版高中化学选修5 2.1脂肪烃练习卷(已下线)2014年高一化学人教版必修2 3.2.1乙烯练习卷高二人教版选修5 第三章 烃的含氧衍生物 第一节 醇酚云南省绥江县一中2018-2019学年高一下学期期末考试化学试题吉林省公主岭市范家屯镇第一中学2019-2020学年高二上学期第二次月考化学试题黑龙江省大兴安岭地区漠河县第一中学2018-2019学年高二上学期第一次月考化学试题课时1 石油的炼制 乙烯——A学习区 夯实基础(鲁科版必修2)课时1 甲烷 石油的炼制与乙烯——A学习区 夯实基础(鲁科版(2019)第二册)山东省德州市齐河县实验中学2019-2020学年高一下学期期中考试化学试题福建省莆田第七中学2020-2021学年高二上学期第一次月考化学试题上海市奉城高级中学2018-2019学年高二上学期期末考试化学试题安徽省安庆桐城市第八中学2020-2021学年高二上学期第一次段考化学试题黑龙江省双鸭山市第一中学2020-2021学年高二下学期4月月考化学试题云南省元阳县一中2020-2021学年高一下学期6月份考试化学试题陕西省西安市蓝田县大学区联考2022-2023学年高二下学期6月期末考试化学试题2.1.1有机化学反应的主要类型(课前)-鲁科版选择性必修3陕西省西安市蓝田县大学区联考2022-2023学年高二下学期4月期中考试化学试题
10 . 常温下,A是双原子分子形成的气态单质。A在标准状况下的密度为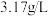 ,B、C、D都是含A中元素的化合物,它们之间的转化关系如图所示(图中有些反应的产物和反应条件没有标出)。
,B、C、D都是含A中元素的化合物,它们之间的转化关系如图所示(图中有些反应的产物和反应条件没有标出)。
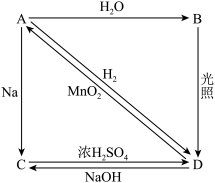
请回答下列问题:
(1)写出下列B的化学式:_______ ;
(2)氢气在A中点燃的现象为_______ ,A通入紫色石蕊溶液中的现象为_______ ;
(3)检验C中的阴离子需要加入的试剂是_______ (填化学式);
(4)常温下,A与 溶液反应的离子方程式为
溶液反应的离子方程式为_______ ;
(5)写出D→A的化学反应方程式为_______ ,此反应中,氧化剂与还原剂的物质的量之比为_______ 。
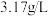 ,B、C、D都是含A中元素的化合物,它们之间的转化关系如图所示(图中有些反应的产物和反应条件没有标出)。
,B、C、D都是含A中元素的化合物,它们之间的转化关系如图所示(图中有些反应的产物和反应条件没有标出)。
请回答下列问题:
(1)写出下列B的化学式:
(2)氢气在A中点燃的现象为
(3)检验C中的阴离子需要加入的试剂是
(4)常温下,A与
 溶液反应的离子方程式为
溶液反应的离子方程式为(5)写出D→A的化学反应方程式为
您最近一年使用:0次



