1 .  为阿伏加德罗常数的值,下列说法
为阿伏加德罗常数的值,下列说法不正确 的是
 为阿伏加德罗常数的值,下列说法
为阿伏加德罗常数的值,下列说法
A.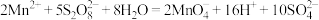 ,1mol[ ,1mol[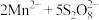 ]完全反应转移的电子数为 ]完全反应转移的电子数为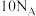 |
B.1L浓度为0.100 的 的 溶液中, 溶液中, 数小于 数小于 |
C.14.0g (分子结构如图所示)中所含N-N键数目为 (分子结构如图所示)中所含N-N键数目为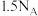 |
D.88.0g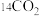 与 与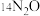 的混合物中所含中子数为 的混合物中所含中子数为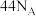 |
您最近一年使用:0次
2 . 下列说法正确的是
| A.在苯与液溴制备溴苯的实验中,溴苯提纯步骤:水洗、用10%的氢氧化钠溶液洗涤、水洗、用干燥剂干燥、蒸馏 |
| B.蒸馏实验时,若温度计水银球高于蒸馏烧瓶支管口,则收集到的馏分沸点偏低 |
| C.牺牲阳极的阴极保护法、外加电流的阳极保护法都可以用来保护金属 |
| D.向铜与浓硫酸反应后的混合液中加水,可以判断有无铜离子生成 |
您最近一年使用:0次
3 . 下列有关实验说法,正确的是
A.纸层析法分离 和 和 时,先将展开剂小心地沿试管内壁注入试管底部,然后将橡胶塞和点有试样的滤纸慢慢伸入试管内,使纸条末端浸入展开剂中,不要让试样点接触展开剂 时,先将展开剂小心地沿试管内壁注入试管底部,然后将橡胶塞和点有试样的滤纸慢慢伸入试管内,使纸条末端浸入展开剂中,不要让试样点接触展开剂 |
| B.氯化钠溶液含有少量硝酸钾,可用蒸发浓缩、冷却结晶来提纯氯化钠 |
| C.“静置”是实验过程中的常见操作,滴定管读数、移液管移液、萃取分液都有“静置”过程 |
D.可用 溶液区分NaCl、 溶液区分NaCl、 和 和 三种溶液 三种溶液 |
您最近一年使用:0次
解题方法
4 . 回答下列问题:
(1)下列反应中,属于吸热反应的是___________。
(2)已知相关化学键的键能(E)数据如下:
则CO(g)+2H2(g)  CH3OH(g) ΔH=
CH3OH(g) ΔH=___________ kJ/mol
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4kJ,该反应的热化学方程式是___________ 。
(4)已知密闭容器中某气体的化学反应,其平衡常数可表示为:K= 写出该反应的化学方程式:
写出该反应的化学方程式:___________ 。
(1)下列反应中,属于吸热反应的是___________。
| A.Na2O与水反应 | B.甲烷燃烧 |
| C.CaCO3受热分解 | D.锌与盐酸反应 |
| 化学键 | H-H | C-O | C O O | H-O | C-H |
| E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
 CH3OH(g) ΔH=
CH3OH(g) ΔH=(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4kJ,该反应的热化学方程式是
(4)已知密闭容器中某气体的化学反应,其平衡常数可表示为:K=
 写出该反应的化学方程式:
写出该反应的化学方程式:
您最近一年使用:0次
5 . 下列过程中,热效应判断不正确的是
| A.浓硫酸遇水会释放大量的热 |
| B.Ba(OH)2固体和NH4Cl固体混合反应会吸收热量 |
| C.NaHCO3固体溶于水会释放热量 |
| D.金属钠溶于水会释放大量的热 |
您最近一年使用:0次
解题方法
6 . 下列物质应用过程中不属于利用了化学反应产生的热效应的是
| A.利用管道燃气烧饭做菜 | B.利用充电宝给手机充电 |
| C.“暖宝宝”贴身上感觉发热 | D.自热饭中的加热包工作原理 |
您最近一年使用:0次
7 . (1)路易斯酸碱电子理论认为:凡是能接受电子对的物质(离子、分子或原子团)都称为路易斯酸;凡是能给出电子对的物质(离子、分子或原子团)都称为路易斯碱。根据信息判断,H2O属于___________ (填“酸”或“碱”,下同),Ag+属于___________ 。
(2)查表可知,金属铝(Al)的三卤化物晶体的熔点如下:
AlF3为什么熔点比AlCl3高得多,请分析原因___________ 。
(2)查表可知,金属铝(Al)的三卤化物晶体的熔点如下:
| 物质 | AlF3 | AlCl3 | AlBr3 |
| 熔点/℃ | 1290 | 192.4 | 97.8 |
AlF3为什么熔点比AlCl3高得多,请分析原因
您最近一年使用:0次
解题方法
8 . 高岭土矿的主要成分是Al2O3、SiO2及少量的Fe2O3,高岭土选矿酸性废水含有大量的H+、SO 、Al3+及少量的Fe3+等离子。工业上利用高岭土矿和酸性废水制备明矾KAl(SO4)2•12H2O(不考虑其它杂质参与反应)。其实验流程如下:
、Al3+及少量的Fe3+等离子。工业上利用高岭土矿和酸性废水制备明矾KAl(SO4)2•12H2O(不考虑其它杂质参与反应)。其实验流程如下:
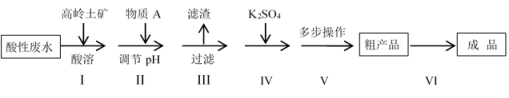
相关信息:
①Fe3+、Al3+完全沉淀的pH范围
②有关物质的溶解度
请回答:
(1)步骤I中,要加快高岭土酸溶的速率可以采取的措施有___________ 。(至少写两点),
(2)滤渣的主要成分是___________ 。
(3)下列说法中正确的是___________ 。
A.步骤I的主要目的是提高废水中铝离子的浓度
B.步骤II中的A物质可以是KOH或NaOH
C.步骤II中调节pH的范围是3.2<pH<3.4
D.步骤IV中需调控K2SO4的用量,使n(Al3+):n(K+):n(SO )尽可能接近1:1:2
)尽可能接近1:1:2
(4)步骤VI,为了得到较大颗粒且较干燥的晶体,请从下列选项中选出合理的操作(操作不重复)并排序:取粗产品于烧杯中加适量水→___________→___________→___________→抽滤→洗涤→___________。___________
a.70℃蒸发溶剂制成热的饱和溶液 b.30℃~40℃减压蒸发溶剂得到饱和溶液
c.加热烧杯至晶体完全溶解 d.缓慢冷却至室温 e.低温干燥 f.加热干燥
(5)为了测定成品中铝的含量,可采用的方法:将一定体积的成品待测液与过量的EDTA(化学式为Na2H2Y)标准液反应,加入几滴指示剂,再用ZnSO4标准液滴定过量的EDTA,反应原理如下:Al3++H2Y2-(过量)=AlY-+2H+、Zn2++H2Y2-(剩余)=ZnY2-+2H+(终点色为紫红色),过实验测出成品中铝的含量低于理论值,原因可能是___________ 。
A.制备过程中,由于结晶温度控制不当,溶液中硫酸钾晶体同时析出
B.酸式滴定管用蒸馏水洗净后就注入ZnSO4标准液
C.滴定时锥形瓶溶液出现紫红色,立即停止滴定
D.滴定前,滴定管内无气泡,滴定后有气泡
 、Al3+及少量的Fe3+等离子。工业上利用高岭土矿和酸性废水制备明矾KAl(SO4)2•12H2O(不考虑其它杂质参与反应)。其实验流程如下:
、Al3+及少量的Fe3+等离子。工业上利用高岭土矿和酸性废水制备明矾KAl(SO4)2•12H2O(不考虑其它杂质参与反应)。其实验流程如下:
相关信息:
①Fe3+、Al3+完全沉淀的pH范围
| 沉淀 | Fe(OH)3 | Al(OH)3 | ||
| pH范围 | 开始沉淀 | 完全沉淀 | 开始沉淀 | 完全沉淀 |
| 2.0 | 3.2 | 3.4 | 4.7 | |
| 温度/℃ 溶解度/g 物质 | 10 | 20 | 30 | 40 | 50 | 70 |
| K2SO4 | 8.46 | 9.55 | 11.4 | 12.9 | 14.2 | 16.7 |
| Al2(SO4)3 | 25.1 | 26.6 | 28.8 | 31.4 | 34.3 | 42.2 |
| KAl(SO4)2•12H2O | 4.0 | 5.9 | 8.4 | 11.7 | 17 | 40 |
(1)步骤I中,要加快高岭土酸溶的速率可以采取的措施有
(2)滤渣的主要成分是
(3)下列说法中正确的是
A.步骤I的主要目的是提高废水中铝离子的浓度
B.步骤II中的A物质可以是KOH或NaOH
C.步骤II中调节pH的范围是3.2<pH<3.4
D.步骤IV中需调控K2SO4的用量,使n(Al3+):n(K+):n(SO
 )尽可能接近1:1:2
)尽可能接近1:1:2(4)步骤VI,为了得到较大颗粒且较干燥的晶体,请从下列选项中选出合理的操作(操作不重复)并排序:取粗产品于烧杯中加适量水→___________→___________→___________→抽滤→洗涤→___________。
a.70℃蒸发溶剂制成热的饱和溶液 b.30℃~40℃减压蒸发溶剂得到饱和溶液
c.加热烧杯至晶体完全溶解 d.缓慢冷却至室温 e.低温干燥 f.加热干燥
(5)为了测定成品中铝的含量,可采用的方法:将一定体积的成品待测液与过量的EDTA(化学式为Na2H2Y)标准液反应,加入几滴指示剂,再用ZnSO4标准液滴定过量的EDTA,反应原理如下:Al3++H2Y2-(过量)=AlY-+2H+、Zn2++H2Y2-(剩余)=ZnY2-+2H+(终点色为紫红色),过实验测出成品中铝的含量低于理论值,原因可能是
A.制备过程中,由于结晶温度控制不当,溶液中硫酸钾晶体同时析出
B.酸式滴定管用蒸馏水洗净后就注入ZnSO4标准液
C.滴定时锥形瓶溶液出现紫红色,立即停止滴定
D.滴定前,滴定管内无气泡,滴定后有气泡
您最近一年使用:0次
9 . 硫粉和S2-反应可以生成多硫离子S ,如:S+S2-→S
,如:S+S2-→S 、2S+S2-→S
、2S+S2-→S 。 在10 mL S2-溶液中加入0.080 g硫粉,控制条件使硫粉完全反应,检测到溶液中最大聚合度的多硫离子是S32-,且离子浓度之比符合等比数列1,10,……10n-1。,若不考虑其他副反应,计算反应后溶液中S2-的浓度c1=
。 在10 mL S2-溶液中加入0.080 g硫粉,控制条件使硫粉完全反应,检测到溶液中最大聚合度的多硫离子是S32-,且离子浓度之比符合等比数列1,10,……10n-1。,若不考虑其他副反应,计算反应后溶液中S2-的浓度c1=_______ ,其起始浓度c0=_______ 。
 ,如:S+S2-→S
,如:S+S2-→S 、2S+S2-→S
、2S+S2-→S 。 在10 mL S2-溶液中加入0.080 g硫粉,控制条件使硫粉完全反应,检测到溶液中最大聚合度的多硫离子是S32-,且离子浓度之比符合等比数列1,10,……10n-1。,若不考虑其他副反应,计算反应后溶液中S2-的浓度c1=
。 在10 mL S2-溶液中加入0.080 g硫粉,控制条件使硫粉完全反应,检测到溶液中最大聚合度的多硫离子是S32-,且离子浓度之比符合等比数列1,10,……10n-1。,若不考虑其他副反应,计算反应后溶液中S2-的浓度c1=
您最近一年使用:0次
2021-07-15更新
|
100次组卷
|
3卷引用:浙江省丽水市缙云中学等三校2021-2022学年高三12月份联考化学试题
浙江省丽水市缙云中学等三校2021-2022学年高三12月份联考化学试题第32届中国化学奥林匹克竞赛(江苏赛区)初赛试题(已下线)解密02 物质的量(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
解题方法
10 . 工业合成氨是人工固氮的一种重要方式,氨的合成实现工业化生产迄今已有100多年历史,合成氨技术是人类科学技术领域的重要突破。请回答:
(1)下列有关获取原料气的说法正确的是___________ 。
A.可通过液化空气分离法得到氮气
B.可用煤、天然气与水蒸气反应制备水煤气,进而获取氢气
C.原料气需经净化处理以防催化剂中毒
D.电解水法获取氢气是一种较为廉价且高效的方法
(2)原料气中的杂质气体H2S可用过量氨水净化吸收,写出化学反应方程式___________ 。
(3)工业生产中氮气与氢气按物质的量之比为1:2.8进行投料,合成塔压强p恒定。若起始时氮气通入量为xmol,一段时间后测得氮气的平衡转化率为80%,用平衡分压代替平衡浓度表示平衡常数的KP=___________ (用p表示,气体分压=总压ⅹ物质的量分数)
(4)据统计,每年全世界在合成氨工业中向外排放CO2高达40亿吨,为循环使用CO2减少浪费,常见的方法是利用合成氨的产品NH3和副产品CO2合成尿素:
①2NH3(g)+CO2(g) NH2COONH4(l)
NH2COONH4(l) Ea1
Ea1
②NH2COONH4(l) CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l) Ea2
Ea2
副反应:NH2COONH4+H2O=(NH4)2CO3
已知活化能大小:Ea1<<Ea2
某科研小组模拟工业合成尿素生产,发现反应温度在140℃时生成尿素的反应速率反而比80℃小,可能原因是___________ 。
(5)工业合成尿素中,通常氨碳投料比大于2,请分析可能原因___________ 。
A.氨易获得,成本较低
B.氨过剩可提高二氧化碳的转化率,加快合成速率
C.氨气可与体系内水结合,减少氨基甲酸铵水解,抑制副反应发生
D.氨结合水,促进反应②正向移动
(1)下列有关获取原料气的说法正确的是
A.可通过液化空气分离法得到氮气
B.可用煤、天然气与水蒸气反应制备水煤气,进而获取氢气
C.原料气需经净化处理以防催化剂中毒
D.电解水法获取氢气是一种较为廉价且高效的方法
(2)原料气中的杂质气体H2S可用过量氨水净化吸收,写出化学反应方程式
(3)工业生产中氮气与氢气按物质的量之比为1:2.8进行投料,合成塔压强p恒定。若起始时氮气通入量为xmol,一段时间后测得氮气的平衡转化率为80%,用平衡分压代替平衡浓度表示平衡常数的KP=
(4)据统计,每年全世界在合成氨工业中向外排放CO2高达40亿吨,为循环使用CO2减少浪费,常见的方法是利用合成氨的产品NH3和副产品CO2合成尿素:
①2NH3(g)+CO2(g)
 NH2COONH4(l)
NH2COONH4(l) Ea1
Ea1②NH2COONH4(l)
 CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l) Ea2
Ea2副反应:NH2COONH4+H2O=(NH4)2CO3
已知活化能大小:Ea1<<Ea2
某科研小组模拟工业合成尿素生产,发现反应温度在140℃时生成尿素的反应速率反而比80℃小,可能原因是
(5)工业合成尿素中,通常氨碳投料比大于2,请分析可能原因
A.氨易获得,成本较低
B.氨过剩可提高二氧化碳的转化率,加快合成速率
C.氨气可与体系内水结合,减少氨基甲酸铵水解,抑制副反应发生
D.氨结合水,促进反应②正向移动
您最近一年使用:0次
2021-07-12更新
|
482次组卷
|
4卷引用:浙江省丽水市2020-2021学年高二下学期普通高中教学质量监控化学试题
浙江省丽水市2020-2021学年高二下学期普通高中教学质量监控化学试题(已下线)期中试卷01-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)(已下线)第12讲 化学反应的调控-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)第二章 第四节 化学反应的调控



