解题方法
1 . 青霉素类药物是人类史上最重要的抗菌药物,其中两种药物阿莫西林(P)、非奈西林(Q)、重要中间体6-APA的结构以及阿莫西林的合成路线如下图所示。
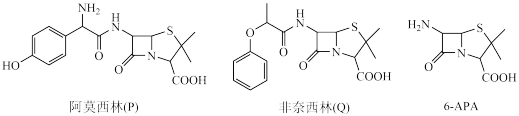
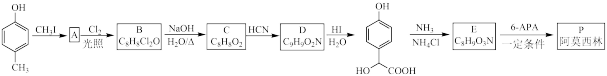
已知:①

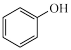
②RCHO + HCN → RCH(OH)CN
③RCN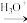 RCOOH + NH
RCOOH + NH
回答下列问题:
(1)C中含有的不饱和官能团的名称为_______ 。
(2)下列说法错误 的是_______。(填序号)
(3)D与足量氢碘酸反应的化学方程式为_______ 。
(4)写出6-APA满足下列条件的所有同分异构体的结构简式:__ 。
①含有苯环;
②含有磺酸基(-SO3H);
③核磁共振氢谱有4组峰
(5)试设计以苯酚、乙醛和6-APA为原料,制备非奈西林(Q)的合成路线__ 。(无机试剂任选)


已知:①

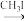

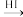
②RCHO + HCN → RCH(OH)CN
③RCN
 RCOOH + NH
RCOOH + NH
回答下列问题:
(1)C中含有的不饱和官能团的名称为
(2)下列说法
| A.1mol对甲基苯酚能与含2mol溴的溴水反应 |
| B.B能发生取代、加成、消去、氧化反应 |
| C.E能发生缩聚反应形成高分子 |
| D.阿莫西林分子中含有5个手性碳原子 |
(4)写出6-APA满足下列条件的所有同分异构体的结构简式:
①含有苯环;
②含有磺酸基(-SO3H);
③核磁共振氢谱有4组峰
(5)试设计以苯酚、乙醛和6-APA为原料,制备非奈西林(Q)的合成路线
您最近一年使用:0次
名校
解题方法
2 . 黄色固体X是由四种元素组成的化合物,用作颜料和食品的抗结剂,为测定其组成,进行如下实验。已知气体D能使澄清石灰水变浑浊,溶液F中只含有一种溶质。回答下列问题:
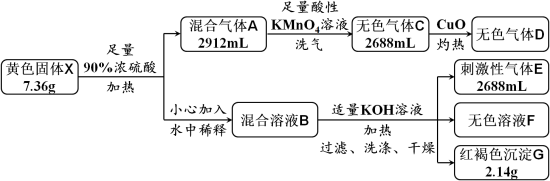
(1)固体X的组成元素是_______ 。
(2)混合气体A中所含物质的化学式为_______ 。
(3)实验中溶液B由X转化而来的溶质与KOH反应的总离子方程式为_______ 。
(4)证明沉淀G中的金属元素已完全沉淀的方法是_______ 。
(5)X与酸性KMnO4溶液反应,可生成一种与X组成元素相同,但式量比其小39的化合物,该反应的化学方程式为_______ 。

(1)固体X的组成元素是
(2)混合气体A中所含物质的化学式为
(3)实验中溶液B由X转化而来的溶质与KOH反应的总离子方程式为
(4)证明沉淀G中的金属元素已完全沉淀的方法是
(5)X与酸性KMnO4溶液反应,可生成一种与X组成元素相同,但式量比其小39的化合物,该反应的化学方程式为
您最近一年使用:0次
2022-12-09更新
|
422次组卷
|
4卷引用:浙江省诸暨海亮高级中学2021-2022学年高三12月份选考模拟化学试题
浙江省诸暨海亮高级中学2021-2022学年高三12月份选考模拟化学试题浙江省舟山中学2022-2023学年高三上学期首考模拟卷(三)化学试题(已下线)浙江省温州市普通高中2023届高三下学期第二次适应性考试化学试题变式题(无机推断题)甘肃省两县高中联考2023-2024学年高三上学期12月月考化学试题
3 . 在常温常压下,下列属于自发过程的是
| A.2C(s) + O2(g) = 2CO(g) |
| B.NH4Cl(s) = NH3(g) + HCl(g) |
| C.CH3COOH(l) = CH3COOH(s) |
D.2Cr3+(aq) + 3Cl2(aq) + 7H2O(l) = Cr2O (aq) + 6Cl-(aq)+14H+(aq) (aq) + 6Cl-(aq)+14H+(aq) |
您最近一年使用:0次
解题方法
4 . 在Cl·(氯自由基)参与下,CH4与Cl2反应生成CH3Cl和HCl的能量-反应进程图如图所示,下列说法正确的是


| A.该反应的决速步是第二步 |
| B.Cl·是该反应的催化剂 |
| C.CH3·+ Cl2 + HCl是该反应的过渡态 |
| D.升高温度,Ea1和Ea2变小,反应速率增大 |
您最近一年使用:0次
名校
解题方法
5 . 以海水和贝壳为原料制备金属镁和漂白粉的流程如下图所示。下列说法不正确 的是
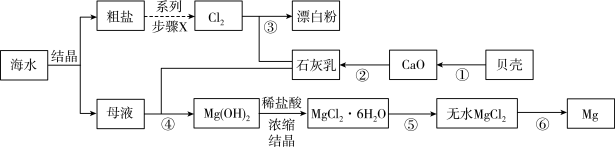

| A.图中的系列步骤x包括粗盐提纯和电解 |
| B.步骤③反应的离子方程式为Cl2 + Ca(OH)2 =Ca2++ Cl-+ClO-+H2O |
| C.在实验室实现步骤④所需要的玻璃仪器有漏斗、烧杯、玻璃棒 |
| D.为防止生成氧化镁,步骤⑥制得的镁应在氮气氛围中冷却 |
您最近一年使用:0次
2022-12-09更新
|
290次组卷
|
2卷引用:浙江省诸暨海亮高级中学2021-2022学年高三12月份选考模拟化学试题
解题方法
6 . 下列工业提取物质的方法不正确 的是
| A.工业上用电解饱和食盐水制备氯气 |
| B.用“吹出法”从海水中提取溴需要用到SO2 |
| C.可以直接加热分解氧化银制备金属银 |
| D.碳酸钠是烘制糕点所用发酵剂的主要成分之一 |
您最近一年使用:0次
解题方法
7 . 完成下列问题:
(1)用离子方程式表示碳酸钠溶液显碱性的原因:_______ 。
(2)汽油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),判断该设想能否实现,并简述原因:_______ 。
(3)25℃时,在1L0.1mol/L的HA溶液中,有0.001mol的HA电离成离子,则该温度下的电离平衡常数为_______ 。
(4)在25℃时,将pH=11 的Ba(OH)2溶液Va L与 pH=2 的HCl溶液Vb L混合,若所得溶液为中性,则Va :Vb=_______ 。
(5)常温下将10 mL 0.1 mol/L的NaOH溶液与10 mL 0.2 mol/L的醋酸溶液混合后溶液显酸性,则混合后溶液中各离子浓度的大小顺序为_______ 。
(6)已知常温下部分弱电解质的电离平衡常数如下表:
常温下,pH相同的三种溶液①NaF溶液;②NaClO溶液;③Na2CO3溶液,其物质的量浓度由大到小的顺序是_______ (填序号)。
(7)已知25℃时,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=1.0×10-32。则使Cr3+恰好完全沉淀,即溶液中c(Cr3+)=1.0×10-5mol/L时,应调节pH的最小值a为多少_______
(1)用离子方程式表示碳酸钠溶液显碱性的原因:
(2)汽油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),判断该设想能否实现,并简述原因:
(3)25℃时,在1L0.1mol/L的HA溶液中,有0.001mol的HA电离成离子,则该温度下的电离平衡常数为
(4)在25℃时,将pH=11 的Ba(OH)2溶液Va L与 pH=2 的HCl溶液Vb L混合,若所得溶液为中性,则Va :Vb=
(5)常温下将10 mL 0.1 mol/L的NaOH溶液与10 mL 0.2 mol/L的醋酸溶液混合后溶液显酸性,则混合后溶液中各离子浓度的大小顺序为
(6)已知常温下部分弱电解质的电离平衡常数如下表:
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10-4 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 | Kb=1.7×10-5 |
(7)已知25℃时,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=1.0×10-32。则使Cr3+恰好完全沉淀,即溶液中c(Cr3+)=1.0×10-5mol/L时,应调节pH的最小值a为多少
您最近一年使用:0次
8 . 对于下列物质,请用编号填空:
①BeCl2 ②CH3CHClCH2CH3 ③金刚砂 ④石墨 ⑤NH4Cl ⑥SO3 ⑦Cu(NH3)4SO4 ⑧明矾 ⑨新戊烷 ⑩Pt
(1)属于共价化合物的是____ 。
(2)其晶体属于共价晶体的是____ 。
(3)其分子属于手性分子的是____ 。
(4)属于非极性分子的是____ 。
(5)属于配合物的是____ 。
①BeCl2 ②CH3CHClCH2CH3 ③金刚砂 ④石墨 ⑤NH4Cl ⑥SO3 ⑦Cu(NH3)4SO4 ⑧明矾 ⑨新戊烷 ⑩Pt
(1)属于共价化合物的是
(2)其晶体属于共价晶体的是
(3)其分子属于手性分子的是
(4)属于非极性分子的是
(5)属于配合物的是
您最近一年使用:0次
解题方法
9 . 某兴趣小组用L-乳酸钙制备L-乳酸亚铁晶体,流程如下:

已知: Fe3+对产品的品质有较大的影响,相关实验结果图示如下:

请回答:
(1)步骤II中反应时间控制在30min,不能过长也不能过短,原因是___________ 。
(2)下列说法不正确的是___________
A.步骤I,反应中控制温度的方法可以采用恒温水浴加热
B.反应温度65-70°C时,产品的收率高,生成的结晶颗粒较大,固液分离较为完全,产品中夹杂的Fe3+含量减少。
C.步骤II,反应应在密闭容器或通氮条件下进行,以减少空气对亚铁盐的氧化
D.步骤III中,为析出颗粒比较大晶体,可采用冰水冷却
E.步骤V,将滤液蒸发、浓缩、过滤、结晶可得副产物CaCl2
(3)对于步骤IV:
①洗涤剂可通过蒸馏实现循环利用。如图是蒸馏装置示意图,其中分馏柱分馏柱的作用是___________ 。

②在干燥前,为得到纯度较高的L-乳酸亚铁晶体,需要对粗产品进行洗涤,请从下列选项中选出合理的操作(操作不能重复使用) 并排序:___________
粗产品放入烧杯中→( )→( )→ ( )→( )→低温真空干燥
a.加入适量的冷水
b.加入适量的65°C- 70°C的水
c.加入80% -85%的乙醇溶液。
d.静置使产品充分沉降
e.将烧杯中的上层清液沿玻璃棒倒入另一只烧杯中
f.用玻璃棒充分搅拌
(4)实验室可用电位滴定法测定L-乳酸亚铁中的Fe2+含量。在被测溶液中插入一个指示电极和一个参比电极组成一个工作电池,当用酸性高锰酸钾标准溶液滴定乳酸亚铁溶液时,Fe2+浓度不断变化,指示电极的电位相应变化,根据测量工作电池电动势的变化就可确定终点。用E表示指示电极的电位,V表示标准溶液体积,△E表示指示电极的电位改变量,△V表示标准溶液体积增量,以下滴定过程中所示图象正确的是
(5)某研究小组用KMnO4滴定法测定样品中乳酸亚铁含量进而计算产品中乳酸亚铁的纯度,发现结果总是大于100%,其原因可能是___________

已知: Fe3+对产品的品质有较大的影响,相关实验结果图示如下:

请回答:
(1)步骤II中反应时间控制在30min,不能过长也不能过短,原因是
(2)下列说法不正确的是
A.步骤I,反应中控制温度的方法可以采用恒温水浴加热
B.反应温度65-70°C时,产品的收率高,生成的结晶颗粒较大,固液分离较为完全,产品中夹杂的Fe3+含量减少。
C.步骤II,反应应在密闭容器或通氮条件下进行,以减少空气对亚铁盐的氧化
D.步骤III中,为析出颗粒比较大晶体,可采用冰水冷却
E.步骤V,将滤液蒸发、浓缩、过滤、结晶可得副产物CaCl2
(3)对于步骤IV:
①洗涤剂可通过蒸馏实现循环利用。如图是蒸馏装置示意图,其中分馏柱分馏柱的作用是

②在干燥前,为得到纯度较高的L-乳酸亚铁晶体,需要对粗产品进行洗涤,请从下列选项中选出合理的操作(操作不能重复使用) 并排序:
粗产品放入烧杯中→( )→( )→ ( )→( )→低温真空干燥
a.加入适量的冷水
b.加入适量的65°C- 70°C的水
c.加入80% -85%的乙醇溶液。
d.静置使产品充分沉降
e.将烧杯中的上层清液沿玻璃棒倒入另一只烧杯中
f.用玻璃棒充分搅拌
(4)实验室可用电位滴定法测定L-乳酸亚铁中的Fe2+含量。在被测溶液中插入一个指示电极和一个参比电极组成一个工作电池,当用酸性高锰酸钾标准溶液滴定乳酸亚铁溶液时,Fe2+浓度不断变化,指示电极的电位相应变化,根据测量工作电池电动势的变化就可确定终点。用E表示指示电极的电位,V表示标准溶液体积,△E表示指示电极的电位改变量,△V表示标准溶液体积增量,以下滴定过程中所示图象正确的是
A. | B. |
C. | D. |
您最近一年使用:0次
10 . 某兴趣小组对化合物X开展探究实验:
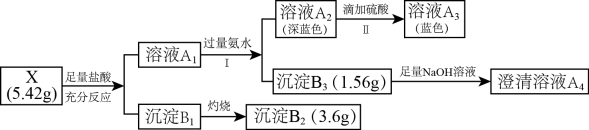
其中:化合物X有由4种元素组成;沉淀B2是工业生产玻璃的重要原料。
请回答:
(1)组成X的四种元素中除含O外,还有___________ (填元素符号)。
(2)在澄清溶液A4中通入过量CO2,产生沉淀的离子方程式为___________ 。
(3)步骤I中生成沉淀B3的离子方程式为___________ 。
(4)步骤II中溶液由深蓝色转变为蓝色的原因是___________ 。
(5)为进一步确定X的化学式,往溶液A1中通入足量的SO2,生成0.995g的白色沉淀(其中氯元素的质量分数为35.7%),在反应后的溶液中滴加BaCl2溶液,有白色沉淀生成。
①写出A1中通入SO2的离子反应方程式___________ 。
②确定X的化学式为___________ 。

其中:化合物X有由4种元素组成;沉淀B2是工业生产玻璃的重要原料。
请回答:
(1)组成X的四种元素中除含O外,还有
(2)在澄清溶液A4中通入过量CO2,产生沉淀的离子方程式为
(3)步骤I中生成沉淀B3的离子方程式为
(4)步骤II中溶液由深蓝色转变为蓝色的原因是
(5)为进一步确定X的化学式,往溶液A1中通入足量的SO2,生成0.995g的白色沉淀(其中氯元素的质量分数为35.7%),在反应后的溶液中滴加BaCl2溶液,有白色沉淀生成。
①写出A1中通入SO2的离子反应方程式
②确定X的化学式为
您最近一年使用:0次



