名校
1 . 工业上用废料制备 的工艺流程如图所示:
的工艺流程如图所示:
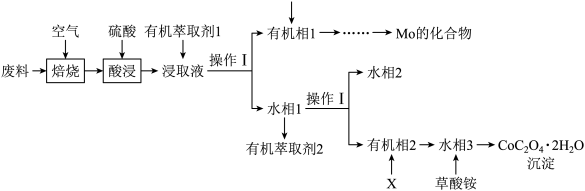
已知:①废料中主要含有 、
、 、
、 ,其他杂质不参与反应;
,其他杂质不参与反应;
②焙烧时,Mo元素转化为 ;
;
③浸取液中金属离子以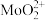 、
、 、
、 形式存在;
形式存在;
④25℃时, 的
的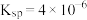 。
。
回答下列问题:
(1)Co元素在元素周期表中的位置是___________ 。已知Mo的核电荷数为42,Mo(IV)离子的价层电子排布式是___________ 。
(2)焙烧时,发生氧化反应的元素有___________ (填元素符号)。标准状况下33.6L 参与焙烧,完全反应时转移的电子的物质的量为
参与焙烧,完全反应时转移的电子的物质的量为___________ 。
(3)酸浸时,所用硫酸过量,则Mo元素发生转化的离子方程式为___________ 。
(4)在实验室进行操作I,所用到的玻璃仪器有___________ 。
(5)萃取 “的原理是“
“的原理是“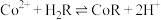 ”,水相2中存在的主要阳离子有
”,水相2中存在的主要阳离子有___________ ,加入试剂X是___________ (填名称),假定水相3中 的浓度为c mo/L,且沉钴过程中加入沉淀剂固体后不考虑溶液体积变化,并忽略盐类的水解,当
的浓度为c mo/L,且沉钴过程中加入沉淀剂固体后不考虑溶液体积变化,并忽略盐类的水解,当 沉淀完全时,溶液中
沉淀完全时,溶液中 最小值的计算式为
最小值的计算式为___________ mol/L(用含c的计算式表示)。
(6)在空气中加热10.98g ,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。经测定,加热到210~320℃过程中的生成物只有
,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。经测定,加热到210~320℃过程中的生成物只有 和钴的氧化物,此过程发生反应的化学方程式为
和钴的氧化物,此过程发生反应的化学方程式为___________ 。
 的工艺流程如图所示:
的工艺流程如图所示:
已知:①废料中主要含有
 、
、 、
、 ,其他杂质不参与反应;
,其他杂质不参与反应;②焙烧时,Mo元素转化为
 ;
;③浸取液中金属离子以
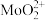 、
、 、
、 形式存在;
形式存在;④25℃时,
 的
的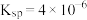 。
。回答下列问题:
(1)Co元素在元素周期表中的位置是
(2)焙烧时,发生氧化反应的元素有
 参与焙烧,完全反应时转移的电子的物质的量为
参与焙烧,完全反应时转移的电子的物质的量为(3)酸浸时,所用硫酸过量,则Mo元素发生转化的离子方程式为
(4)在实验室进行操作I,所用到的玻璃仪器有
(5)萃取
 “的原理是“
“的原理是“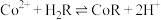 ”,水相2中存在的主要阳离子有
”,水相2中存在的主要阳离子有 的浓度为c mo/L,且沉钴过程中加入沉淀剂固体后不考虑溶液体积变化,并忽略盐类的水解,当
的浓度为c mo/L,且沉钴过程中加入沉淀剂固体后不考虑溶液体积变化,并忽略盐类的水解,当 沉淀完全时,溶液中
沉淀完全时,溶液中 最小值的计算式为
最小值的计算式为(6)在空气中加热10.98g
 ,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。经测定,加热到210~320℃过程中的生成物只有
,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。经测定,加热到210~320℃过程中的生成物只有 和钴的氧化物,此过程发生反应的化学方程式为
和钴的氧化物,此过程发生反应的化学方程式为| 温度范围/℃ | 固体质量/g |
| 150~210 | 8.82 |
| 210~320 | 4.82 |
| 890~920 | 4.50 |
您最近一年使用:0次
2022-09-25更新
|
403次组卷
|
2卷引用:重庆市巴蜀中学2022-2023学年高三上学期月考化学试题
名校
解题方法
2 . 我国科学家在铁基高温超导体的研究上取得重大突破,发现了该超导体是由Fe、Al、S、Se、Mn等元素组成,这为进一步理解超导配对机理提供了重要实验证据。回答下列问题:
(1)基态S原子的原子核外有共有_____ 种能量不同的电子,其能量最高的电子电子云轮廓图为_____ 形。
(2)铁在元素周期表中的位置是________ ,其价电子排布式是________ 。
(3)在第四周期中未成对电子数最多的元素是________ (填元素名称)。 也是第四周期元素,与O同族,是动物和人体所必需的微量元素之一,写出O、Se元素对应简单氢化物热稳定性的关系
也是第四周期元素,与O同族,是动物和人体所必需的微量元素之一,写出O、Se元素对应简单氢化物热稳定性的关系______ (用化学式表示)。
(4)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+_____ (填“无”或“有”)颜色。
(5)与Al元素成“对角线规则”关系的短周期元素Be的最高价氧化物的水化物具有两性,写出该两性物质与氢氧化钠溶液反应的化学方程式:___________ 。
(1)基态S原子的原子核外有共有
(2)铁在元素周期表中的位置是
(3)在第四周期中未成对电子数最多的元素是
 也是第四周期元素,与O同族,是动物和人体所必需的微量元素之一,写出O、Se元素对应简单氢化物热稳定性的关系
也是第四周期元素,与O同族,是动物和人体所必需的微量元素之一,写出O、Se元素对应简单氢化物热稳定性的关系(4)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+
(5)与Al元素成“对角线规则”关系的短周期元素Be的最高价氧化物的水化物具有两性,写出该两性物质与氢氧化钠溶液反应的化学方程式:
您最近一年使用:0次
名校
3 . 硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
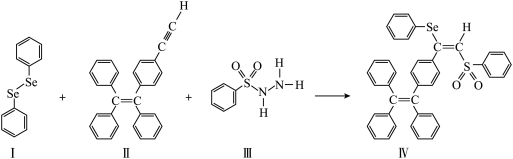
分子 的合成路线如下:
的合成路线如下:
(1) 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为___________ 。
(2) 的沸点低于
的沸点低于 ,其原因是
,其原因是___________ 。
(3)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有___________ 。
A.Ⅰ中仅有 键 B.Ⅰ中的
键 B.Ⅰ中的 键为非极性共价键 C.Ⅱ易溶于水
键为非极性共价键 C.Ⅱ易溶于水
D.Ⅱ中原子的杂化轨道类型只有 与
与 E.Ⅰ~Ⅲ含有的元素中,O电负性最大
E.Ⅰ~Ⅲ含有的元素中,O电负性最大
(4) 的杂化类型为
的杂化类型为___________ 。
(5)硒的两种化合物的键角大小为SeO3___________ SeO (填“>”或“<”或者“=”),原因是:
(填“>”或“<”或者“=”),原因是:___________ 。
(6)MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是___________ 。

以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,a点硫原子坐标为(1, ,
, ),b点锰原子坐标为(0,
),b点锰原子坐标为(0, ,0),则c点锰原子坐标为
,0),则c点锰原子坐标为___________ 。MnS的密度为ρg/cm3,摩尔质量为M g/mol,NA表示阿伏加德罗常数的值,则晶胞中S原子距离相等且最近的S原子的距离为___________ nm(列式表示)。
 )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下:
(1)
 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为(2)
 的沸点低于
的沸点低于 ,其原因是
,其原因是(3)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有
A.Ⅰ中仅有
 键 B.Ⅰ中的
键 B.Ⅰ中的 键为非极性共价键 C.Ⅱ易溶于水
键为非极性共价键 C.Ⅱ易溶于水D.Ⅱ中原子的杂化轨道类型只有
 与
与 E.Ⅰ~Ⅲ含有的元素中,O电负性最大
E.Ⅰ~Ⅲ含有的元素中,O电负性最大(4)
 的杂化类型为
的杂化类型为(5)硒的两种化合物的键角大小为SeO3
 (填“>”或“<”或者“=”),原因是:
(填“>”或“<”或者“=”),原因是:(6)MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是

以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,a点硫原子坐标为(1,
 ,
, ),b点锰原子坐标为(0,
),b点锰原子坐标为(0, ,0),则c点锰原子坐标为
,0),则c点锰原子坐标为
您最近一年使用:0次
名校
4 . 阿司匹林( )是一种用途很广的消炎镇痛药物。可以通过以下方法合成:
)是一种用途很广的消炎镇痛药物。可以通过以下方法合成:

已知:
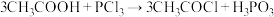 。
。
请回答下列问题:
(1)阿司匹林中的含氧官能团有___________ (写名称),反应①的反应类型为___________ 。
(2)通过水杨酸还可制得香料E和高分子化合物G,转化关系如图。

①请写出A→E的化学方程式:___________ 。
②已知G是一种聚酯,请写出其结构简式:___________ 。
(3)水杨酸所有属于芳香酯的同分异构体中,苯环上有两个对位取代基的结构简式为_______ 。
(4)结合题中信息,以苯酚、异丁烯为原料(其他无机原料自选)合成聚合物 的流程路线如下:
的流程路线如下:

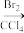 ………
………



请完善上述合成流程路线中的省略部分___________ 。
 )是一种用途很广的消炎镇痛药物。可以通过以下方法合成:
)是一种用途很广的消炎镇痛药物。可以通过以下方法合成:
已知:

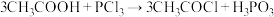 。
。请回答下列问题:
(1)阿司匹林中的含氧官能团有
(2)通过水杨酸还可制得香料E和高分子化合物G,转化关系如图。

①请写出A→E的化学方程式:
②已知G是一种聚酯,请写出其结构简式:
(3)水杨酸所有属于芳香酯的同分异构体中,苯环上有两个对位取代基的结构简式为
(4)结合题中信息,以苯酚、异丁烯为原料(其他无机原料自选)合成聚合物
 的流程路线如下:
的流程路线如下:
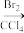 ………
………



请完善上述合成流程路线中的省略部分
您最近一年使用:0次
名校
解题方法
5 . 化合物G是一种药物中间体,其合成路线如图所示:
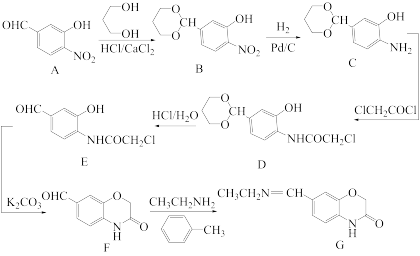
(1)A的分子式为___________ ,物质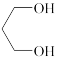 的化学名称为
的化学名称为___________ (系统命名法)。
(2)A→B的反应需经历A→X→B的过程,X的化学式为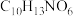 ,则推测X的结构简式为
,则推测X的结构简式为___________ 。
(3)B→C、C→D的反应类型分别为___________ 、___________ 。
(4)写出E→F反应的化学方程式:___________ 。
(5)C有多种同分异构体,写出满足以下要求的同分异构体的结构简式:___________ (只写一种)。
①能与 溶液发生显色反应;
溶液发生显色反应;
②核磁共振氢谱显示四组峰,且峰面积之比为6:3:2:2。
(6)参照题干中的合成路线及信息,以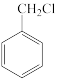 、
、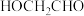 和苯酚为有机原料制备
和苯酚为有机原料制备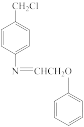 ,设计合成路线图
,设计合成路线图_______ (无机试剂任选,用箭头表示转化关系,箭头上注明试剂和反应条件)。

(1)A的分子式为
 的化学名称为
的化学名称为(2)A→B的反应需经历A→X→B的过程,X的化学式为
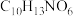 ,则推测X的结构简式为
,则推测X的结构简式为(3)B→C、C→D的反应类型分别为
(4)写出E→F反应的化学方程式:
(5)C有多种同分异构体,写出满足以下要求的同分异构体的结构简式:
①能与
 溶液发生显色反应;
溶液发生显色反应;②核磁共振氢谱显示四组峰,且峰面积之比为6:3:2:2。
(6)参照题干中的合成路线及信息,以
 、
、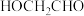 和苯酚为有机原料制备
和苯酚为有机原料制备 ,设计合成路线图
,设计合成路线图
您最近一年使用:0次
2022-09-25更新
|
358次组卷
|
3卷引用:重庆市巴蜀中学2022-2023学年高三上学期月考化学试题
名校
解题方法
6 . (Te)与氧元素同族,在元素周期表中与硒(Se)相邻,位于硒(Se)的下方。含元素碲(Te)的几种物质存在如图所示转化关系。下列说法错误的是
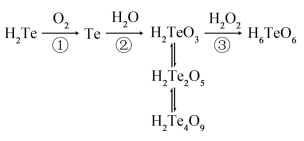

A.反应①利用了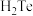 的还原性 的还原性 |
| B.碲(Te)位于元素周期表中第五周期第ⅥA族 |
C.反应③利用了 的氧化性 的氧化性 |
| D.H2Te2O5转化为H2Te4O9发生了氧化还原反应 |
您最近一年使用:0次
名校
解题方法
7 . 从钒铬锰矿渣(主要成分为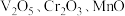 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下: 较大时,二价锰
较大时,二价锰 在空气中易被氧化。回答下列问题:
在空气中易被氧化。回答下列问题:
(1) 元素位于元素周期表第
元素位于元素周期表第_______ 周期_______ 族。
(2)用 溶液制备
溶液制备 胶体的化学方程式为
胶体的化学方程式为_______ 。
(3)常温下,各种形态五价钒粒子总浓度的对数 与
与 关系如图1,已知钒铬锰矿渣硫酸浸液中
关系如图1,已知钒铬锰矿渣硫酸浸液中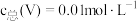 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为_______ (填化学式)。 (III)、
(III)、 (II)的沉淀率与
(II)的沉淀率与 关系如图2,“沉铬”过程最佳
关系如图2,“沉铬”过程最佳 为
为_______ (填标号);
a.4.0 b.5.0 c.6.0
在该条件下滤液B中
_______  [
[ 近似为
近似为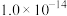 ,
, 的
的 近似为
近似为 ]。
]。
(5)“转化”过程中生成 的离子方程式为
的离子方程式为_______ 。
(6)“提纯”过程中 的作用为
的作用为_______ 。
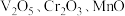 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下: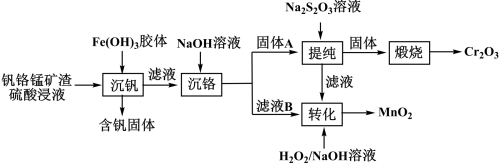
 较大时,二价锰
较大时,二价锰 在空气中易被氧化。回答下列问题:
在空气中易被氧化。回答下列问题:(1)
 元素位于元素周期表第
元素位于元素周期表第(2)用
 溶液制备
溶液制备 胶体的化学方程式为
胶体的化学方程式为(3)常温下,各种形态五价钒粒子总浓度的对数
 与
与 关系如图1,已知钒铬锰矿渣硫酸浸液中
关系如图1,已知钒铬锰矿渣硫酸浸液中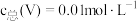 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为
 (III)、
(III)、 (II)的沉淀率与
(II)的沉淀率与 关系如图2,“沉铬”过程最佳
关系如图2,“沉铬”过程最佳 为
为a.4.0 b.5.0 c.6.0
在该条件下滤液B中

 [
[ 近似为
近似为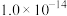 ,
, 的
的 近似为
近似为 ]。
]。(5)“转化”过程中生成
 的离子方程式为
的离子方程式为(6)“提纯”过程中
 的作用为
的作用为
您最近一年使用:0次
名校
解题方法
8 . 现有部分短周期主族元素的性质或原子结构如表所示:
A、B、D三种单质(单质分别由X、Y、Z元素组成)和甲、乙、丙、丁四种化合物之间的转化关系如图所示(某些条件已略去)。其中丁是一种高能燃料,常用于火箭推进剂,1个丁分子中含有18个电子,其组成元素与丙相同。
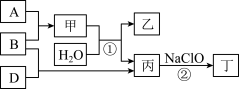
请回答:
(1)元素X在周期表中的位置是_______ ,元素Y的原子结构示意图为_______ 。
(2)单质B电子式为_______ ,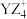 中心原子杂化类型为
中心原子杂化类型为_______ ,空间结构为_______ 。
(3)分子中的大π键可以用符号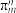 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则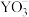 中中心原子价层电子对数为
中中心原子价层电子对数为_______ ,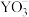 的大π键可表示为
的大π键可表示为_______ 。
(4)丙中所包含的化学键类型有_______ (填字母序号)。
A.离子键 B.极性共价键 C.非极性共价键
(5)反应①的化学方程式为_______ 。
(6)反应②中,0.5molNaClO参加反应时,转移1mol电子,反应②的离子方程式为:_______ 。
| 元素编号 | 元素性质或原子结构 |
| X | 其电子层上M层与K层上的电子数相等 |
| Y | 其最简单氢化物丙的水溶液呈碱性 |
| Z | 其原子半径在所有原子中最小 |

请回答:
(1)元素X在周期表中的位置是
(2)单质B电子式为
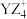 中心原子杂化类型为
中心原子杂化类型为(3)分子中的大π键可以用符号
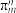 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则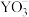 中中心原子价层电子对数为
中中心原子价层电子对数为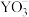 的大π键可表示为
的大π键可表示为(4)丙中所包含的化学键类型有
A.离子键 B.极性共价键 C.非极性共价键
(5)反应①的化学方程式为
(6)反应②中,0.5molNaClO参加反应时,转移1mol电子,反应②的离子方程式为:
您最近一年使用:0次
2023-01-13更新
|
167次组卷
|
2卷引用:重庆西南大学附属中学校2022-2023学年高二上学期1月线上定时检测化学试题
名校
9 . 研究碳、氮、硫等元素化合物的性质或转化对建设生态文明,美丽中国具有重要意义。
(1)基态硫原子的价层电子轨道表示式为:___________ 。
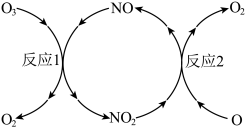
(2) 加速臭氧层被破坏,其反应过程如下图所示:
加速臭氧层被破坏,其反应过程如下图所示:
已知: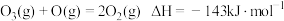
反应1: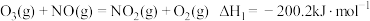 。
。
反应2的热化学方程式为___________ 。
(3)工业上以 和
和 为原料合成甲醇的反应:
为原料合成甲醇的反应: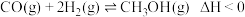 ,在容积为
,在容积为 的恒容容器中,分别在
的恒容容器中,分别在 温度下合成甲醇。如图是不同温度下
温度下合成甲醇。如图是不同温度下 和
和 的起始组成比(起始时
的起始组成比(起始时 的物质的量均为
的物质的量均为 )与
)与 平衡转化率的关系。
平衡转化率的关系。

①判断
___________  (选填“<”、“>”或“=”);
(选填“<”、“>”或“=”);
②若a点达到平衡的时间是5分钟,从反应开始到平衡用 表示的反应速率为
表示的反应速率为
___________ ;
③d点的平衡常数的值为___________ ;
④a点状态下再通入 和
和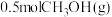 ,平衡
,平衡___________ 移动(选填“正向”、“逆向”或“不”);
⑤a、b、c三点 转化率由大到小的顺序是
转化率由大到小的顺序是___________ 。
(1)基态硫原子的价层电子轨道表示式为:
(2)
 加速臭氧层被破坏,其反应过程如下图所示:
加速臭氧层被破坏,其反应过程如下图所示:
已知:
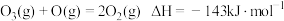
反应1:
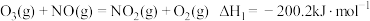 。
。反应2的热化学方程式为
(3)工业上以
 和
和 为原料合成甲醇的反应:
为原料合成甲醇的反应: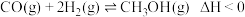 ,在容积为
,在容积为 的恒容容器中,分别在
的恒容容器中,分别在 温度下合成甲醇。如图是不同温度下
温度下合成甲醇。如图是不同温度下 和
和 的起始组成比(起始时
的起始组成比(起始时 的物质的量均为
的物质的量均为 )与
)与 平衡转化率的关系。
平衡转化率的关系。
①判断

 (选填“<”、“>”或“=”);
(选填“<”、“>”或“=”);②若a点达到平衡的时间是5分钟,从反应开始到平衡用
 表示的反应速率为
表示的反应速率为
③d点的平衡常数的值为
④a点状态下再通入
 和
和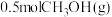 ,平衡
,平衡⑤a、b、c三点
 转化率由大到小的顺序是
转化率由大到小的顺序是
您最近一年使用:0次
名校
解题方法
10 . 为加快实现“双碳”目标,CO2的资源化利用成为了科研的热门选题。
(1)工业上利用CO2和H2为原料,在催化剂Cu/ZnO的作用下合成甲醇,该反应的热化学方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49kJ•mol-1。
CH3OH(g)+H2O(g)△H=-49kJ•mol-1。
①该反应在_____ (填“高温”“低温”或“任意温度”)下,易自发进行。
②该反应分两步进行:
第一步Cu/ZnO*=Cu/Zn*+H2O△H>0
第二步Cu/Zn*+2H2+CO2=Cu/ZnO*+CH3OH
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知以下能正确表示反应过程中能量变化的示意图为______ (填序号)。
a.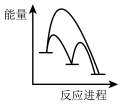 b.
b.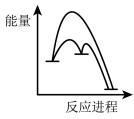 c.
c.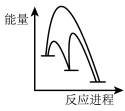 d.
d.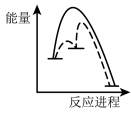
(2)Sabatier反应可实现CO2甲烷化:反应1为CO2(g)+4H2(g) CH4(g)+2H2O(g)△H=-165kJ•mol-1,该反应发生的同时还伴随着副反应;反应2为CO2(g)+H2(g)
CH4(g)+2H2O(g)△H=-165kJ•mol-1,该反应发生的同时还伴随着副反应;反应2为CO2(g)+H2(g) CO(g)+H2O(g)△H=+41kJ•mol-1,将5molCO2和20molH2通入某恒压密闭容器中将CO2甲烷化,平衡时体系中各含碳元素物质的物质的量n(X)与温度T的关系如图所示。
CO(g)+H2O(g)△H=+41kJ•mol-1,将5molCO2和20molH2通入某恒压密闭容器中将CO2甲烷化,平衡时体系中各含碳元素物质的物质的量n(X)与温度T的关系如图所示。

①曲线Y代表的物质是______ (填化学式),曲线Z所代表的物质在1100K以上物质的量减小的原因是______ 。
②800K时,若经过10min达到平衡,则该条件下0~10min内H2O的平均生成速率v(H2O)=_______ mol•min-1。
③当反应1和反应2均达到化学平衡状态时,若维持温度不变,向容器内通入惰性气体He,则反应2平衡______ (填“正向移动”“逆向移动”或“不移动”)。
④800K时,若平衡时容器内总压为p,则反应2的压强平衡常数Kp=_____ (结果保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压 物质的量分数)。
物质的量分数)。
(3)在酸性水溶液中,CO2通过电催化法可生成C2H5OH,c-NC、i-NC是两种电极催化剂,转化原理如图所示。
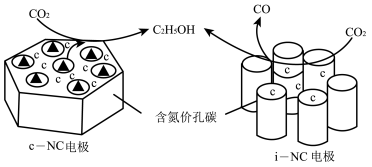
①c-NC上的电极反应式为______ 。
②当两个电极上转移相同数目的电子时,c-NC电极和i-NC电极上得到的C2H5OH的物质的量之比为5:4,则i-NC电极上产生的C2H5OH和CO的物质的量之比为______ 。
(1)工业上利用CO2和H2为原料,在催化剂Cu/ZnO的作用下合成甲醇,该反应的热化学方程式为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=-49kJ•mol-1。
CH3OH(g)+H2O(g)△H=-49kJ•mol-1。①该反应在
②该反应分两步进行:
第一步Cu/ZnO*=Cu/Zn*+H2O△H>0
第二步Cu/Zn*+2H2+CO2=Cu/ZnO*+CH3OH
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知以下能正确表示反应过程中能量变化的示意图为
a.
 b.
b. c.
c. d.
d.
(2)Sabatier反应可实现CO2甲烷化:反应1为CO2(g)+4H2(g)
 CH4(g)+2H2O(g)△H=-165kJ•mol-1,该反应发生的同时还伴随着副反应;反应2为CO2(g)+H2(g)
CH4(g)+2H2O(g)△H=-165kJ•mol-1,该反应发生的同时还伴随着副反应;反应2为CO2(g)+H2(g) CO(g)+H2O(g)△H=+41kJ•mol-1,将5molCO2和20molH2通入某恒压密闭容器中将CO2甲烷化,平衡时体系中各含碳元素物质的物质的量n(X)与温度T的关系如图所示。
CO(g)+H2O(g)△H=+41kJ•mol-1,将5molCO2和20molH2通入某恒压密闭容器中将CO2甲烷化,平衡时体系中各含碳元素物质的物质的量n(X)与温度T的关系如图所示。
①曲线Y代表的物质是
②800K时,若经过10min达到平衡,则该条件下0~10min内H2O的平均生成速率v(H2O)=
③当反应1和反应2均达到化学平衡状态时,若维持温度不变,向容器内通入惰性气体He,则反应2平衡
④800K时,若平衡时容器内总压为p,则反应2的压强平衡常数Kp=
 物质的量分数)。
物质的量分数)。(3)在酸性水溶液中,CO2通过电催化法可生成C2H5OH,c-NC、i-NC是两种电极催化剂,转化原理如图所示。

①c-NC上的电极反应式为
②当两个电极上转移相同数目的电子时,c-NC电极和i-NC电极上得到的C2H5OH的物质的量之比为5:4,则i-NC电极上产生的C2H5OH和CO的物质的量之比为
您最近一年使用:0次



