解题方法
1 . 鱼浮灵主要成分为过碳酸钠(2Na2CO3•3H2O2)是水产养殖的速效增氧剂信息:
①过碳酸钠具有Na2CO3和H2O2的双重性质,50℃开始分解
②2Na2CO3(aq)+3H2O2(aq)=2Na2CO3•3H2O2(aq)△H<0
③过碳酸钠在异丙醇中的溶解度较低
实验室用Na2CO3与稳定剂的混合液和H2O2化合制备过碳酸钠,制备装置如图。
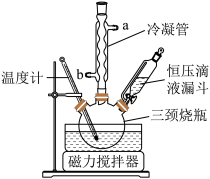
(1)冷凝管中冷凝水的进口是___ (填“a”或“b”),恒压滴液漏斗中盛装的药品是___ 。
(2)实验测定反应温度对产物的影响如表所示,根据表中数据可以得知最佳的反应温度为15—20℃,请说明选择该温度的理由是___ 。
(3)反应结束后,停止搅拌,( ),( ),( ),( ),干燥得到产品,从下列选项中选出合理的操作(操作不能重复使用)并排序___ 。
a.蒸发溶剂至100℃,冷却结晶
b.蒸发至大量晶体析出,用余热蒸干
c.加入异丙醇
d.用异丙醇溶液洗涤
e.用饱和碳酸钠溶液洗涤
f.抽滤
g.加入氯化钠晶体
h.静置
(4)过碳酸钠成分的测定:
①取适量过氧碳酸钠样品,用蒸馏水溶解后转移至250mL容量瓶中,定容,摇匀
②用移液管移取25.00mL于锥形瓶中,加入2-3滴甲基橙,用0.2000mol•L-1硫酸标准溶液滴定至终点。重复操作2-3次,记录数据。
③用移液管移取12.50mL于锥形瓶中,加入足量稀硫酸,用0.0200mol•L-1KMnO4标准溶液滴定至终点。重复操作2-3次,记录数据。
经计算发现过氧碳酸钠中碳酸钠与双氧水的比例大于2:3,引起上述结果可能的原因有___ 。
A.干燥产品时采用了加热烘干的方式
B.上述步骤②操作过程中,滴定完成后,俯视滴定管
C.上述步骤③滴定操作前润洗了滴定管和锥形瓶
D.上述步骤③滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡
(5)某小组在常温下进行H2O2在不同pH下,相同时间内溶解氧含量测定的实验,数据记录如表:
结合以上数据分析“鱼浮灵”溶于水后在水产养殖中速效增氧的原理是___ 。
①过碳酸钠具有Na2CO3和H2O2的双重性质,50℃开始分解
②2Na2CO3(aq)+3H2O2(aq)=2Na2CO3•3H2O2(aq)△H<0
③过碳酸钠在异丙醇中的溶解度较低
实验室用Na2CO3与稳定剂的混合液和H2O2化合制备过碳酸钠,制备装置如图。

(1)冷凝管中冷凝水的进口是
(2)实验测定反应温度对产物的影响如表所示,根据表中数据可以得知最佳的反应温度为15—20℃,请说明选择该温度的理由是
| t/℃ | 活性氧百分含量/% | 产率/% |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
a.蒸发溶剂至100℃,冷却结晶
b.蒸发至大量晶体析出,用余热蒸干
c.加入异丙醇
d.用异丙醇溶液洗涤
e.用饱和碳酸钠溶液洗涤
f.抽滤
g.加入氯化钠晶体
h.静置
(4)过碳酸钠成分的测定:
①取适量过氧碳酸钠样品,用蒸馏水溶解后转移至250mL容量瓶中,定容,摇匀
②用移液管移取25.00mL于锥形瓶中,加入2-3滴甲基橙,用0.2000mol•L-1硫酸标准溶液滴定至终点。重复操作2-3次,记录数据。
③用移液管移取12.50mL于锥形瓶中,加入足量稀硫酸,用0.0200mol•L-1KMnO4标准溶液滴定至终点。重复操作2-3次,记录数据。
经计算发现过氧碳酸钠中碳酸钠与双氧水的比例大于2:3,引起上述结果可能的原因有
A.干燥产品时采用了加热烘干的方式
B.上述步骤②操作过程中,滴定完成后,俯视滴定管
C.上述步骤③滴定操作前润洗了滴定管和锥形瓶
D.上述步骤③滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡
(5)某小组在常温下进行H2O2在不同pH下,相同时间内溶解氧含量测定的实验,数据记录如表:
| 试剂 | H2O2 | H2O2+NaCl | H2O2+Na2CO3 | H2O2+NaOH | H2O2+NaOH |
| pH | 6.01 | 5.97 | 8.14 | 8.15 | 9.26 |
| 溶解氧 | 6.44 | 6.48 | 9.11 | 9.12 | 10.97 |
您最近一年使用:0次
2021-04-30更新
|
343次组卷
|
3卷引用:新疆维吾尔自治区疏附县第一中学2021-2022学年高三上学期期中考试化学试题
新疆维吾尔自治区疏附县第一中学2021-2022学年高三上学期期中考试化学试题浙江省平湖市2021届高三4月适应性考试化学试题(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)
2 . 化学上常用燃烧法确定有机物的组成。这种方法是在电炉里加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。如图所列装置是用燃烧法确定有机物分子式常用的装置。
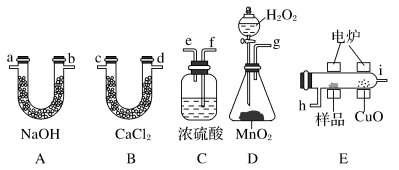
回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是__ 。
(2)C装置中浓H2SO4的作用是___ 。
(3)D装置中MnO2的作用是__ 。
(4)燃烧管中CuO的作用是___ 。
(5)若准确称取0.90g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32g,B管质量增加0.54g,则该有机物的最简式为___ 。
(6)要确定该有机物的分子式,还要___ 。

回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是
(2)C装置中浓H2SO4的作用是
(3)D装置中MnO2的作用是
(4)燃烧管中CuO的作用是
(5)若准确称取0.90g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32g,B管质量增加0.54g,则该有机物的最简式为
(6)要确定该有机物的分子式,还要
您最近一年使用:0次
2021-01-03更新
|
444次组卷
|
12卷引用:2011-2012年新疆乌鲁木齐市第八中学高一下学期期末考试化学卷
(已下线)2011-2012年新疆乌鲁木齐市第八中学高一下学期期末考试化学卷2015-2016学年辽宁大连经济技术开发区得胜高中高二下期中化学试卷2018版化学(苏教版)高考总复习专题十二课时跟踪训练--认识有机化合物【全国百强校】辽宁省鞍山市第一中学2018-2019学年高二下学期开学考试化学试题3.2有机化合物结构的测定能力提升宁夏石嘴山市第三中学2019-2020学年高二10月月考化学试题山西省朔州市怀仁县第一中学2018-2019学年高二下学期第二次月考化学试题天津市南开中学人教版高中化学选修5预习练习:第一章 第四节 研究有机化合物的一般步骤和方法 第2课时江西省南昌市新建区第二中学2020-2021学年高二上学期“新星计划”体验营10月考化学试题(已下线)1.4 研究有机化合物的一般步骤和方法(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版选修5)(已下线)1.2 研究有机化合物的一般方法(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修3)(已下线)1.2.2 确定有机化合物的实验式与分子结构-2020-2021学年高二化学课时同步练(人教版2019选择性必修3)
名校
解题方法
3 . 钻(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如图(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
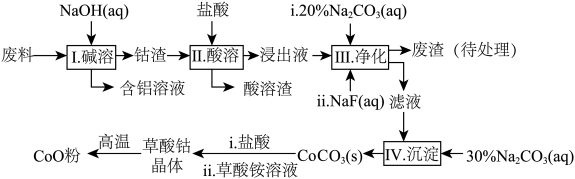
已知: LiF难溶于水,Li2CO3微溶于水。
请回答:
(1)写出I中发生反应的化学方程式并用单线桥标记电子转移的方向和数目________ 。
(2)写出步骤中Co2O3与盐酸反应生成Cl2的离子方程式_______________ 。
(3)步骤II所得废渣的主要成分除了LiF外,还有________________ 。
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤IV所起的作用是___________ 。
(5)在空气中加热10.98g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。已知:M(CoC2O4•2H2O)=183g/mol。
经测定,加热到210℃时,固体物质的化学式为_____ 。加热到210--290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是_________ 。温度高于890℃时,固体产物发生分解反应,固体产物为__________ 。

已知: LiF难溶于水,Li2CO3微溶于水。
请回答:
(1)写出I中发生反应的化学方程式并用单线桥标记电子转移的方向和数目
(2)写出步骤中Co2O3与盐酸反应生成Cl2的离子方程式
(3)步骤II所得废渣的主要成分除了LiF外,还有
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤IV所起的作用是
(5)在空气中加热10.98g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。已知:M(CoC2O4•2H2O)=183g/mol。
| 温度范围/℃ | 固体质量/g |
| 150--210 | 8.82 |
| 290--320 | 4.82 |
| 890--920 | 4.5 |
经测定,加热到210℃时,固体物质的化学式为
您最近一年使用:0次
2018-05-13更新
|
504次组卷
|
2卷引用:新疆喀什地区伽师县2022-2023学年高三上学期11月期中考试化学试题
解题方法
4 . 钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
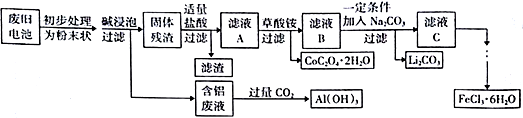
已知:①还原性:Cl->Co2+;
②Fe3+和C2O42-结合生成较稳定的[ Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是(写两点)_______________ 。
(2)从含铝废液得到Al(OH)3的离子反应方程式为__________________________________ 。
(3)滤液A中的溶质除HCl、LiCl外还有__________ (填化学式)。写出LiCoO2和盐酸反应的化学方程式__________________________________ 。
(4)滤渣的主要成分为____________________ (填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2
②固体失重率=对应温度下样品失重的质量/样品的初始质量
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为___________ mol·L-1
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是_________________________ 。

已知:①还原性:Cl->Co2+;
②Fe3+和C2O42-结合生成较稳定的[ Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是(写两点)
(2)从含铝废液得到Al(OH)3的离子反应方程式为
(3)滤液A中的溶质除HCl、LiCl外还有
(4)滤渣的主要成分为
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2
②固体失重率=对应温度下样品失重的质量/样品的初始质量
| 序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
| Ⅰ | 120-220 | CoC2O4·2H2O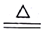 CoC2O4+2H2O CoC2O4+2H2O | 19.67% |
| Ⅱ | 300~350 | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是
您最近一年使用:0次
2018-03-24更新
|
514次组卷
|
3卷引用:新疆克拉玛依市2020届高三第三次模拟检测理综化学试题
2014高三·全国·专题练习
名校
5 . 2013年中国水周的主题是:“节约保护水资源,大力建设生态文明”.
(1)ClO2和Cl2(还原产物都为Cl﹣)是生活中常用的净水消毒剂.当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的_________ 倍.
(2)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作流程和有关现象如图所示:操作③的相关图象如图
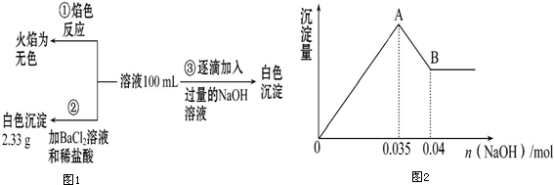
请根据上图回答下列问题:
①实验中需配制1.0mol•L﹣1的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为_______________ .
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为___________ .
③试确定NO3-是否存在?________ (填“存在”“不存在”或“不确定”),若存在,试计算c(NO3-)=_____ (若不存在,此问不必作答).
(1)ClO2和Cl2(还原产物都为Cl﹣)是生活中常用的净水消毒剂.当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的
(2)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作流程和有关现象如图所示:操作③的相关图象如图

请根据上图回答下列问题:
①实验中需配制1.0mol•L﹣1的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为
③试确定NO3-是否存在?
您最近一年使用:0次
2016-12-09更新
|
267次组卷
|
5卷引用:新疆乌什县阿克托海乡中学2019届高三年级四月调研考试理综化学试题
新疆乌什县阿克托海乡中学2019届高三年级四月调研考试理综化学试题(已下线)2014届高考化学二轮专题冲刺第3讲 离子反应氧化还原反应练习卷2016届山东省枣庄市滕州五中高三上学期期末化学试卷吉林省长春市第五中学2021届高三上学期期中考试化学试题湖北省石首市第一中学2019-2020学年高三上学期8月月考化学试题
6 . 某研究性学习小组在网上收集到信息:钠、镁等活泼金属都能在CO2气体中燃烧。
他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
[实验操作]将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质。
[提出假设]假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
[设计方案]该小组对燃烧后生成的白色物质进行如下探究:
请回答下列问题:
(1)写出金属镁与二氧化碳反应的化学方程式:________________________ 。
(2)甲同学认为方案1得到的结论不正确,其理由是____________________ 。
(3)钠在二氧化碳中燃烧的化学方程式为______________________________ 。
(4)乙同学认为白色物质有可能是氢氧化钠。你是否同意乙同学的观点,并简述理由:__________ 。
他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
[实验操作]将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质。
[提出假设]假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
[设计方案]该小组对燃烧后生成的白色物质进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液。 ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀 ②无明显现象 | 白色物质为Na2CO3 |
(1)写出金属镁与二氧化碳反应的化学方程式:
(2)甲同学认为方案1得到的结论不正确,其理由是
(3)钠在二氧化碳中燃烧的化学方程式为
(4)乙同学认为白色物质有可能是氢氧化钠。你是否同意乙同学的观点,并简述理由:
您最近一年使用:0次
2016-12-09更新
|
164次组卷
|
2卷引用:新疆维吾尔自治区阿克苏市高级中学2019届高三上学期第二次月考化学试题



