1 . 氯气(Cl2)是一种能溶于水的有毒气体,它能与水发生反应生成盐酸(HCl)和次氯酸(HClO),次氯酸(HClO) 具有漂白性,能使品红等有色物质褪色。
(1)向含有酚酞的NaOH溶液中逐滴滴入饱和氯水(氯气的水溶液),发现溶液会由红色褪成无色,请根据以上信息猜想溶液变成无色的两个可能原因(用简要文字说明);
①___________ ;
②___________ 。
(2)请设计一个简单的实验,验证(1) 中猜想:___________ 。
(3)工业制取漂白粉的原理为2Cl2+2Ca (OH)2 =CaCl2+Ca (C1O)2+2H2O, 漂白粉的有效成分是次氯酸钙Ca (ClO)2 ,它能与酸发生复分解反应生成HClO。在空气中容易吸收水和CO2发生反应:Ca (ClO) 2+CO2+H2O=CaCO3 ↓+2HClO, HClO是一种酸性比盐酸弱的酸,不稳定、易分解。
①HClO在常温下分解,发生反应:2HClO=2HCl+O2↑。某瓶HClO溶液放置一段时间后,溶液的pH会___________ (填 “增大”或“减小”或“不变”)。
②实验室有一包长时间放置的漂白粉,某同学设计了下列实验探究该漂白粉是否变质。
[提出问题]长时间放置的漂白粉是否变质?
[作出猜想]猜想1:该漂白粉未未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为___________ ;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3。
[实验探究]
[反思评价]I.有同学认为无需进行操作步骤②,只需在步骤①反应后的溶液中滴加适量品红,观察品红是否褪色即可,理由是___________ (用化学方程式表示)。
II.漂白粉在保存时一定要注意___________ 。
(1)向含有酚酞的NaOH溶液中逐滴滴入饱和氯水(氯气的水溶液),发现溶液会由红色褪成无色,请根据以上信息猜想溶液变成无色的两个可能原因(用简要文字说明);
①
②
(2)请设计一个简单的实验,验证(1) 中猜想:
(3)工业制取漂白粉的原理为2Cl2+2Ca (OH)2 =CaCl2+Ca (C1O)2+2H2O, 漂白粉的有效成分是次氯酸钙Ca (ClO)2 ,它能与酸发生复分解反应生成HClO。在空气中容易吸收水和CO2发生反应:Ca (ClO) 2+CO2+H2O=CaCO3 ↓+2HClO, HClO是一种酸性比盐酸弱的酸,不稳定、易分解。
①HClO在常温下分解,发生反应:2HClO=2HCl+O2↑。某瓶HClO溶液放置一段时间后,溶液的pH会
②实验室有一包长时间放置的漂白粉,某同学设计了下列实验探究该漂白粉是否变质。
[提出问题]长时间放置的漂白粉是否变质?
[作出猜想]猜想1:该漂白粉未未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3。
[实验探究]
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入适量 | 有气体产生,气体使石灰水变浑浊。 | 猜想2成立 |
| ②把少量样品加入水中,通入足量的CO2气体后,再滴入适量的品红溶液 |
II.漂白粉在保存时一定要注意
您最近一年使用:0次
21-22高一·全国·假期作业
2 . Na2O2是一种重要化工原料,工业上可以用来漂白纺织类物品、麦秆、纤维等。回答下列问题:
(1)Na2O2中氧元素化合价为_______ ,写出过氧化钠与水反应的化学方程式_______ 。
(2)过氧化钠若长期保存不当,容易生成_______ (填化学式),证明过氧化钠变质情况的一种实验方案如下。
(3)过氧化钠还可以作为潜艇工作人员的供氧剂,某工作人员携带10kg的过氧化钠固体进入潜艇,相当于携带标况下_______ m3空气(只需列出计算表达式,已知氧气占空气体积分数约为20%,空气的密度为1.293g/cm3)。
(1)Na2O2中氧元素化合价为
(2)过氧化钠若长期保存不当,容易生成
| 操作 | 现象 | 结论 |
| 取少量样品于试管中,加水溶解,加入 | 有白色沉淀生成 | |
| 另取少量样品于试管中,再加入适量的水,用带火星的木条靠近管口 | 带火星的木条复燃 |
(3)过氧化钠还可以作为潜艇工作人员的供氧剂,某工作人员携带10kg的过氧化钠固体进入潜艇,相当于携带标况下
您最近一年使用:0次
3 . 氯化亚铜(CuCl)广泛用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿空气中易变质。学习小组开展了与CuCl相关的系列实验,回答下列问题:
I.利用废铜屑制备CuCl2,实验装置如图所示。
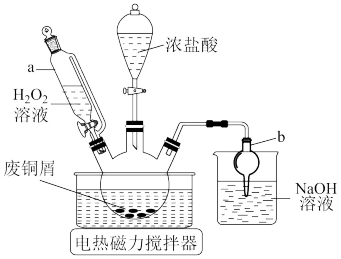
(1)仪器a的名称为___ 。仪器b的作用是___ 。
(2)三颈烧瓶中制备CuCl2的化学方程式为___ 。
II.制备氯化亚铜,制备流程如图所示:
CuCl2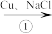 Na[CuCl2]
Na[CuCl2]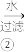 CuCl粗产品
CuCl粗产品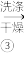 CuCl
CuCl
(3)反应①中氧化剂为___ (填化学式)。
(4)Na[CuCl2]溶液中存在的平衡是___ (用离子方程式表示)。
(5)析出的CuCl粗产品不用盐酸而用水、乙醇分别洗涤的目的依次是___ 、___ 。
(6)测定产品中CuCl的质量分数。准确称取制备的CuCl产品0.40g,加入足量的氯化铁溶液,待样品全部溶解后,加入适量稀硫酸,用0.15 mol·L-1的Ce(SO4)2标准溶液滴定至终点,消耗Ce(SO4)2溶液24.00 mL,反应中Ce4+被还原为Ce3+。硫酸铈标准溶液应盛放在___ (填“酸式”或“碱式”)滴定管中。产品中CuCl的质量分数为___ 。
I.利用废铜屑制备CuCl2,实验装置如图所示。

(1)仪器a的名称为
(2)三颈烧瓶中制备CuCl2的化学方程式为
II.制备氯化亚铜,制备流程如图所示:
CuCl2
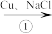 Na[CuCl2]
Na[CuCl2] CuCl粗产品
CuCl粗产品 CuCl
CuCl(3)反应①中氧化剂为
(4)Na[CuCl2]溶液中存在的平衡是
(5)析出的CuCl粗产品不用盐酸而用水、乙醇分别洗涤的目的依次是
(6)测定产品中CuCl的质量分数。准确称取制备的CuCl产品0.40g,加入足量的氯化铁溶液,待样品全部溶解后,加入适量稀硫酸,用0.15 mol·L-1的Ce(SO4)2标准溶液滴定至终点,消耗Ce(SO4)2溶液24.00 mL,反应中Ce4+被还原为Ce3+。硫酸铈标准溶液应盛放在
您最近一年使用:0次
2022-01-08更新
|
274次组卷
|
3卷引用:河北省名校联盟2021-2022学年高三上学期一轮复习考试化学试题
解题方法
4 . 过氧化锶(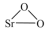 )广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
)广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
(1)实验室利用锶单质制备过氧化锶可能用到的仪器如图:

①按气流从左到右的流向,制备过氧化锶的导管接口顺序为a→____ (选择必要的仪器,可重复选择)。
②SrO2在空气中会变质生成碳酸盐,写出该反应的化学方程式____ 。
(2)通入氨气的条件下,在水溶液中可制备得到SrO2·8H2O,实验装置如图:
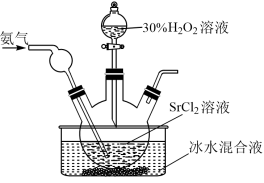
①盛装H2O2溶液的仪器名称为____ 。
②写出该方法制备SrO2·8H2O的离子方程式____ ,NH3的作用是___ 。
③冰水浴的原因是___ 。
(3)为测定SrO2·8H2O样品的纯度,可进行下列实验:准确称取3.0gSrO2·8H2O置于锥形瓶中,加入适量的盐酸充分溶解;加入过量KI溶液,摇匀后置于暗处;充分反应后加入少量淀粉溶液,用1.000mol·L-1Na2S2O3标准溶液滴定至____ (写出实验现象),记下此时消耗标准溶液的体积,重复实验3~4次,得如表数据:
SrO2·8H2O样品的纯度为____ (已知:I2+2S2O =2I-+S4O
=2I-+S4O )
)
 )广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
)广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。(1)实验室利用锶单质制备过氧化锶可能用到的仪器如图:

①按气流从左到右的流向,制备过氧化锶的导管接口顺序为a→
②SrO2在空气中会变质生成碳酸盐,写出该反应的化学方程式
(2)通入氨气的条件下,在水溶液中可制备得到SrO2·8H2O,实验装置如图:

①盛装H2O2溶液的仪器名称为
②写出该方法制备SrO2·8H2O的离子方程式
③冰水浴的原因是
(3)为测定SrO2·8H2O样品的纯度,可进行下列实验:准确称取3.0gSrO2·8H2O置于锥形瓶中,加入适量的盐酸充分溶解;加入过量KI溶液,摇匀后置于暗处;充分反应后加入少量淀粉溶液,用1.000mol·L-1Na2S2O3标准溶液滴定至
| 平行实验 | 1 | 2 | 3 | 4 |
| 消耗标准溶液体积(mL) | 19.98 | 19.50 | 20.00 | 20.02 |
 =2I-+S4O
=2I-+S4O )
)
您最近一年使用:0次
名校
解题方法
5 . 比亚迪推出了基于磷酸亚铁锂技术的“刀片电池”,该电池能量密度大,安全性高。生产“刀片电池”需要用到FeSO4,某工业废料中主要含Fe2O3、Al2O3、SiO2 (其他成分与酸碱都不反应),某同学设计如下工艺流程从工业废料中回收绿矾

请回答:
(1)“碱浸”过程中,将工业废料粉碎的目的是___________ (写出一种)。
(2)“碱浸”时发生的离子方程式为___________ 。
(3)“提纯操作1”制取绿矾晶体需先加入少量稀硫酸,再经过___________ 、冷却结晶、过滤、洗涤、干燥。
(4)某同学为了验证某久置的FeSO4溶液是否变质,取少量待测液于试管中,加入2滴___________ 溶液,若观察到___________ ,则证明该溶液已经变质。
(5)称取1.390 0 g新制绿矾样品,以稀硫酸酸化,用0.040 0 mol·L-1的KMnO4标准液滴定至终点,消耗KMnO4标准液24.00 mL。该滴定反应的离子方程式为___________ ,取样样品的纯度为___________ (已知FeSO4·7H2O的摩尔质量为278 g·mol-1)。

请回答:
(1)“碱浸”过程中,将工业废料粉碎的目的是
(2)“碱浸”时发生的离子方程式为
(3)“提纯操作1”制取绿矾晶体需先加入少量稀硫酸,再经过
(4)某同学为了验证某久置的FeSO4溶液是否变质,取少量待测液于试管中,加入2滴
(5)称取1.390 0 g新制绿矾样品,以稀硫酸酸化,用0.040 0 mol·L-1的KMnO4标准液滴定至终点,消耗KMnO4标准液24.00 mL。该滴定反应的离子方程式为
您最近一年使用:0次
2022-03-08更新
|
233次组卷
|
4卷引用:湖北省新高考联考协作体2021-2022学年高一下学期3月考试化学试题
解题方法
6 . 过氧化钠因吸收空气里的二氧化碳和水而变质,某兴趣小组对久置的过氧化钠样品M进行实验探究。
实验Ⅰ:甲同学设计下图所示装置探究样品M的变质情况。
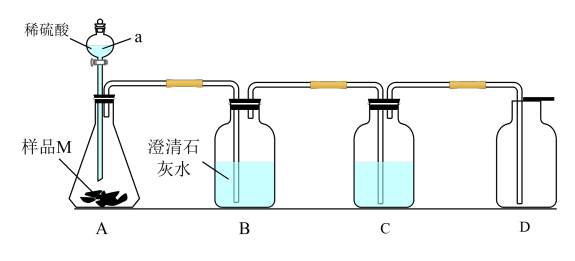
(1)仪器a的名称是_______ 。
(2)装置C中的溶液是_______ ,其作用是_______ 。
(3)如果装置B中出现浑浊,D中收集到的气体能使带火星的木条复燃,则样品M的变质情况为_______ 。
实验Ⅱ:乙同学用氯化钡溶液作为检验试剂进行实验。
(4)根据产生白色沉淀,乙同学认为样品M已变质,该反应的离子方程式为_______ 。
资料显示, 能与
能与 、NaOH溶液反应生成白色不溶物
、NaOH溶液反应生成白色不溶物 。据此,丙同学对乙同学的检验结果提出质疑并进行实验。
。据此,丙同学对乙同学的检验结果提出质疑并进行实验。
实验Ⅲ:取少量纯净的过氧化钠固体溶于蒸馏水,先加入过量稀硫酸,再滴入 溶液。实验证明
溶液。实验证明 与水反应有
与水反应有 生成。
生成。
(5)滴入 溶液后观察到的现象是
溶液后观察到的现象是_______ ,此反应的离子方程式为_______ 。
丙同学利用如图装置进行实验,排除了 的干扰。
的干扰。
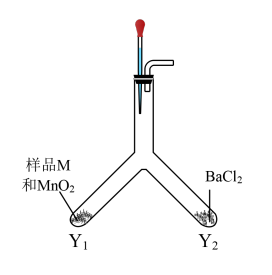
实验Ⅳ:往Y型管中加入相应药品,塞紧橡胶塞,滴入蒸馏水……产生白色沉淀,说明样品M已变质。
(6)请补充完整上述实验的操作过程:_______ 。
实验Ⅰ:甲同学设计下图所示装置探究样品M的变质情况。

(1)仪器a的名称是
(2)装置C中的溶液是
(3)如果装置B中出现浑浊,D中收集到的气体能使带火星的木条复燃,则样品M的变质情况为
实验Ⅱ:乙同学用氯化钡溶液作为检验试剂进行实验。
(4)根据产生白色沉淀,乙同学认为样品M已变质,该反应的离子方程式为
资料显示,
 能与
能与 、NaOH溶液反应生成白色不溶物
、NaOH溶液反应生成白色不溶物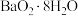 。据此,丙同学对乙同学的检验结果提出质疑并进行实验。
。据此,丙同学对乙同学的检验结果提出质疑并进行实验。实验Ⅲ:取少量纯净的过氧化钠固体溶于蒸馏水,先加入过量稀硫酸,再滴入
 溶液。实验证明
溶液。实验证明 与水反应有
与水反应有 生成。
生成。(5)滴入
 溶液后观察到的现象是
溶液后观察到的现象是丙同学利用如图装置进行实验,排除了
 的干扰。
的干扰。
实验Ⅳ:往Y型管中加入相应药品,塞紧橡胶塞,滴入蒸馏水……产生白色沉淀,说明样品M已变质。
(6)请补充完整上述实验的操作过程:
您最近一年使用:0次
名校
7 . 某FeSO4在空气中久置发生了部分变质,为测定该样品的纯度,进行如下分析:
(1)准确移取25.00 mL 0.05000 mol·L-1的草酸钠水溶液,放入锥形瓶中,加入25 mL蒸馏水和5mL6 mol·L-1的H2SO4溶液,微热至60~70°C,用KMnO4溶液滴定,消耗27.75mL。写出滴定过程发生的反应的离子方程式_______ ;达到滴定终点的现象是_______ ;计算KMnO4溶液的浓度为_______ (保留2位有效数字)
(2)准确称取mg样品,放入锥形瓶中,加入25 mL蒸馏水和5mL6 mol·L-1的H2SO4溶液,微热至60~70°C,用上述KMnO4溶液滴定,消耗12.75 mL。则该样品中FeSO4的质量分数为_______ (用含m的式子表示)。
(3)测定样品纯度的过程中,下列操作会引起所测FeSO4的质量分数偏低的是_______ 。
A.称取mg样品放入锥形瓶中,加入25 mL蒸馏水溶解时搅拌时间过长
B.上述(2)步骤中,用KMnO4溶液滴定达终点读数时俯视
C.上述(2)步骤中,所用的锥形瓶不干燥
(1)准确移取25.00 mL 0.05000 mol·L-1的草酸钠水溶液,放入锥形瓶中,加入25 mL蒸馏水和5mL6 mol·L-1的H2SO4溶液,微热至60~70°C,用KMnO4溶液滴定,消耗27.75mL。写出滴定过程发生的反应的离子方程式
(2)准确称取mg样品,放入锥形瓶中,加入25 mL蒸馏水和5mL6 mol·L-1的H2SO4溶液,微热至60~70°C,用上述KMnO4溶液滴定,消耗12.75 mL。则该样品中FeSO4的质量分数为
(3)测定样品纯度的过程中,下列操作会引起所测FeSO4的质量分数偏低的是
A.称取mg样品放入锥形瓶中,加入25 mL蒸馏水溶解时搅拌时间过长
B.上述(2)步骤中,用KMnO4溶液滴定达终点读数时俯视
C.上述(2)步骤中,所用的锥形瓶不干燥
您最近一年使用:0次
解题方法
8 . 化学小组欲测定一份长期放置的补铁药品(有效成分是琥珀酸亚铁,化学式为FeC4H4O4)是否已变质,实验如下:
Ⅰ.取补铁药样品10.00g,碾碎,溶于100.0mL稀盐酸中,过滤,滤液呈浅黄绿色。
Ⅱ.取少量滤液,滴加KSCN溶液,溶液变为浅红色;再滴入3滴H2O2溶液,溶液红色加深。
Ⅲ.准确量取Ⅰ中滤液20.00mL,加入足量H2O2溶液,再加入足量NaOH溶液,过滤、洗涤、常温晾干,获得Fe(OH)3固体0.642g。
Ⅳ.再准确量取Ⅰ中滤液20.00mL于大试管中,加入1.00g铜粉,用胶塞塞紧试管口,充分振荡后过滤,最后得到干燥的铜粉0.936g。
(1)Ⅰ中琥珀酸亚铁与稀盐酸反应生成FeCl2和琥珀酸(分子式为C4H6O4),说明酸性:C4H6O4___________ HCl(填“>”或“<”)。
(2)用离子方程式解释Ⅱ中实验现象产生的原因:___________ 、Fe3++3SCN−=Fe(SCN)3。
(3)Ⅳ中发生反应的离子方程式是___________ 。
(4)该补铁药中琥珀酸亚铁变质程度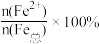 =
=___________ 。
(5)Ⅳ中溶液与铜粉反应时必须使用胶塞塞紧试管口,原因是___________ 。
Ⅰ.取补铁药样品10.00g,碾碎,溶于100.0mL稀盐酸中,过滤,滤液呈浅黄绿色。
Ⅱ.取少量滤液,滴加KSCN溶液,溶液变为浅红色;再滴入3滴H2O2溶液,溶液红色加深。
Ⅲ.准确量取Ⅰ中滤液20.00mL,加入足量H2O2溶液,再加入足量NaOH溶液,过滤、洗涤、常温晾干,获得Fe(OH)3固体0.642g。
Ⅳ.再准确量取Ⅰ中滤液20.00mL于大试管中,加入1.00g铜粉,用胶塞塞紧试管口,充分振荡后过滤,最后得到干燥的铜粉0.936g。
(1)Ⅰ中琥珀酸亚铁与稀盐酸反应生成FeCl2和琥珀酸(分子式为C4H6O4),说明酸性:C4H6O4
(2)用离子方程式解释Ⅱ中实验现象产生的原因:
(3)Ⅳ中发生反应的离子方程式是
(4)该补铁药中琥珀酸亚铁变质程度
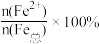 =
=(5)Ⅳ中溶液与铜粉反应时必须使用胶塞塞紧试管口,原因是
您最近一年使用:0次
解题方法
9 . 氨基甲酸铵是一种白色固体,易分解、易水解,难溶于CCl4,主要用作磷化铝中间体,也用于医药。传统制备氨基甲酸铵的装置如图1所示,其反应的化学方程式如下:
2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0。
NH2COONH4(s) ΔH<0。
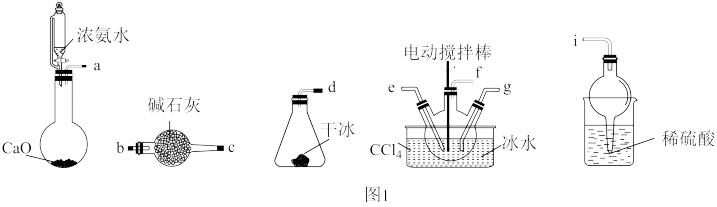
(1)请按气流方向连接各仪器接口,补充完整:a→_____ ,____ →e f g←d;_____ →____ 。
(2)三颈烧瓶需用冰水浴的原因是_____ 。当CCl4液体中产生较多晶体悬浮物时即停止反应,从反应后的混合物中分离出产品的实验方法是_____ (填写操作名称)。为了得到干燥产品,应采取的方法是_____ (填序号)。
A.蒸馏 B.常压加热 C.高压加热 D.减压微热
(3)欲使原料气体按反应计量系数充分反应,若反应初期观察到装置内稀硫酸溶液中产生气泡,应该采取的措施是:______ 。
(4)对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有:____ 。
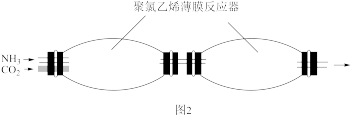
(5)实验中发现用玻璃仪器做反应器,内壁容易形成致密坚硬、粘附能力强的产物结晶体。研究小组改用聚氯乙烯薄膜材料的反应器(如图2所示),其优点是____ 。
(6)氨基甲酸铵变质后会转化为碳酸氢铵。取3.910g变质后的样品,加入足量澄清石灰水,使样品中碳元素全部转化为碳酸钙,过滤、洗涤、干燥得到沉淀5.000g。则该样品的纯度为____ (计算结果保留3位有效数字)。
2NH3(g)+CO2(g)
 NH2COONH4(s) ΔH<0。
NH2COONH4(s) ΔH<0。
(1)请按气流方向连接各仪器接口,补充完整:a→
(2)三颈烧瓶需用冰水浴的原因是
A.蒸馏 B.常压加热 C.高压加热 D.减压微热
(3)欲使原料气体按反应计量系数充分反应,若反应初期观察到装置内稀硫酸溶液中产生气泡,应该采取的措施是:
(4)对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有:
(5)实验中发现用玻璃仪器做反应器,内壁容易形成致密坚硬、粘附能力强的产物结晶体。研究小组改用聚氯乙烯薄膜材料的反应器(如图2所示),其优点是

(6)氨基甲酸铵变质后会转化为碳酸氢铵。取3.910g变质后的样品,加入足量澄清石灰水,使样品中碳元素全部转化为碳酸钙,过滤、洗涤、干燥得到沉淀5.000g。则该样品的纯度为
您最近一年使用:0次
10 . 某研究小组根据文献模拟利用氨浸法从某钢铁厂烟灰(主要成分为ZnO,并含有少量的CuO、Fe2O3等)中制备碱式碳酸锌,并测定其组成的流程如下:
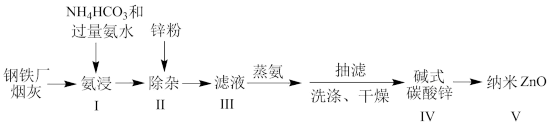
已知:a、碱式碳酸锌白色粉末,难溶于水和乙醇,微溶于氨;
纳米氧化锌具有极强的吸附性,空气中久置容易变质。
b、ZnO+2NH3+2 →Zn(NH3)
→Zn(NH3) +H2O
+H2O
Zn(NH3) →Zn2++4NH3
→Zn2++4NH3
Zn2++2OH-→Zn(OH)2↓
Zn2++ →ZnCO3↓
→ZnCO3↓
(1)“氨浸”时加入过量氨水的目的:
①使HCO 转化为
转化为 :
:
②_______ 。
(2)下列说法不正确的是_______。
(3)I、该研究小组利用步骤V对碱式碳酸锌[Zn3(OH)m(CO3)n(其中m。n为整数)]组成进行测定,从下列选项中选出合理的操作并排序:坩埚预处理后将样品放入坩埚中称量,再置于高温炉中加热→_______→_______→_______→_______→_______。_______
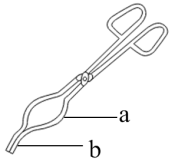
①放在石棉网上
②放在干燥器中
③冷却至室温
④用如图坩埚钳a处夹取坩埚
⑤用如图坩埚钳b处夹取坩埚⑥放入电子天平中称量
⑦重复以上操作,确认最后两次称量值差≦0.001g
II、电子天平记录的部分数据如下表所示
①根据数据计算该碱式碳酸锌的化学式_______ 。
②写出蒸氨步骤制得该碱式碳酸锌的离子方程式_______ 。

已知:a、碱式碳酸锌白色粉末,难溶于水和乙醇,微溶于氨;
纳米氧化锌具有极强的吸附性,空气中久置容易变质。
b、ZnO+2NH3+2
 →Zn(NH3)
→Zn(NH3) +H2O
+H2OZn(NH3)
 →Zn2++4NH3
→Zn2++4NH3Zn2++2OH-→Zn(OH)2↓
Zn2++
 →ZnCO3↓
→ZnCO3↓(1)“氨浸”时加入过量氨水的目的:
①使HCO
 转化为
转化为 :
:②
(2)下列说法不正确的是_______。
| A.步骤I可以采用加热方式来加快浸出速率,提高浸出量 |
| B.步骤II过滤得到的滤渣中含有Cu、Fe、Zn |
| C.步骤III蒸氨过程产生气体除了氨气还有CO2,冷凝后得到的碳化氨水循环用于氨浸 |
| D.步骤IV洗涤时可先用浓氨水洗涤,减少固体溶解,再用无水乙醇洗涤 |

①放在石棉网上
②放在干燥器中
③冷却至室温
④用如图坩埚钳a处夹取坩埚
⑤用如图坩埚钳b处夹取坩埚⑥放入电子天平中称量
⑦重复以上操作,确认最后两次称量值差≦0.001g
II、电子天平记录的部分数据如下表所示
| 电子天平视数/g | |
| 空坩埚 | 19.2500 |
| 空坩埚+样品 | 25.7100 |
| 第一次灼烧后称量 | 24.3251 |
| 第二次灼烧后称量 | 24.1414 |
| 第三次灼烧后称量 | 24.1101 |
| 第四次灼烧后称量 | 24.1100 |
| 第五次灼烧后称量 | 24.1099 |
②写出蒸氨步骤制得该碱式碳酸锌的离子方程式
您最近一年使用:0次
2021-09-17更新
|
712次组卷
|
4卷引用:浙江省名校新高考研究联盟(Z20联盟)2022届高三上学期第一次联考化学试题
浙江省名校新高考研究联盟(Z20联盟)2022届高三上学期第一次联考化学试题2021年湖北高考化学试题变式题11-192020年全国卷Ⅰ理综化学高考真题变式题(已下线)解密13 实验化学(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)



