2010·上海宝山·二模
解题方法
1 . vmL密度为 g/cm3的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶质的质量分数为W%,物质的量浓度为cmol/L,那么下列关系式正确的是
g/cm3的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶质的质量分数为W%,物质的量浓度为cmol/L,那么下列关系式正确的是
 g/cm3的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶质的质量分数为W%,物质的量浓度为cmol/L,那么下列关系式正确的是
g/cm3的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶质的质量分数为W%,物质的量浓度为cmol/L,那么下列关系式正确的是A.c= | B.c=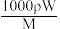 | C.W%=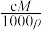 | D.m=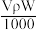 |
您最近一年使用:0次
2010·上海奉贤·二模
解题方法
2 . 20℃时有a g硫酸铜溶液V mL,将溶液蒸发掉b g水后恢复到20℃,恰好全部生成硫酸铜晶体(CuSO4·5H2O),则下列关系式错误的是( )
A.原硫酸铜溶液的密度为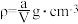 |
B.生成硫酸铜晶体的物质的量为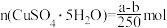 |
C.原硫酸铜溶液的物质的量浓度为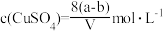 |
D.原硫酸铜溶液的质量分数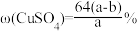 |
您最近一年使用:0次
2011·上海·零模
3 . 若NA表示阿伏加 德罗常数,下列说法正确的是( )
| A.1 mol Cl2作为氧化剂得到的电子数为NA |
| B.25℃时,l L pH=13的Ba(OH)2 溶液中含有Ba2+的数目为0.1 NA |
| C.在0℃,101kPa时,22.4L氢气中含有NA个氢原子 |
| D.在标准状况下,22.4L空气中约有NA个气体分子 |
您最近一年使用:0次
2011·上海普陀·零模
4 . 某一元弱酸HX的相对分子质量为M,t℃时,将ag HX溶解于一定量的水中恰好形成饱和溶液VmL,其密度为dg/cm3,其中n(X-)=bmol。关于该溶液的说法错误的是
A.溶液中c(H+)-c(OH-)= mol/L mol/L |
B.物质的量浓度c(HX)=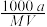 mol/L mol/L |
C.t℃时,溶液中由水电离产生的c(H+) = 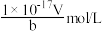 |
D.该温度下饱和溶液中HX的质量分数w% =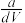 ×100% ×100% |
您最近一年使用:0次
2012·上海杨浦·二模
解题方法
5 . (1)某KClO3和KCl的混合物,钾的质量分数为43.09%,则氧的质量分数为_______ %(保留2位小数)。
(2)取KClO3和MnO2的混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g (25℃),再加5 g水充分溶解,仍剩余固体4.80g(25℃)。
①若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为_____ g(保留2位小数)。
②若剩余的4.80g固体是MnO2和KCl的混合物,则25℃时KCl的溶解度为__________ ;原混合物中KClO3的质量为__________ g;所得KCl溶液的密度为1.72g/cm3,则溶液的物质的量浓度为______ mol/L(保留2位小数)。
(3)可用以下反应制备KIO3和K2H3IO6(高碘酸氢二钾):
I2+2KClO3→2KIO3+Cl2 ① KIO3+Cl2+3KOH →K2H3IO6+2KCl ②
最终制得的KIO3和K2H3IO6 的物质的量之比x,若制得100molK2H3IO6, 共消耗ymol KClO3,试确定y与x的关系式_______________ 。
(4)取研细的KClO3、I2各0.02mol置于锥形瓶中,在不断摇动的情况下,慢慢加入浓盐酸,直到I2完全消失,没有黄绿色气体产生。将锥形瓶置于冰水中,有橙红色晶体A析出,剩余溶液中只检出K+和Cl-。取少量A放入试管中,发现A在常温下就会有升华现象。若将A水浴加热,产生红棕色液体B和黄绿色气体。
①试确定A的化学式。__________
②能否确定B的化学式?说明理由。__________
(2)取KClO3和MnO2的混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g (25℃),再加5 g水充分溶解,仍剩余固体4.80g(25℃)。
①若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为
②若剩余的4.80g固体是MnO2和KCl的混合物,则25℃时KCl的溶解度为
(3)可用以下反应制备KIO3和K2H3IO6(高碘酸氢二钾):
I2+2KClO3→2KIO3+Cl2 ① KIO3+Cl2+3KOH →K2H3IO6+2KCl ②
最终制得的KIO3和K2H3IO6 的物质的量之比x,若制得100molK2H3IO6, 共消耗ymol KClO3,试确定y与x的关系式
(4)取研细的KClO3、I2各0.02mol置于锥形瓶中,在不断摇动的情况下,慢慢加入浓盐酸,直到I2完全消失,没有黄绿色气体产生。将锥形瓶置于冰水中,有橙红色晶体A析出,剩余溶液中只检出K+和Cl-。取少量A放入试管中,发现A在常温下就会有升华现象。若将A水浴加热,产生红棕色液体B和黄绿色气体。
①试确定A的化学式。
②能否确定B的化学式?说明理由。
您最近一年使用:0次
2012·上海松江·三模
6 . 在100克水中溶解了22.4LHCl(标准状况下)气体后形成的溶液,对该溶液的判断正确的是
| A.所得的溶液的体积为22.5L |
| B.该溶液物质的量浓度为10.00mol·L−1 |
| C.根据题中数据,无法求得该溶液物质的量的浓度 |
| D.该溶液中溶质的质量百分比浓度因溶液的密度未知而无法求得 |
您最近一年使用:0次
12-13高三上·上海虹口·阶段练习
解题方法
7 . 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
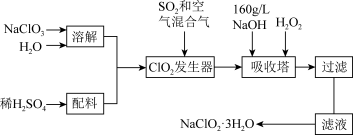
已知:① 纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全;
② NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
(1)ClO2发生器中鼓入空气的作用可能是_________ (填序号)。
a 将SO2氧化成SO3,增强酸性 b 稀释ClO2以防止爆炸 c 将NaClO3氧化成ClO2
(2)160 g/L NaOH溶液的物质的量浓度为_________ 。若要计算该溶液的质量分数,还需要的一个条件是______ (用文字说明)。
(3)吸收塔内的反应的化学方程式为__________ 。吸收塔的温度不能超过20℃,其目的是______ 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是_______ 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是_________ (填序号)。
a Na2O2 b Na2S c FeCl2 d PbO(悬浊液)
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是_________ (填序号)。
a 蒸馏 b 蒸发 c 灼烧 d 过滤 e 冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是__________________ (填操作名称)。

已知:① 纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全;
② NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
(1)ClO2发生器中鼓入空气的作用可能是
a 将SO2氧化成SO3,增强酸性 b 稀释ClO2以防止爆炸 c 将NaClO3氧化成ClO2
(2)160 g/L NaOH溶液的物质的量浓度为
(3)吸收塔内的反应的化学方程式为
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是
a Na2O2 b Na2S c FeCl2 d PbO(悬浊液)
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是
a 蒸馏 b 蒸发 c 灼烧 d 过滤 e 冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是
您最近一年使用:0次
2013·上海·零模
名校
解题方法
8 . 将a mol金属钠和b mol金属铝(a>b)一同投入m g足量水中,钠、铝均完全溶解,所得溶液密度为d g/cm3,下列式子中错误的是
| A.NaOH的物质的量:(a-b) mol |
B.NaAlO2的物质的量浓度: mol/L mol/L |
C.标况下生成H2的体积: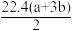 L L |
| D.参加反应的水的质量:18(a+1.5b)g |
您最近一年使用:0次
2020-03-29更新
|
146次组卷
|
3卷引用:上海市六校2013届高三3月模拟考试化学试题
(已下线)上海市六校2013届高三3月模拟考试化学试题河南省安阳市第一中学2019-2020学年高一上学期期末考试化学试题福建省厦门内厝中学2021-2022学年高一上学期(10月)第一次月考化学试题
2013·上海闵行·二模
9 . 开展“三废”综合治理,是防治工业“三废”污染,搞好环境保护的重要途径之一。其中常用方法是将“三废”中有毒有害物转化为无害的物质或有用的产品。
(1)硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还原处理。其主要反应原理:4NO + 4NH3 + O2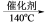 4N2 + 6H2O 6NO2 + 8NH3
4N2 + 6H2O 6NO2 + 8NH3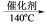 7N2 + 12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
7N2 + 12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
①氨氧混合气的平均相对分子质量为_______ (精确到0.01)。
②尾气中NO的含量为_______ mg/m3。
③要处理5m3的尾气,需要氨氧混合气的体积为_______ L。
(2)另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25% NaOH溶液(密度1.28g/cm3)完全吸收。
①NaOH溶液的物质的量浓度为_______ mol/L,体积为__________ mL。
②已知反应后溶液中含有0.35mol NaNO2。若将尾气中NO与NO2的平均组成记为NOx,则x=_________ 。
(3)硫酸工业的废水中含质量分数4.9%的硫酸,加入质量分数22.2%的石灰乳,恰好使废水达到排放标准(pH=7),同时又得到副产品石膏(CaSO4·2H2O)。已知按此法处理后每小时可排放达标废水276.5吨,求每小时生产石膏的质量(忽略其他反应且不计过程中损耗)。_____________
(1)硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还原处理。其主要反应原理:4NO + 4NH3 + O2
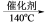 4N2 + 6H2O 6NO2 + 8NH3
4N2 + 6H2O 6NO2 + 8NH3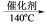 7N2 + 12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
7N2 + 12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。①氨氧混合气的平均相对分子质量为
②尾气中NO的含量为
③要处理5m3的尾气,需要氨氧混合气的体积为
(2)另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25% NaOH溶液(密度1.28g/cm3)完全吸收。
①NaOH溶液的物质的量浓度为
②已知反应后溶液中含有0.35mol NaNO2。若将尾气中NO与NO2的平均组成记为NOx,则x=
(3)硫酸工业的废水中含质量分数4.9%的硫酸,加入质量分数22.2%的石灰乳,恰好使废水达到排放标准(pH=7),同时又得到副产品石膏(CaSO4·2H2O)。已知按此法处理后每小时可排放达标废水276.5吨,求每小时生产石膏的质量(忽略其他反应且不计过程中损耗)。
您最近一年使用:0次
10 . 现有1950g发烟硫酸(用aSO3•H2O表示),SO3和H2SO4的质量分数分别为0.3和0.7,加bg水稀释成某浓度的硫酸(用H2SO4•H2O表示),则以下正确的是( )(允许最后一位数字不同)
| A.a=1.38 | B.a=1.53 | C.b=174 | D.b=165 |
您最近一年使用:0次



