名校
1 . 将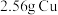 投入
投入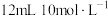 硝酸中,恰好完全反应,向反应后的溶液中加入
硝酸中,恰好完全反应,向反应后的溶液中加入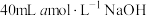 溶液,
溶液, 恰好完全沉淀,将生成的气体与
恰好完全沉淀,将生成的气体与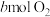 一起通入足量
一起通入足量 溶液中,气体恰好被完全吸收生成
溶液中,气体恰好被完全吸收生成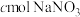 。下列判断正确的是
。下列判断正确的是
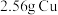 投入
投入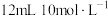 硝酸中,恰好完全反应,向反应后的溶液中加入
硝酸中,恰好完全反应,向反应后的溶液中加入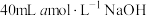 溶液,
溶液, 恰好完全沉淀,将生成的气体与
恰好完全沉淀,将生成的气体与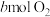 一起通入足量
一起通入足量 溶液中,气体恰好被完全吸收生成
溶液中,气体恰好被完全吸收生成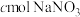 。下列判断正确的是
。下列判断正确的是| A.生成的气体中只有NO | B. |
C. | D.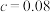 |
您最近一年使用:0次
解题方法
2 . 铬酰氯( )常作有机合成的氯化剂。它的部分性质如下表所示:
)常作有机合成的氯化剂。它的部分性质如下表所示:
某小组设计如图装置利用 和HCl迅速反应制备铬酰氯。
和HCl迅速反应制备铬酰氯。
(1)装浓盐酸的仪器名称是___________ ,B装置作用是___________ 。
(2)A中可能看到的现象是___________ ,利用浓硫酸的性质是___________ 。
(3)C中反应的化学方程式是___________ 。
(4)有人认为,E装置可以用盛装NaOH溶液的洗气瓶替代,是否合理:___________ (填“是”或“否”),请解释原因:___________ 。
(5)利用如图装置测定铬酰氯中氯元素含量(杂质不参与反应)。 溶液,过滤,用稀硝酸酸化滤液,再加入
溶液,过滤,用稀硝酸酸化滤液,再加入 溶液,最后用
溶液,最后用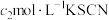 溶液滴定过量的
溶液滴定过量的 ,消耗溶液
,消耗溶液 。
。
该样品中氯元素质量分数为___________ 。如果滴定管没有润洗,测得结果会___________ (填“偏高”“偏低”或“无影响”)。
已知:常温下, ,
,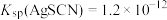 ,
,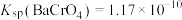 。
。
 )常作有机合成的氯化剂。它的部分性质如下表所示:
)常作有机合成的氯化剂。它的部分性质如下表所示:| 物理性质 | 化学性质 |
| 熔点:-96.5℃,沸点:117℃ | 放置在空气中会迅速挥发并水解 |
 和HCl迅速反应制备铬酰氯。
和HCl迅速反应制备铬酰氯。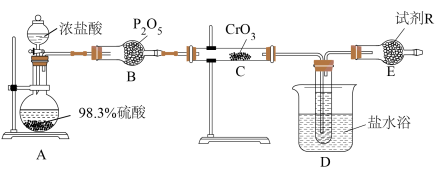
(1)装浓盐酸的仪器名称是
(2)A中可能看到的现象是
(3)C中反应的化学方程式是
(4)有人认为,E装置可以用盛装NaOH溶液的洗气瓶替代,是否合理:
(5)利用如图装置测定铬酰氯中氯元素含量(杂质不参与反应)。
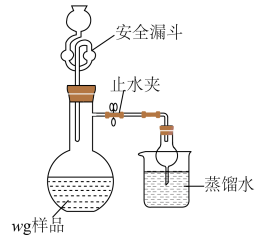
 溶液,过滤,用稀硝酸酸化滤液,再加入
溶液,过滤,用稀硝酸酸化滤液,再加入 溶液,最后用
溶液,最后用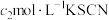 溶液滴定过量的
溶液滴定过量的 ,消耗溶液
,消耗溶液 。
。该样品中氯元素质量分数为
已知:常温下,
 ,
,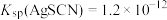 ,
,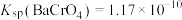 。
。
您最近一年使用:0次
解题方法
3 . 纳米银胶体能有效杀死病毒,利用硝酸银溶液与硼氢化钠溶液共热反应制备纳米银胶体的化学方程式为 。下列有关该反应的说法不正确的是
。下列有关该反应的说法不正确的是
 。下列有关该反应的说法不正确的是
。下列有关该反应的说法不正确的是| A.纳米银胶体能产生丁达尔效应 |
B. 的酸性大于 的酸性大于 |
C. 作还原剂 作还原剂 |
| D.反应生成1.12L气体时,转移电子的物质的量为0.1mol |
您最近一年使用:0次
名校
4 . 设 为阿伏加德罗常数,现向
为阿伏加德罗常数,现向 的
的 溶液中通入一定量的
溶液中通入一定量的 ,使溶液的紫色恰好褪尽,若反应前后溶液的体积不变,则下列说法不正确的是
,使溶液的紫色恰好褪尽,若反应前后溶液的体积不变,则下列说法不正确的是
 为阿伏加德罗常数,现向
为阿伏加德罗常数,现向 的
的 溶液中通入一定量的
溶液中通入一定量的 ,使溶液的紫色恰好褪尽,若反应前后溶液的体积不变,则下列说法不正确的是
,使溶液的紫色恰好褪尽,若反应前后溶液的体积不变,则下列说法不正确的是A.通入的 在标准状况下的体积为 在标准状况下的体积为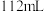 |
B.反应后溶液中 的数目为 的数目为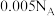 |
C.该反应中转移的电子数为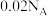 |
D.反应后的溶液中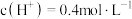 |
您最近一年使用:0次
名校
5 . 铬及其化合物在催化、金属防腐等方面具有重要应用。催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。
(1)完成化学方程式:_____ 。
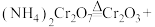 _____+_____。
_____+_____。
(2)Cr2O3催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为_____ (列式表示)。_____ (用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为_____ 。
(1)完成化学方程式:
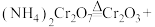 _____+_____。
_____+_____。(2)Cr2O3催化丙烷脱氢过程中,部分反应历程如图,
 过程的焓变为
过程的焓变为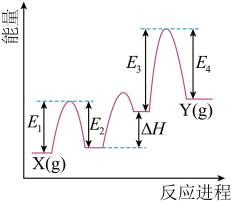
您最近一年使用:0次
解题方法
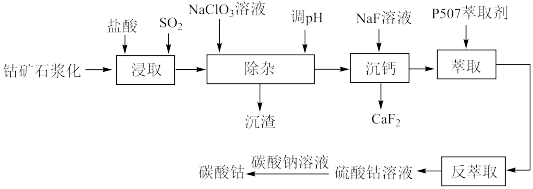
6 . 碳酸钴是一种无机化合物,其化学式为CoCO3。它是一种重要的钴盐,常用于电池、催化剂等领域。工业上以钴矿[主要成分是Co2O3]为原料制取碳酸钴的工艺流程如图: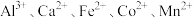 等阳离子
等阳离子
②25℃时,部分阳离子以氢氧化物形式沉淀时溶液的 见表:
见表:
③ 的
的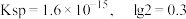
回答下列问题:
(1)Co原子的原子序数为27,其基态原子的价电子排布式为_______ 。
(2)浸取钴矿石前,需要浆化处理,原因是_______ 。
(3)除杂过程中,若加入过量 溶液会产生有毒气体
溶液会产生有毒气体 ,有人提出用压缩空气代替
,有人提出用压缩空气代替 溶液,则通入压缩空气后发生反应的离子方程式为
溶液,则通入压缩空气后发生反应的离子方程式为_______ ,调节 后,若溶液中
后,若溶液中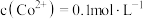 ,此时
,此时 的范围是
的范围是_______ 。
(4) 萃取剂
萃取剂 和
和 能发生反应:
能发生反应: 。萃取时,适当增大溶液
。萃取时,适当增大溶液 萃取率会增大,其原因是
萃取率会增大,其原因是_______ 。
(5)反萃取时需向萃取液中加入_______ (填写化学式),该工艺中设计萃取、反萃取的目的是_______ 。
(6)一种含 的氧化物晶胞结构如图所示,已知在该氧化物中
的氧化物晶胞结构如图所示,已知在该氧化物中 原子半径为
原子半径为 原子半径为
原子半径为 ,它们在晶体中是紧密接触的。用
,它们在晶体中是紧密接触的。用 表示阿伏加德罗常数的值,则该晶体密度为
表示阿伏加德罗常数的值,则该晶体密度为_______  (列出计算式即可)。
(列出计算式即可)。
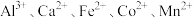 等阳离子
等阳离子②25℃时,部分阳离子以氢氧化物形式沉淀时溶液的
 见表:
见表:| 金属离子 |  |  |  |  |
沉淀完全的 | 8.3 | 2.8 | 4.7 | 9.8 |
 的
的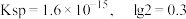
回答下列问题:
(1)Co原子的原子序数为27,其基态原子的价电子排布式为
(2)浸取钴矿石前,需要浆化处理,原因是
(3)除杂过程中,若加入过量
 溶液会产生有毒气体
溶液会产生有毒气体 ,有人提出用压缩空气代替
,有人提出用压缩空气代替 溶液,则通入压缩空气后发生反应的离子方程式为
溶液,则通入压缩空气后发生反应的离子方程式为 后,若溶液中
后,若溶液中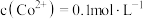 ,此时
,此时 的范围是
的范围是(4)
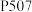 萃取剂
萃取剂 和
和 能发生反应:
能发生反应: 。萃取时,适当增大溶液
。萃取时,适当增大溶液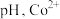 萃取率会增大,其原因是
萃取率会增大,其原因是(5)反萃取时需向萃取液中加入
(6)一种含
 的氧化物晶胞结构如图所示,已知在该氧化物中
的氧化物晶胞结构如图所示,已知在该氧化物中 原子半径为
原子半径为 原子半径为
原子半径为 ,它们在晶体中是紧密接触的。用
,它们在晶体中是紧密接触的。用 表示阿伏加德罗常数的值,则该晶体密度为
表示阿伏加德罗常数的值,则该晶体密度为 (列出计算式即可)。
(列出计算式即可)。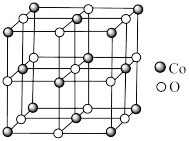
您最近一年使用:0次
解题方法
7 . 用锌窑渣回收Cu和 。已知锌窑渣主要成分有Fe、
。已知锌窑渣主要成分有Fe、 、
、 、FeS、CuS、
、FeS、CuS、 等。其流程如下图所示:
等。其流程如下图所示:
(1)滤渣的主要成分是_______ ,试剂1的化学式为_______ 。
(2)一般的矿物质用盐酸浸出的速率要比硫酸高,但在实际工业生产中一般用硫酸对矿物质进行酸浸。其原因除了盐酸比硫酸价格高外,你认为还有的原因是______ (填一种原因即可)。
(3)为了得到目标产物,对沉淀1的处理方法为_______ ,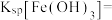
_______ 。
(4)氧化酸浸装置中,氧气的分压对Cu、Fe的溶出率的影响如图所示。_______ 。
②Fe溶出率随氧气分压增大而增大的原因是_______ 。
 。已知锌窑渣主要成分有Fe、
。已知锌窑渣主要成分有Fe、 、
、 、FeS、CuS、
、FeS、CuS、 等。其流程如下图所示:
等。其流程如下图所示: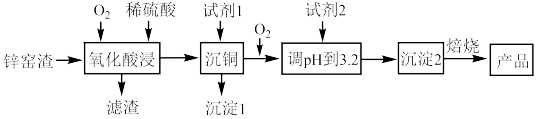
(1)滤渣的主要成分是
(2)一般的矿物质用盐酸浸出的速率要比硫酸高,但在实际工业生产中一般用硫酸对矿物质进行酸浸。其原因除了盐酸比硫酸价格高外,你认为还有的原因是
(3)为了得到目标产物,对沉淀1的处理方法为
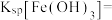
(4)氧化酸浸装置中,氧气的分压对Cu、Fe的溶出率的影响如图所示。
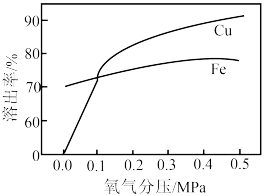
②Fe溶出率随氧气分压增大而增大的原因是
您最近一年使用:0次
8 .  下,某反应体系只存在如下8种物质:
下,某反应体系只存在如下8种物质: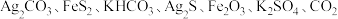 和
和 ,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量
,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量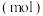 与时间关系如图所示。设
与时间关系如图所示。设 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是
 下,某反应体系只存在如下8种物质:
下,某反应体系只存在如下8种物质: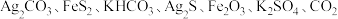 和
和 ,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量
,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量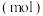 与时间关系如图所示。设
与时间关系如图所示。设 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是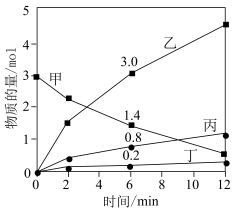
A.甲代表 ,丁为碱性氧化物 ,丁为碱性氧化物 |
B.还原产物、氧化产物的物质的量之比 |
C. 甲完全反应转移电子数为 甲完全反应转移电子数为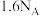 |
D.在该反应中,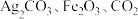 的化学计量数之比为 的化学计量数之比为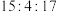 |
您最近一年使用:0次
名校
9 . 某同学为测定 和
和 混合粉末中
混合粉末中 的含量。将
的含量。将 和
和 混合粉末加入
混合粉末加入 的稀硝酸中,得到
的稀硝酸中,得到 气体
气体 (标准状况下),忽略溶液体积的变化。下列有关说法正确的是
(标准状况下),忽略溶液体积的变化。下列有关说法正确的是
 和
和 混合粉末中
混合粉末中 的含量。将
的含量。将 和
和 混合粉末加入
混合粉末加入 的稀硝酸中,得到
的稀硝酸中,得到 气体
气体 (标准状况下),忽略溶液体积的变化。下列有关说法正确的是
(标准状况下),忽略溶液体积的变化。下列有关说法正确的是| A.反应后有固体剩余 | B.反应后的溶液中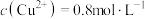 |
C. 单质在混合粉末中的质量分数约为 单质在混合粉末中的质量分数约为 | D.在反应后的溶液中加入足量铁粉,可置换出 |
您最近一年使用:0次
2024-04-11更新
|
146次组卷
|
3卷引用:辽宁省部分高中2023-2024学年高一下学期4月月考化学试题
辽宁省部分高中2023-2024学年高一下学期4月月考化学试题吉林省白山市抚松县第一中学2023-2024学年高一下学期4月月考化学试题(已下线)第二章 化学计量及应用(测试)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
解题方法
10 . 物质的形成与氧化还原反应的发生
英国科学家道尔顿是近代原子学说的创始人。他认为物质是由原子构成的,这些是不可分割的实心球体,同种原子的质量和性质相同。意大利科学家阿伏加德罗提出了分子的概念,指出了分子和原子的区别与联系。
构成物质的微粒之间通过不同性质和强度的作用力即化学键相互作用形成了具有特定组成的、性质各异的物质。
氧化还原反应是指在反应前后元素的氧化数有相应升降变化的化学反应。其由氧化反应和还原反应构成,并遵守电荷守恒定律。
氧化还原反应广泛应用于工业、农业、生物、能源等领域。例如,煤炭、石油、天然气等燃料的燃烧,植物的呼吸作用、光合作用,化学电池的制造,金属冶炼,火箭发射,施入土壤后化肥的变化等都与该反应息息相关。因此,认识氧化还原反应的实质与规律,对人类的生产和生活都具有非常重要的意义。
1.据报道,某医院正在研究用放射性同位素碘 治疗肿瘤。该核素原子核外电子数是_________。
治疗肿瘤。该核素原子核外电子数是_________。
2.下列物质中,不可能含有离子键的是_________。
3.用化学用语表示化学方程式2Na+2H2O=2NaOH+H2↑中的相关微粒,正确的是_________。
4.已知元素A的+1价的正离子核外没有电子,元素B的-2价的负离子的电子层结构与Ne原子相同。
①写出元素符号:A为___________ ;B为___________ 。
②A、B两元素结合成的一种常见的三原子化合物的分子式是___________ ,属于___________ 化合物。
③AlCl3是一种常用的氯化物,认识其结构有利于开发新的含氯元素的化合物。经实验测定,AlCl3在2.02×105Pa时熔点为190℃,且在180℃时即升华。据此性质推测,AlCl3应该属于___________ 选填“离子”或“共价”化合物。由此可知构成AlCl3固体的微粒是___________ 。
5.已知铜能与浓硝酸反应,化学方程式为:Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
①用单线桥标出上述反应的电子转移的方向和数目___________ ;
Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
②上述反应中氧化剂是___________ 填序号,被还原的元素是___________ 填序号;
a. Cu b.HNO3 c. +5价的N元素 d.0价的Cu元素
③写出该反应的离子方程式___________ 。
④0.3molCu被硝酸完全溶解后,被还原的硝酸是___________ mol,产生NO2气体的体积为___________ L标准状况下不考虑NO2与水的反应。
英国科学家道尔顿是近代原子学说的创始人。他认为物质是由原子构成的,这些是不可分割的实心球体,同种原子的质量和性质相同。意大利科学家阿伏加德罗提出了分子的概念,指出了分子和原子的区别与联系。
构成物质的微粒之间通过不同性质和强度的作用力即化学键相互作用形成了具有特定组成的、性质各异的物质。
氧化还原反应是指在反应前后元素的氧化数有相应升降变化的化学反应。其由氧化反应和还原反应构成,并遵守电荷守恒定律。
氧化还原反应广泛应用于工业、农业、生物、能源等领域。例如,煤炭、石油、天然气等燃料的燃烧,植物的呼吸作用、光合作用,化学电池的制造,金属冶炼,火箭发射,施入土壤后化肥的变化等都与该反应息息相关。因此,认识氧化还原反应的实质与规律,对人类的生产和生活都具有非常重要的意义。
1.据报道,某医院正在研究用放射性同位素碘
 治疗肿瘤。该核素原子核外电子数是_________。
治疗肿瘤。该核素原子核外电子数是_________。| A.72 | B.29 | C.53 | D.125 |
| A.CaO | B.NaOH | C.NaCl | D.HCl |
| A.中子数为12的钠原子:12Na | B.F-的结构示意图为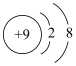 |
C.O的电子式: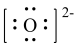 | D.NaOH中只含离子键 |
①写出元素符号:A为
②A、B两元素结合成的一种常见的三原子化合物的分子式是
③AlCl3是一种常用的氯化物,认识其结构有利于开发新的含氯元素的化合物。经实验测定,AlCl3在2.02×105Pa时熔点为190℃,且在180℃时即升华。据此性质推测,AlCl3应该属于
5.已知铜能与浓硝酸反应,化学方程式为:Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
①用单线桥标出上述反应的电子转移的方向和数目
Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
②上述反应中氧化剂是
a. Cu b.HNO3 c. +5价的N元素 d.0价的Cu元素
③写出该反应的离子方程式
④0.3molCu被硝酸完全溶解后,被还原的硝酸是
您最近一年使用:0次



