解题方法
1 . 以废旧催化剂(主要成分为 、
、 ,还含有少量的
,还含有少量的 、
、 )为主要原料制备
)为主要原料制备 、
、 的工艺流程如图所示:
的工艺流程如图所示:
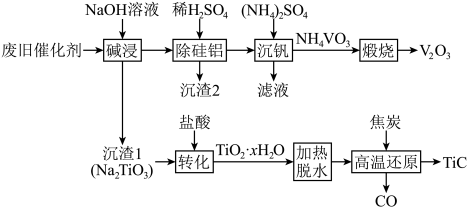
回答下列问题:
(1)“碱浸”后溶液中含钒元素的溶质是_______ (填化学式),实验室中将“沉渣1”从“碱浸”所得的悬浊液中分离出来所需玻璃仪器的名称为_______ 。
(2)“沉渣2”中含有两种成分,它们的化学式为_______ 。
(3)“转化”时发生反应的化学方程式为_______ 。
(4)“煅烧”时生成一种刺激性气味的气体,检验该气体常使用的试纸为_______ 。
(5)“高温还原”时 发生反应的化学方程式为
发生反应的化学方程式为_______ ,若生成30g还原产物,则转移电子的物质的量为_______ 。
 、
、 ,还含有少量的
,还含有少量的 、
、 )为主要原料制备
)为主要原料制备 、
、 的工艺流程如图所示:
的工艺流程如图所示:
回答下列问题:
(1)“碱浸”后溶液中含钒元素的溶质是
(2)“沉渣2”中含有两种成分,它们的化学式为
(3)“转化”时发生反应的化学方程式为
(4)“煅烧”时生成一种刺激性气味的气体,检验该气体常使用的试纸为
(5)“高温还原”时
 发生反应的化学方程式为
发生反应的化学方程式为
您最近一年使用:0次
解题方法
2 . 草酸钴主要用作制氧化钴的原料,也可用于制取其他钴化合物。利用废料铝钴膜(含有LiCoO2、Al、Fe)制备草酸钴的工艺如下:
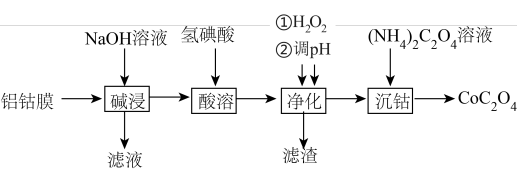
已知:①钴酸锂LiCoO2难溶于水,具有强氧化性。
②氢碘酸是强酸,酸溶后的溶液含有Li+、Fe2+、Co2+。
③金属离子沉淀开始和沉淀完全的pH:
(1)钴酸锂LiCoO2中钴元素的化合价为__________ 。
(2)“碱浸”的目的是溶解Al,写出“碱浸”过程发生反应的离子方程式__________ 。
(3)“酸溶”过程LiCoO2发生反应的离子方程式为__________ 。
(4)“净化”过程加入H2O2的目的是__________ 。
(5)调节pH的范围是__________ ,滤渣的成分是__________ (填化学式)。
(6)“沉钴”后过滤、洗涤,简述洗涤沉淀的方法__________ 。

已知:①钴酸锂LiCoO2难溶于水,具有强氧化性。
②氢碘酸是强酸,酸溶后的溶液含有Li+、Fe2+、Co2+。
③金属离子沉淀开始和沉淀完全的pH:
| Fe2+ | Fe3+ | Al3+ | Co2+ | |
| 沉淀开始的pH | 6.5 | 1.5 | 3.3 | 6.6 |
| 沉淀完全的pH | 9.7 | 3.2 | 4.7 | 9.2 |
(1)钴酸锂LiCoO2中钴元素的化合价为
(2)“碱浸”的目的是溶解Al,写出“碱浸”过程发生反应的离子方程式
(3)“酸溶”过程LiCoO2发生反应的离子方程式为
(4)“净化”过程加入H2O2的目的是
(5)调节pH的范围是
(6)“沉钴”后过滤、洗涤,简述洗涤沉淀的方法
您最近一年使用:0次
3 . 氧化还原反应在生活中随处可见,下列变化不包含氧化还原反应的是
| A.铁锅生锈 | B.铜器表面产生铜绿 |
| C.酸雨侵蚀大理石建筑 | D.彩漂水(主要成分H2O2)可漂白衣物 |
您最近一年使用:0次
解题方法
4 . 在包装糕点盒中会附有食品保鲜剂,里边的主要成分是铁粉,它可以预防食物变质,这说明铁粉具有
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
您最近一年使用:0次
解题方法
5 . “五步产盐法”起源于山西运城,其生产工艺主要以集卤蒸发为主,盐池的浓卤水经过箩、调配、储卤、结晶、铲出五个步骤即可得到纯度高且颗粒大的食盐.《天工开物》中也有类似描述,“凡引水种盐,春间即为之,久则水成赤色.待夏秋之交,南风大起,则一宵结成.……但成盐时日,与不借南风则大异也”.已知:
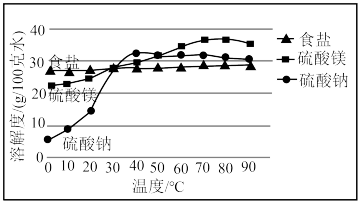
运城盐池卤水中三种主要成分溶解度随温度变化示意图
回答下列问题:
(1)为除去食盐中可能含有的少量 和
和 ,将其溶解后依次加入
,将其溶解后依次加入_________ 、 溶液后过滤,再加入适量的盐酸,蒸发结晶.
溶液后过滤,再加入适量的盐酸,蒸发结晶.
(2)运城盐池素有“夏产盐冬产硝”的说法,“夏产盐”的原理是___________________ (填操作名称,下同),“冬产硝”(主要成分为 )的原理是
)的原理是_______________ .“五步产盐法”最独特的妙处之一是在出盐前于卤水中浇洒适量淡水,由此得到的食盐晶体“质坚、粒大”且纯度较高,此法得到的食盐晶体粒大、质坚的原因是__________________________________________________ .
(3)经提纯得到的 与煤粉(主要成分为C)高温还原可制取一种重要的化工原料
与煤粉(主要成分为C)高温还原可制取一种重要的化工原料 ,同时生成无污染气体,该反应的化学方程式为
,同时生成无污染气体,该反应的化学方程式为________________________________ .
(4) 与
与 混合溶液中通入
混合溶液中通入 即可制得
即可制得 ,装置如图所示:
,装置如图所示:
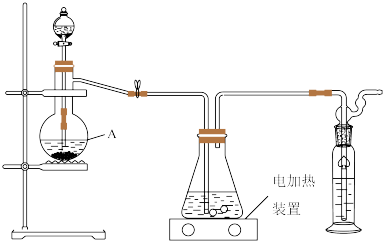
实验过程如下:打开分液漏斗活塞慢慢滴入70%的硫酸溶液,使产生的气体均匀通入 与
与 混合溶液,随着气体的通入逐渐有大量硫单质析出.继续通入气体,反应约一小时,溶液pH约等于7时(注意不要小于7),停止通气.
混合溶液,随着气体的通入逐渐有大量硫单质析出.继续通入气体,反应约一小时,溶液pH约等于7时(注意不要小于7),停止通气.
①仪器A的名称是____________ .
②锥形瓶内的反应大致可分为三步进行:
第一步:
第二步:
第三步:生成 反应的化学方程式为
反应的化学方程式为_________________ ,该实验过程中 的比例太低会导致产率过低的原因是
的比例太低会导致产率过低的原因是_________________________ .

运城盐池卤水中三种主要成分溶解度随温度变化示意图
回答下列问题:
(1)为除去食盐中可能含有的少量
 和
和 ,将其溶解后依次加入
,将其溶解后依次加入 溶液后过滤,再加入适量的盐酸,蒸发结晶.
溶液后过滤,再加入适量的盐酸,蒸发结晶.(2)运城盐池素有“夏产盐冬产硝”的说法,“夏产盐”的原理是
 )的原理是
)的原理是(3)经提纯得到的
 与煤粉(主要成分为C)高温还原可制取一种重要的化工原料
与煤粉(主要成分为C)高温还原可制取一种重要的化工原料 ,同时生成无污染气体,该反应的化学方程式为
,同时生成无污染气体,该反应的化学方程式为(4)
 与
与 混合溶液中通入
混合溶液中通入 即可制得
即可制得 ,装置如图所示:
,装置如图所示:
实验过程如下:打开分液漏斗活塞慢慢滴入70%的硫酸溶液,使产生的气体均匀通入
 与
与 混合溶液,随着气体的通入逐渐有大量硫单质析出.继续通入气体,反应约一小时,溶液pH约等于7时(注意不要小于7),停止通气.
混合溶液,随着气体的通入逐渐有大量硫单质析出.继续通入气体,反应约一小时,溶液pH约等于7时(注意不要小于7),停止通气.①仪器A的名称是
②锥形瓶内的反应大致可分为三步进行:
第一步:

第二步:

第三步:生成
 反应的化学方程式为
反应的化学方程式为 的比例太低会导致产率过低的原因是
的比例太低会导致产率过低的原因是
您最近一年使用:0次
6 . 金属镓有“电子工业脊梁”的美誉,镓与铝的化学性质类似.从刚玉渣(含钛、镓的低硅铁合金,还含有少量氧化铝)回收镓的一种流程如图所示:
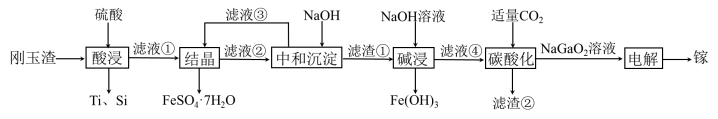
回答下列问题:
(1)镓原子结构示意图为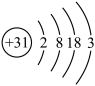 ,则其在元素周期表第
,则其在元素周期表第_________ 周期__________ 族。
(2)“酸浸”过程中禁止明火加热,原因是___________________________ ;为提高镓的浸出率,可采用的措施是__________________ (填一种即可)。
(3)“结晶”过程中得到 的操作主要为
的操作主要为__________________________ 。
(4)滤渣②的主要成分为_________________ 。
(5)“碳酸化”过程中不能通入过量 的原因为
的原因为______________________ (用离子方程式表示)。
(6)氮化镓具有优异的光电性能.工业上常采用在1100℃条件下,利用Ga与 反应可制备
反应可制备 ,该反应的化学方程式为
,该反应的化学方程式为_____________________________ 。
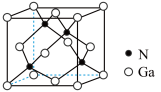
(7) 晶体的一种立方晶胞如图所示,已知晶胞参数为
晶体的一种立方晶胞如图所示,已知晶胞参数为 ,
, 的摩尔质量为
的摩尔质量为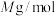 ,则该晶体的密度为
,则该晶体的密度为___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。

回答下列问题:
(1)镓原子结构示意图为
 ,则其在元素周期表第
,则其在元素周期表第(2)“酸浸”过程中禁止明火加热,原因是
(3)“结晶”过程中得到
 的操作主要为
的操作主要为(4)滤渣②的主要成分为
(5)“碳酸化”过程中不能通入过量
 的原因为
的原因为(6)氮化镓具有优异的光电性能.工业上常采用在1100℃条件下,利用Ga与
 反应可制备
反应可制备 ,该反应的化学方程式为
,该反应的化学方程式为(7)
 晶体的一种立方晶胞如图所示,已知晶胞参数为
晶体的一种立方晶胞如图所示,已知晶胞参数为 ,
, 的摩尔质量为
的摩尔质量为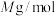 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
7 . 利用 和溴酸盐溶液制备高溴酸盐的反应为
和溴酸盐溶液制备高溴酸盐的反应为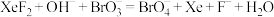 (未配平).下列说法正确的是
(未配平).下列说法正确的是
 和溴酸盐溶液制备高溴酸盐的反应为
和溴酸盐溶液制备高溴酸盐的反应为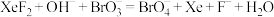 (未配平).下列说法正确的是
(未配平).下列说法正确的是A.氧化剂为 ,还原产物为 ,还原产物为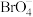 | B.若生成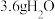 ,则该反应中转移 ,则该反应中转移 电子 电子 |
C. 中各原子均满足8电子稳定结构 中各原子均满足8电子稳定结构 | D. 中心原子的价层电子对数为2,杂化方式为 中心原子的价层电子对数为2,杂化方式为 |
您最近一年使用:0次
解题方法
8 . 下列方程式错误的是
A.在弱碱性条件下,FeS与 反应: 反应: |
B.将少量浓氨水滴入盛有CaO的烧瓶制备 : : |
C.小苏打与明矾共溶于水,产生大量气泡: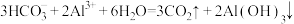 |
D.铅酸蓄电池正极反应: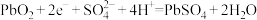 |
您最近一年使用:0次
解题方法
9 . 铅(Pb)元素的主要化合价有+2价和+4价,溶液中铅为+2价(Pb2+或 ,铅单质及其化合物在日常生活和工业生产中具有非常广泛的用途。
,铅单质及其化合物在日常生活和工业生产中具有非常广泛的用途。
(1)Pb3O4 俗名红丹,在涂料工业中用作防锈颜料,Pb3O4中+2价铅和+4价铅的原子个数之比为
(2)Pb、PbO2可用于制造铅蓄电池,铅蓄电池工作时的反应方程式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,该反应中还原产物为
(3)工业上利用铅渣(主要成分是PbO、Pb,以及少量不溶于硝酸的杂质)生产PbSO4的流程如图:
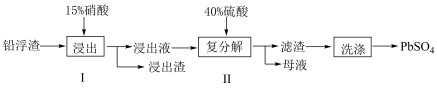
已知步骤1有NO产生,试写出Pb与硝酸反应的化学方程式
(4)血铅是指血液中铅元素的含量。血铅超标会引起机体的神经系统、血液系统、消化系统的一系列异常表现。某人血液中铅的浓度为0.4μg/mL,若转化为物质的量浓度为
您最近一年使用:0次
10 . 某同学在实验室以铁镁矿渣(含 、
、 、
、 及少量
及少量 )和
)和 (常温下为液体)为原料制备
(常温下为液体)为原料制备 和
和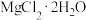 的流程如下:
的流程如下:

回答下列问题:
(1)“水解”反应的化学方程式为_______ 。
(2)“滤渣”为_______ (填化学式),其用途为_______ (填一条)。
(3)“氧化”的目的是_______ (用离子方程式表示)。
(4)“调 ”时,
”时, 调节至3,该工艺条件下,
调节至3,该工艺条件下,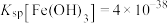 、
、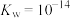 。
。
①为了获得更多的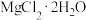 ,试剂X可以是
,试剂X可以是_______ (填化学式)。
②“调 ”后的溶液中
”后的溶液中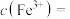
_______  。
。
(5)“系列操作”包括_______ ,过滤、洗涤、低温干燥。
(6)若直接加热蒸发 溶液
溶液____ (填“能”或“不能”)获得氯化镁晶体,其原因是_____ 。
 、
、 、
、 及少量
及少量 )和
)和 (常温下为液体)为原料制备
(常温下为液体)为原料制备 和
和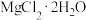 的流程如下:
的流程如下:
回答下列问题:
(1)“水解”反应的化学方程式为
(2)“滤渣”为
(3)“氧化”的目的是
(4)“调
 ”时,
”时, 调节至3,该工艺条件下,
调节至3,该工艺条件下,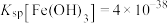 、
、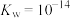 。
。①为了获得更多的
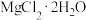 ,试剂X可以是
,试剂X可以是②“调
 ”后的溶液中
”后的溶液中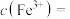
 。
。(5)“系列操作”包括
(6)若直接加热蒸发
 溶液
溶液
您最近一年使用:0次



