解题方法
1 . 碱式碳酸铜俗称铜绿,用于催化剂、烟火、农药、颜料、电镀、防腐等行业及制造铜化合物。在工业上用辉铜矿(主要成分为 ,含少量
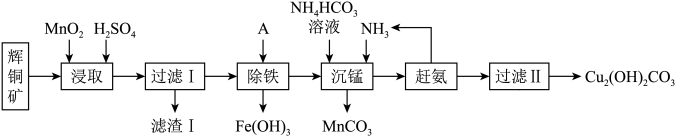
,含少量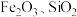 等杂质)来制备铜绿的工艺流程如下图:
等杂质)来制备铜绿的工艺流程如下图:
已知:下表为部分金属阳离子在常温下沉淀时的pH值:
(1)“酸浸”过程中,会加入软锰矿(主要成分为 )氧化
)氧化 ,并生成一种黄色沉淀,请写出该离子方程式:
,并生成一种黄色沉淀,请写出该离子方程式:_______ ;为提高酸浸效率,可采取的措施是_______ 。
(2)“除铁”过程中,A物质选用 来中和酸,调节
来中和酸,调节 的范围为
的范围为_______ ;当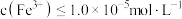 时视为沉淀完全,则
时视为沉淀完全,则
_______ 。
(3)为了保证产品纯度,请设计实验确认 是否除尽
是否除尽_______ 。
(4)经上述流程转化后,为确认该 的纯度,取
的纯度,取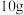 样品加强热至质量不再变化(假设杂质受热不反应),所得气体全部通入澄清石灰水中,得到
样品加强热至质量不再变化(假设杂质受热不反应),所得气体全部通入澄清石灰水中,得到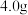 沉淀。请写出加热时的化学方程式
沉淀。请写出加热时的化学方程式_______ ,产物纯度为_______  (精确到小数点后1位)。
(精确到小数点后1位)。
(5)某同学仔细研究后,认为该工艺流程还可以提取副产物,从而提高经济效益。他从滤渣I溶解回收黄色沉淀,所用溶剂最合适的是_______ (填化学式),但该操作温度不宜过高,其原因是_______ 。
 ,含少量
,含少量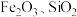 等杂质)来制备铜绿的工艺流程如下图:
等杂质)来制备铜绿的工艺流程如下图:
已知:下表为部分金属阳离子在常温下沉淀时的pH值:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 7.5 | 2.3 | 5.6 | 8.3 |
| 完全沉淀的pH | 9.0 | 3.0 | 6.7 | 9.8 |
(1)“酸浸”过程中,会加入软锰矿(主要成分为
 )氧化
)氧化 ,并生成一种黄色沉淀,请写出该离子方程式:
,并生成一种黄色沉淀,请写出该离子方程式:(2)“除铁”过程中,A物质选用
 来中和酸,调节
来中和酸,调节 的范围为
的范围为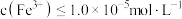 时视为沉淀完全,则
时视为沉淀完全,则
(3)为了保证产品纯度,请设计实验确认
 是否除尽
是否除尽(4)经上述流程转化后,为确认该
 的纯度,取
的纯度,取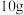 样品加强热至质量不再变化(假设杂质受热不反应),所得气体全部通入澄清石灰水中,得到
样品加强热至质量不再变化(假设杂质受热不反应),所得气体全部通入澄清石灰水中,得到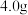 沉淀。请写出加热时的化学方程式
沉淀。请写出加热时的化学方程式 (精确到小数点后1位)。
(精确到小数点后1位)。(5)某同学仔细研究后,认为该工艺流程还可以提取副产物,从而提高经济效益。他从滤渣I溶解回收黄色沉淀,所用溶剂最合适的是
您最近一年使用:0次
解题方法
2 . 锂被誉为“高能金属”,以废旧锂离子电池的正极材料(主要含有 及少量
及少量 、
、 等)为原料制备
等)为原料制备 的一种工艺流程如图1所示。
的一种工艺流程如图1所示。
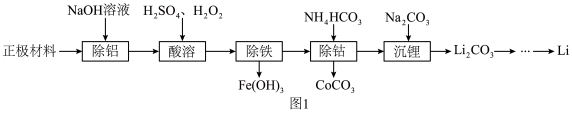
回答下列问题:
(1)“除铝”时所得溶液中含铝微粒为___________ (填化学式,下同)。
(2)“酸溶”时,若用浓盐酸代替 和
和 的混合液,则有一种黄绿色气体生成,该反应的还原剂为
的混合液,则有一种黄绿色气体生成,该反应的还原剂为___________ 。
(3)该流程中涉及过滤,实验室过滤时玻璃棒的作用为___________ 。
(4)写出“除钴”过程中发生反应的离子方程式:___________ 。
(5)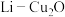 电池是近年来发明的一种低成本高效电池,该电池首先通过
电池是近年来发明的一种低成本高效电池,该电池首先通过 与
与 反应产生
反应产生 ,然后通过还原反应再生,电池结构如图2所示。
,然后通过还原反应再生,电池结构如图2所示。
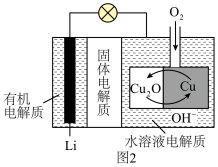
①正极反应式为___________ 。
②每转移 电子,理论上消耗
电子,理论上消耗___________ 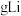 。
。
(6)锂—空气二次电池的反应原理为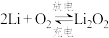 ,其放电时的工作原理如图3所示。
,其放电时的工作原理如图3所示。
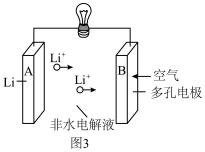
①充电时阳极电极反应式为___________ 。
②放电时,若B极增重 ,则通过外电路电子的物质的量为
,则通过外电路电子的物质的量为___________  。
。
 及少量
及少量 、
、 等)为原料制备
等)为原料制备 的一种工艺流程如图1所示。
的一种工艺流程如图1所示。
回答下列问题:
(1)“除铝”时所得溶液中含铝微粒为
(2)“酸溶”时,若用浓盐酸代替
 和
和 的混合液,则有一种黄绿色气体生成,该反应的还原剂为
的混合液,则有一种黄绿色气体生成,该反应的还原剂为(3)该流程中涉及过滤,实验室过滤时玻璃棒的作用为
(4)写出“除钴”过程中发生反应的离子方程式:
(5)
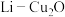 电池是近年来发明的一种低成本高效电池,该电池首先通过
电池是近年来发明的一种低成本高效电池,该电池首先通过 与
与 反应产生
反应产生 ,然后通过还原反应再生,电池结构如图2所示。
,然后通过还原反应再生,电池结构如图2所示。
①正极反应式为
②每转移
 电子,理论上消耗
电子,理论上消耗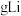 。
。(6)锂—空气二次电池的反应原理为
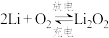 ,其放电时的工作原理如图3所示。
,其放电时的工作原理如图3所示。
①充电时阳极电极反应式为
②放电时,若B极增重
 ,则通过外电路电子的物质的量为
,则通过外电路电子的物质的量为 。
。
您最近一年使用:0次
解题方法
3 . 松山湖材料实验室李洪飞首次研究了碘正极在水系铝离子电池中的转化反应化学( )。下列叙述错误的是
)。下列叙述错误的是
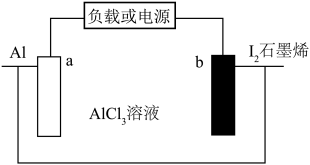
 )。下列叙述错误的是
)。下列叙述错误的是
A.放电时, 在正极上发生还原反应 在正极上发生还原反应 |
B.放电时, 极质量减少 极质量减少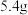 理论上转移约 理论上转移约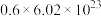 个电子 个电子 |
C.充电时, 极反应之一为 极反应之一为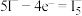 |
D.充电时, 参与反应生成 参与反应生成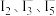 物质的量之比一定为 物质的量之比一定为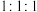 |
您最近一年使用:0次
4 . 下列由实验操作和现象得出的结论正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 新制氯水中通入 | 溶液黄绿色逐渐褪去 |  将 将 还原 还原 |
| B | 向 溶液滴入过量氯水,再滴入 溶液滴入过量氯水,再滴入 溶液 溶液 | 溶液无色变黄色,后产生淡黄色沉淀 | 氧化性: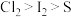 |
| C |  通入 通入 溶液中 溶液中 | 产生无色气体 | 产生的气体为 |
| D | 向 与 与 固体混合物中滴入水 固体混合物中滴入水 | 产生刺激性气体 | 该气体中含 和 和 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 草酸亚铁晶体(FeC2O4·2H2O)是实验室常用的分析试剂,可通过硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O,易氧化]与草酸反应制得。制备并测定其组成设计实验如下。
Ⅰ.硫酸铵和硫酸亚铁混合结晶制备硫酸亚铁铵。
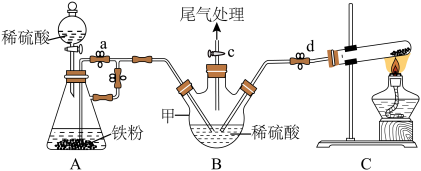
实验步骤:(ⅰ)……;(ⅱ)加入试剂;(ⅲ)打开d、c,加热,通入氨气制得硫酸铵;(ⅳ)……(a、b止水夹“操作1”),加入稀硫酸,产生H2,赶出装置内的空气,……(a、b止水夹“操作2”),将A中的硫酸亚铁压入到B中;(ⅴ)将B中溶液倒入蒸发皿中,经系列操作得到硫酸亚铁铵。
(1)操作(ⅰ)为______ 。
(2)操作(ⅳ)产生H2,赶出装置内的空气的目的为______ a、b止水夹“操作2”为______
(3)仪器甲的名称为______ 。该装置中存在一处缺陷为______
(4)写出装置C中发生反应的化学方程式____________ 。
Ⅱ.制备草酸亚铁晶体并测定其组成。
将制得的硫酸亚铁铵与草酸一定条件下混合加热,经沉淀,抽滤、洗涤获得草酸亚铁晶体
粗品。该草酸亚铁晶体(FeC2O4·2H2O)粗品中可能含有的杂质为Fe2(C2O4)3、H2C2O4·2H2O,采用KMnO4溶液滴定法测定该粗品的组成,实验过程如图。已知草酸为弱酸,可被KMnO4溶液氧化为CO2,回答下列问题。

(5)“滴定①”中发生反应的离子方程式为____________ 。
(6)样品中所含H2C2O4·2H2O(摩尔质量为M g/mol)的质量分数表达式为____________ 。
Ⅰ.硫酸铵和硫酸亚铁混合结晶制备硫酸亚铁铵。

实验步骤:(ⅰ)……;(ⅱ)加入试剂;(ⅲ)打开d、c,加热,通入氨气制得硫酸铵;(ⅳ)……(a、b止水夹“操作1”),加入稀硫酸,产生H2,赶出装置内的空气,……(a、b止水夹“操作2”),将A中的硫酸亚铁压入到B中;(ⅴ)将B中溶液倒入蒸发皿中,经系列操作得到硫酸亚铁铵。
(1)操作(ⅰ)为
(2)操作(ⅳ)产生H2,赶出装置内的空气的目的为
(3)仪器甲的名称为
(4)写出装置C中发生反应的化学方程式
Ⅱ.制备草酸亚铁晶体并测定其组成。
将制得的硫酸亚铁铵与草酸一定条件下混合加热,经沉淀,抽滤、洗涤获得草酸亚铁晶体
粗品。该草酸亚铁晶体(FeC2O4·2H2O)粗品中可能含有的杂质为Fe2(C2O4)3、H2C2O4·2H2O,采用KMnO4溶液滴定法测定该粗品的组成,实验过程如图。已知草酸为弱酸,可被KMnO4溶液氧化为CO2,回答下列问题。

(5)“滴定①”中发生反应的离子方程式为
(6)样品中所含H2C2O4·2H2O(摩尔质量为M g/mol)的质量分数表达式为
您最近一年使用:0次
6 . 黄铜矿(主要成分为CuFeS2)产生的炉渣可用于制备绿矾(FeSO4·7H2O)。工艺流程如图。

已知:焙烧时的主要反应为:① ;
;
② ;③
;③ 。
。
回答下列问题:
(1)若CuFeS2中Fe的化合价为+2,则反应①中的氧化剂为
(2)“炉渣”的主要成分为Fe2O3、FeO和少量Cu。
①Fe2O3高温下与铝粉混合发生的反应为
②“酸溶”后溶液中一定存在的金属阳离子为
③“试剂X”为
a.铁粉 b.铜粉 c.锌粉 d.30%的H2O2
④“操作”用到的玻璃仪器为
(3)“系列操作”为
您最近一年使用:0次
解题方法
7 . 化学与生活息息相关。请回答下列问题。
(1)碳酸氢钠可单独用作蒸馒头的膨松剂,用化学方程式表示该膨松原理______ 。
(2)过氧化钠常用作呼吸面具和潜水艇里的氧气供给,用化学方程式表示____________ 。
(3)铀元素在核工业中具有重要作用,自然界中存在的铀矿石主要成分为二氧化铀(UO2)。工业上,可以用钾、钙、镁等金属与二氧化铀反应制得铀单质。若要获得等质量的铀单质,钾、钙、镁三种金属的物质的量之比为______ 。
(4)补铁口服液是常见的补铁剂,同时服用维生素C吸收效果更好,维生素C的作用为____________ 。
(5)工业上利用硫铁矿(80%FeS2)制备硫酸。
①FeS2中S的化合价为______ ,硫铁矿在氧气中焙烧产物为Fe2O3和SO2,写出该反应的化学方程式____________ 。
②不考虑生产过程中硫的损失,3吨该矿石可制得98%的浓硫酸______ 吨。
(1)碳酸氢钠可单独用作蒸馒头的膨松剂,用化学方程式表示该膨松原理
(2)过氧化钠常用作呼吸面具和潜水艇里的氧气供给,用化学方程式表示
(3)铀元素在核工业中具有重要作用,自然界中存在的铀矿石主要成分为二氧化铀(UO2)。工业上,可以用钾、钙、镁等金属与二氧化铀反应制得铀单质。若要获得等质量的铀单质,钾、钙、镁三种金属的物质的量之比为
(4)补铁口服液是常见的补铁剂,同时服用维生素C吸收效果更好,维生素C的作用为
(5)工业上利用硫铁矿(80%FeS2)制备硫酸。
①FeS2中S的化合价为
②不考虑生产过程中硫的损失,3吨该矿石可制得98%的浓硫酸
您最近一年使用:0次
8 . 郫县豆瓣是中国有名调味料之一。某罐装郫县豆瓣部分信息如图所示。下列有关说法正确的是
| 配料表:红辣椒、蚕豆、食用盐、小麦粉、菜籽油、香辛料、食品添加剂(山梨酸钾)、 食用盐(NaCl计)含量:16~18g/100g 净含量:500g |
| A.郫县豆瓣能产生丁达尔效应 |
| B.制作过程中需要发酵,发酵时未发生化学反应 |
| C.郫县豆瓣密封保存的原因之一是隔绝空气中的氮气 |
| D.每500g该郫县豆瓣中含有NaCl的物质的量最多约为1.54mol |
您最近一年使用:0次
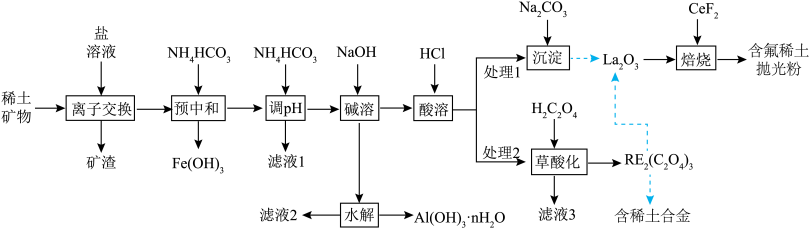
9 . 稀土(RE)包括镧(La)、铈(Ce)等元素,是重要的战略资源,从离子型稀土矿(含Fe、Al等元素)中提取稀土元素并获得高附加值产品的一种工艺流程如图所示:
回答下列问题:
(1)“预中和”工序中:
①该工序适宜的pH范围是______ 。
②胶状 的X射线衍射图谱中,
的X射线衍射图谱中,______ (选填“能”或“不能”)观察到明锐的衍射峰。
(2)“调pH”工序中, 发生的离子反应方程式为
发生的离子反应方程式为________________________ 。
(3)滤液3可返回__________________ 工序循环使用。
(4)“沉淀”工序产物为______ (选填“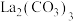 ”或“
”或“ ”),理由是
”),理由是______ [ :
: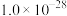 ]。(当反应的
]。(当反应的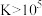 时可认为反应完全)
时可认为反应完全)
(5)含氟稀土抛光粉的主要成分为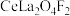 ,焙烧时发生的化学反应方程式为
,焙烧时发生的化学反应方程式为______ 。
(6)利用离子交换法浸出稀土的过程如图所示。已知离子半径越小、电荷数越大,离子交换能力越强.下列离子对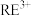 交换能力最强的是______。
交换能力最强的是______。
(7)银铈合金是优良的导电材料,一种银铈晶体结构单元如图(a)所示:____________ 。
②该晶体的化学式为____________ 。
| 离子 |  |  | 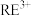 |
| 开始沉淀时的pH | 1.5 | 4.3 | 5.6( 为6.2) 为6.2) |
| 沉淀完全时的pH | 3.2 | 5.5 | /( 为9.0) 为9.0) |
(1)“预中和”工序中:
①该工序适宜的pH范围是
②胶状
 的X射线衍射图谱中,
的X射线衍射图谱中,(2)“调pH”工序中,
 发生的离子反应方程式为
发生的离子反应方程式为(3)滤液3可返回
(4)“沉淀”工序产物为
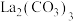 ”或“
”或“ ”),理由是
”),理由是 :
: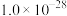 ]。(当反应的
]。(当反应的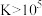 时可认为反应完全)
时可认为反应完全)(5)含氟稀土抛光粉的主要成分为
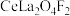 ,焙烧时发生的化学反应方程式为
,焙烧时发生的化学反应方程式为(6)利用离子交换法浸出稀土的过程如图所示。已知离子半径越小、电荷数越大,离子交换能力越强.下列离子对
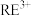 交换能力最强的是______。
交换能力最强的是______。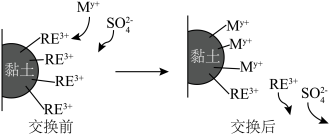
A. | B. | C. | D. |
(7)银铈合金是优良的导电材料,一种银铈晶体结构单元如图(a)所示:

②该晶体的化学式为
您最近一年使用:0次
2024-03-22更新
|
872次组卷
|
2卷引用:广东省佛山市2024届高三教学质量检测(一)化学试题
10 .  是一种重要的消毒剂,在日常生活中应用广泛。
是一种重要的消毒剂,在日常生活中应用广泛。
(1) 在水溶液中的电离方程式是
在水溶液中的电离方程式是_______ 。
(2)使用 溶液时经常滴加稀硫酸,目的是
溶液时经常滴加稀硫酸,目的是_______ 。
(3)实验室中要配制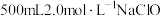 溶液。
溶液。
①实验中用到的玻璃仪器是烧杯、玻璃棒、_______ ;
②配制溶液的过程中一些操作如下图所示:
关于上述操作的说法正确的是_______ 。
A.溶解 固体的操作如图①所示
固体的操作如图①所示
B.定容时的操作如图②所示
C.定容时的操作可用图③表示
D.定容时向容量瓶内加蒸馏水至接近刻度线 时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切
时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切
(4)下列操作能使所配制溶液浓度偏低的是_______。
(5)洁厕灵(主要成分是盐酸)与“84”消毒液混合使用发生下列反应: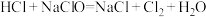 ,该反应的氧化剂是
,该反应的氧化剂是______ ,反应过程中生成标准状况下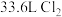 ,转移电子数是
,转移电子数是_____ 。
 是一种重要的消毒剂,在日常生活中应用广泛。
是一种重要的消毒剂,在日常生活中应用广泛。(1)
 在水溶液中的电离方程式是
在水溶液中的电离方程式是(2)使用
 溶液时经常滴加稀硫酸,目的是
溶液时经常滴加稀硫酸,目的是(3)实验室中要配制
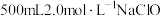 溶液。
溶液。①实验中用到的玻璃仪器是烧杯、玻璃棒、
②配制溶液的过程中一些操作如下图所示:
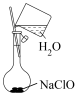 |  | 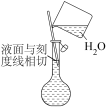 |
| ① | ② | ③ |
A.溶解
 固体的操作如图①所示
固体的操作如图①所示B.定容时的操作如图②所示
C.定容时的操作可用图③表示
D.定容时向容量瓶内加蒸馏水至接近刻度线
 时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切
时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切(4)下列操作能使所配制溶液浓度偏低的是_______。
| A.称量固体时物码反放 | B.使用的容量瓶不干燥 |
| C.称量时使用有油污的砝码 | D.定容摇匀后液面下降又加水 |
(5)洁厕灵(主要成分是盐酸)与“84”消毒液混合使用发生下列反应:
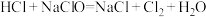 ,该反应的氧化剂是
,该反应的氧化剂是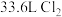 ,转移电子数是
,转移电子数是
您最近一年使用:0次



