解题方法
1 . 根据实验操作和现象得出的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 用硫酸酸化的 溶液滴入 溶液滴入 溶液中,溶液变黄色 溶液中,溶液变黄色 | 氧化性: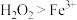 |
| B | 向某溶液中加入足量氯水,再滴加淀粉溶液,溶液未变蓝色 | 溶液中不含I⁻ |
| C | 取足量铜和浓硫酸反应后的溶液于试管中,依次加入稀盐酸、 溶液,产生大量白色沉淀 溶液,产生大量白色沉淀 | 说明硫酸有剩余 |
| D | 将两支盛有等体积、等浓度的 溶液的大小相同的试管分别置于冷水、热水中,同时加入等体积、等浓度的稀硫酸。置于热水中的试管比置于冷水中的试管先出现沉淀 溶液的大小相同的试管分别置于冷水、热水中,同时加入等体积、等浓度的稀硫酸。置于热水中的试管比置于冷水中的试管先出现沉淀 | 其他条件相同时,升高温度能加快反应速率 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 下围是以氮气和氢气为原料合成氨,并以氨为原料生产硝酸的工艺流程(其中空气等基础原料已略去).________________ .
(2)若条件控制不当,氨氧化装置中可能发生副反应, 与
与 生成
生成 ,该副反应中氧化剂与还原剂的物质的量之比为
,该副反应中氧化剂与还原剂的物质的量之比为________ .
(3)下列离子能在溶液中共存,但加入适量 溶液后无法大量共存的是________.
溶液后无法大量共存的是________.
(4)将25.6g铜与60.0mL一定浓度的硝酸发生反应,铜完全溶解,产生 和NO混合气体的体积为8.96L(标准状况,不考虑
和NO混合气体的体积为8.96L(标准状况,不考虑 二聚).待产生的气体全部释放后,向溶液加入100mL
二聚).待产生的气体全部释放后,向溶液加入100mL 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为________  .
.
(5)可以用 还原
还原 生成BaO,该过程分两步进行.下图表示该过程相关物质浓度随时间的变化关系,第一步反应中消耗的
生成BaO,该过程分两步进行.下图表示该过程相关物质浓度随时间的变化关系,第一步反应中消耗的 与
与 的物质的量之比是
的物质的量之比是________ .

(2)若条件控制不当,氨氧化装置中可能发生副反应,
 与
与 生成
生成 ,该副反应中氧化剂与还原剂的物质的量之比为
,该副反应中氧化剂与还原剂的物质的量之比为(3)下列离子能在溶液中共存,但加入适量
 溶液后无法大量共存的是________.
溶液后无法大量共存的是________.A. 、 、 、 、 、 、 | B. 、 、 、 、 、 、 |
C. 、 、 、 、 、 、 | D. 、 、 、 、 、 、 |
(4)将25.6g铜与60.0mL一定浓度的硝酸发生反应,铜完全溶解,产生
 和NO混合气体的体积为8.96L(标准状况,不考虑
和NO混合气体的体积为8.96L(标准状况,不考虑 二聚).待产生的气体全部释放后,向溶液加入100mL
二聚).待产生的气体全部释放后,向溶液加入100mL 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为 .
.(5)可以用
 还原
还原 生成BaO,该过程分两步进行.下图表示该过程相关物质浓度随时间的变化关系,第一步反应中消耗的
生成BaO,该过程分两步进行.下图表示该过程相关物质浓度随时间的变化关系,第一步反应中消耗的 与
与 的物质的量之比是
的物质的量之比是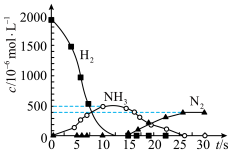
您最近一年使用:0次
名校
3 . 在葡萄酒酿制的过程中,葡萄汁中某些细菌的繁殖会影响发酵,常常添加适量的 。下列关于
。下列关于 作用的叙述中,正确的是
作用的叙述中,正确的是
 。下列关于
。下列关于 作用的叙述中,正确的是
作用的叙述中,正确的是| A.可以起到防腐和杀菌等作用 | B.作氧化剂,起到保质作用 |
| C.不利于保持葡萄酒的天然果香味 | D.在其他食品加工中,提倡使用 |
您最近一年使用:0次
名校
解题方法
4 . “微生物法”处理含 废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含
废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含 废水。
废水。
(1)硫酸盐还原菌能将水中的 转化为
转化为 ,
, 与
与 可反应生成
可反应生成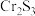 和
和 两种沉淀。写出
两种沉淀。写出 与
与 反应的离子方程式:
反应的离子方程式:___________ 。
(2)用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在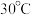 左右,温度过高,
左右,温度过高, 的去除率低的原因是
的去除率低的原因是___________ 。
(3)硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。已知溶液中的 会完全转化为
会完全转化为 ,则
,则 腐蚀后生成
腐蚀后生成 和
和 的物质的量之比为
的物质的量之比为___________ 。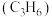 为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。___________ ,乙为___________ 。(用化学式表示)
②若参加反应的丙烯与 物质的量之比为
物质的量之比为 ,则反应的化学方程式为
,则反应的化学方程式为___________ 。
 废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含
废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含 废水。
废水。(1)硫酸盐还原菌能将水中的
 转化为
转化为 ,
, 与
与 可反应生成
可反应生成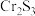 和
和 两种沉淀。写出
两种沉淀。写出 与
与 反应的离子方程式:
反应的离子方程式:(2)用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在
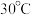 左右,温度过高,
左右,温度过高, 的去除率低的原因是
的去除率低的原因是(3)硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。已知溶液中的
 会完全转化为
会完全转化为 ,则
,则 腐蚀后生成
腐蚀后生成 和
和 的物质的量之比为
的物质的量之比为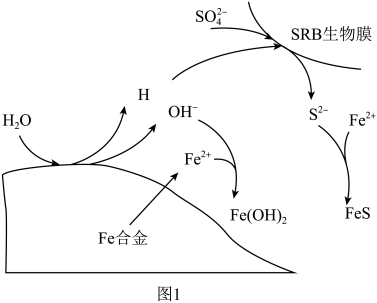
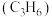 为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。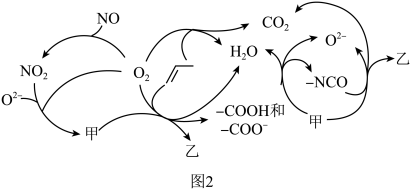
②若参加反应的丙烯与
 物质的量之比为
物质的量之比为 ,则反应的化学方程式为
,则反应的化学方程式为
您最近一年使用:0次
名校
5 . 环境保护与绿色发展是新时代人们关心的共同话题。NO、 是大气主要污染物,因此对工业烟气(主要成分为
是大气主要污染物,因此对工业烟气(主要成分为 ,
, 、
、 )脱硝是工业生产中的重要一环。脱除的方法有多种,比较常见的有水吸收法、酸吸收法、碱吸收法、氧化吸收法、还原吸收法和综合吸收法等。
)脱硝是工业生产中的重要一环。脱除的方法有多种,比较常见的有水吸收法、酸吸收法、碱吸收法、氧化吸收法、还原吸收法和综合吸收法等。
(1)碱液吸收:NaOH溶液可吸收工业烟气,获得副产品 。
。
①等物质的量的NO与 被NaOH溶液吸收,反应的离子方程式为
被NaOH溶液吸收,反应的离子方程式为____________ 。
②若吸收时NO与 的比例控制不当,则吸收液经浓缩结晶、过滤得到的
的比例控制不当,则吸收液经浓缩结晶、过滤得到的 晶体中最有可能混有的杂质是
晶体中最有可能混有的杂质是______ (填化学式)。
(2)目前常见方法是采用酸化处理的NaClO溶液液相氧化法脱除烟气中的 ,其主要过程如下:
,其主要过程如下:
Ⅰ.
 kJ/mol
kJ/mol
Ⅱ.
 kJ/mol
kJ/mol
①写出 转化为
转化为 的热化学方程式:
的热化学方程式:____________ 。
②研究不同温度下对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是______ 。
(3)氨气催化吸收处理尾气法:已知6mol氨气恰好能将含NO和 共7mol的混合气体完全转化为
共7mol的混合气体完全转化为 ,则混合气体中NO和
,则混合气体中NO和 的物质的量之比为
的物质的量之比为______ 。
方法1:直接使用尿素 溶液吸收烟气中的
溶液吸收烟气中的 。
。
方法2:先用合适的氧化剂将 中的NO氧化为
中的NO氧化为 ,再用
,再用 溶液还原吸收。
溶液还原吸收。
还原吸收等量的 ,消耗尿素较少的是
,消耗尿素较少的是______ (填“方法1”或“方法2”)。工业上选择方法2处理 的原因是
的原因是____________ 。
 是大气主要污染物,因此对工业烟气(主要成分为
是大气主要污染物,因此对工业烟气(主要成分为 ,
, 、
、 )脱硝是工业生产中的重要一环。脱除的方法有多种,比较常见的有水吸收法、酸吸收法、碱吸收法、氧化吸收法、还原吸收法和综合吸收法等。
)脱硝是工业生产中的重要一环。脱除的方法有多种,比较常见的有水吸收法、酸吸收法、碱吸收法、氧化吸收法、还原吸收法和综合吸收法等。(1)碱液吸收:NaOH溶液可吸收工业烟气,获得副产品
 。
。①等物质的量的NO与
 被NaOH溶液吸收,反应的离子方程式为
被NaOH溶液吸收,反应的离子方程式为②若吸收时NO与
 的比例控制不当,则吸收液经浓缩结晶、过滤得到的
的比例控制不当,则吸收液经浓缩结晶、过滤得到的 晶体中最有可能混有的杂质是
晶体中最有可能混有的杂质是(2)目前常见方法是采用酸化处理的NaClO溶液液相氧化法脱除烟气中的
 ,其主要过程如下:
,其主要过程如下:Ⅰ.

 kJ/mol
kJ/molⅡ.

 kJ/mol
kJ/mol①写出
 转化为
转化为 的热化学方程式:
的热化学方程式:②研究不同温度下对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
(3)氨气催化吸收处理尾气法:已知6mol氨气恰好能将含NO和
 共7mol的混合气体完全转化为
共7mol的混合气体完全转化为 ,则混合气体中NO和
,则混合气体中NO和 的物质的量之比为
的物质的量之比为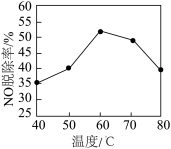
方法1:直接使用尿素
 溶液吸收烟气中的
溶液吸收烟气中的 。
。方法2:先用合适的氧化剂将
 中的NO氧化为
中的NO氧化为 ,再用
,再用 溶液还原吸收。
溶液还原吸收。还原吸收等量的
 ,消耗尿素较少的是
,消耗尿素较少的是 的原因是
的原因是
您最近一年使用:0次
名校
解题方法
6 . 一种制备 的方法如下:将铜与足量的浓硫酸加热,接着有两步操作
的方法如下:将铜与足量的浓硫酸加热,接着有两步操作
Ⅰ:将生成的气体用适量 溶液吸收得到单一组分的正盐溶液X
溶液吸收得到单一组分的正盐溶液X
Ⅱ:除去余酸,将硫酸铜配成溶液,并加入溶液X,反应过滤即得
已知第Ⅱ步反应需及时补加 以保持反应在
以保持反应在 条件下进行.下列有关说法不正确的是
条件下进行.下列有关说法不正确的是
 的方法如下:将铜与足量的浓硫酸加热,接着有两步操作
的方法如下:将铜与足量的浓硫酸加热,接着有两步操作Ⅰ:将生成的气体用适量
 溶液吸收得到单一组分的正盐溶液X
溶液吸收得到单一组分的正盐溶液XⅡ:除去余酸,将硫酸铜配成溶液,并加入溶液X,反应过滤即得

已知第Ⅱ步反应需及时补加
 以保持反应在
以保持反应在 条件下进行.下列有关说法不正确的是
条件下进行.下列有关说法不正确的是| A.铜和浓硫酸的反应中,浓硫酸表现为氧化性和酸性 |
| B.若从溶液X获得固体X,可将X溶液蒸发浓缩,冷却结晶 |
| C.硫酸铜和石灰乳混合可以制备波尔多液 |
D.若 产量不变,参与反应Ⅱ的X与 产量不变,参与反应Ⅱ的X与 物质的量之比 物质的量之比 增大时,需补加 增大时,需补加 的量减少 的量减少 |
您最近一年使用:0次
名校
7 . FeOOH在生产生活中有广泛应用。
I.用硫酸渣(主要成分为 、
、 )制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。
)制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。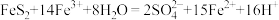 ;
; 、
、 均与
均与 不反应。
不反应。
(1)基态 价层电子排布式为
价层电子排布式为___________ 。
(2)“还原”时还原产物与氧化产物的物质的量之比为___________ 。
(3)“氧化”时,当滴加氨水至pH为6.0时,停止滴加氨水,开始通空气,生成铁黄。通入空气过程中,记录溶液pH变化如图所示。 完全沉淀的
完全沉淀的 。
。 时段发生的反应为
时段发生的反应为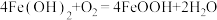 ;
; 时段,溶液pH明显降低,请解释原因:
时段,溶液pH明显降低,请解释原因:___________ 。
II. 在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。
(4)在80℃下,向 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得
溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。
①制备1mol 理论上需要
理论上需要 的物质的量为
的物质的量为___________ mol;实际生产过程中所加 低于理论用量的原因是
低于理论用量的原因是___________ 。
②为检验 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是___________ 。
(5) 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 结构如图2所示。
结构如图2所示。 分子中的共价键的物质的量为
分子中的共价键的物质的量为___________ mol。
②写出反应II的化学方程式:___________ 。
I.用硫酸渣(主要成分为
 、
、 )制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。
)制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。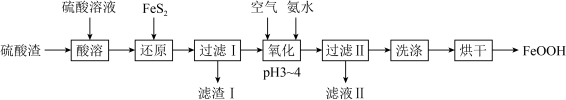
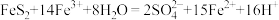 ;
; 、
、 均与
均与 不反应。
不反应。(1)基态
 价层电子排布式为
价层电子排布式为(2)“还原”时还原产物与氧化产物的物质的量之比为
(3)“氧化”时,当滴加氨水至pH为6.0时,停止滴加氨水,开始通空气,生成铁黄。通入空气过程中,记录溶液pH变化如图所示。
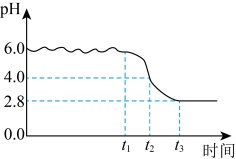
 完全沉淀的
完全沉淀的 。
。 时段发生的反应为
时段发生的反应为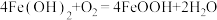 ;
; 时段,溶液pH明显降低,请解释原因:
时段,溶液pH明显降低,请解释原因:II.
 在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。(4)在80℃下,向
 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得
溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。①制备1mol
 理论上需要
理论上需要 的物质的量为
的物质的量为 低于理论用量的原因是
低于理论用量的原因是②为检验
 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是(5)
 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 结构如图2所示。
结构如图2所示。
 分子中的共价键的物质的量为
分子中的共价键的物质的量为②写出反应II的化学方程式:
您最近一年使用:0次
2024-06-16更新
|
58次组卷
|
2卷引用:江苏省南通市海安高级中学2023-2024学年高一下学期期中考试化学试题
名校
解题方法
8 . 将3.2g铜与60.0mL稀硝酸发生反应,铜完全溶解,假设还原产物只有一种,则用排水法可收集到________ L气体(STP)。
您最近一年使用:0次
名校
9 . 天然气中的 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为 ,一定条件下向
,一定条件下向 溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:
溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:________________ .当消耗标准状况下22.4L富氧空气时,有________ mol电子转移。
 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为 ,一定条件下向
,一定条件下向 溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:
溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:
您最近一年使用:0次
10 . 自然界的氮循环如图所示
(2)施用化肥可有效提高粮食产量.化肥氯化铵施用时需要注意避免烈日曝晒,因为(写出对应的化学方程式)______________________________ .此类铵态氮肥不宜和草木灰等碱性肥料混合使用,原因是________________ .
(3)海洋生物参与氮循环的过程如图所示(其它含氮物质不参与反应).________ 种价态.过程②中氮元素被________ .(填“氧化”或“还原”)
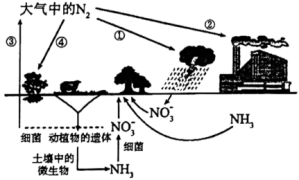
| A.图中表示了三种不同的固氮方式 | B.②中合成氨属于人工固氮 |
C.除 外,①和④中均需还原剂参与 外,①和④中均需还原剂参与 | D.含氮有机物和含氮无机物可相互转化 |
(3)海洋生物参与氮循环的过程如图所示(其它含氮物质不参与反应).

您最近一年使用:0次



