1 . 叠氮化钠( )常用于汽车安全气囊的气源,工业上以
)常用于汽车安全气囊的气源,工业上以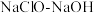 混合液和尿素
混合液和尿素 为原料,先制备水合肼(
为原料,先制备水合肼( ,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(
,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(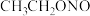 ,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
 )常用于汽车安全气囊的气源,工业上以
)常用于汽车安全气囊的气源,工业上以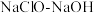 混合液和尿素
混合液和尿素 为原料,先制备水合肼(
为原料,先制备水合肼( ,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(
,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(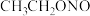 ,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
A.“反应器1”是将尿素溶液加入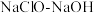 混合液中充分反应 混合液中充分反应 |
B.“余液”的主要成分可能是 、NaCl 、NaCl |
C.若“反应器2”中生成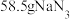 ,则转移电子的物质的量为3mol ,则转移电子的物质的量为3mol |
| D.实际工业生产中,“反应器2”应做冷却处理 |
您最近一年使用:0次
2 . 实验室用磷矿脱镁废液制备 的实验过程可表示为
的实验过程可表示为 及少量
及少量 、
、 、
、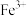 、
、 和
和 。
。
①向废液中加入 溶液调节
溶液调节 为
为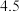 ,可达到
,可达到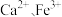 和
和 的最佳沉淀效果。其中
的最佳沉淀效果。其中 转化为
转化为 的离子方程式为
的离子方程式为_________ 。
②将除杂净化后的清液控制在一定温度,加入 浆液搅拌即可获得
浆液搅拌即可获得 固体。实验测得镁回收率、产品纯度与反应后溶液
固体。实验测得镁回收率、产品纯度与反应后溶液 关系如图所示。
关系如图所示。 小于6时,随着
小于6时,随着 增大,镁回收率上升,其原因是
增大,镁回收率上升,其原因是_______ 。 大于6时,随着
大于6时,随着 增大,产品纯度逐渐下降,其可能原因是
增大,产品纯度逐渐下降,其可能原因是_______ 。
(2)实验室用如下方案测定 产品(含有
产品(含有 杂质)的纯度:准确称取
杂质)的纯度:准确称取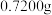 磷酸氢镁产品,加入足量稀硫酸溶解后配成
磷酸氢镁产品,加入足量稀硫酸溶解后配成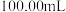 溶液。准确移取
溶液。准确移取 于锥形瓶中,用
于锥形瓶中,用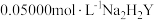 标准液滴定(离子方程式为
标准液滴定(离子方程式为 )至终点,平行滴定三次,平均消耗
)至终点,平行滴定三次,平均消耗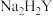 标准液
标准液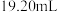 。计算该产品中
。计算该产品中 的纯度
的纯度_______ (写出计算过程)。
(3)恒温转化后的母液中主要含 和
和 。已知:水溶液中各含磷微粒的分布如图-2所示,
。已知:水溶液中各含磷微粒的分布如图-2所示, 和
和 的溶解度曲线如图-3所示;常温下
的溶解度曲线如图-3所示;常温下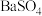 、
、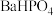 的溶度积常数依次为
的溶度积常数依次为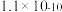 和
和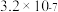 。请补充完整由恒温转化后的母液制备
。请补充完整由恒温转化后的母液制备 晶体的实验方案:用比浊法测定母液中
晶体的实验方案:用比浊法测定母液中 的浓度后,在搅拌下向一定体积的母液中
的浓度后,在搅拌下向一定体积的母液中_______ ,过滤、用无水乙醇洗涤,干燥。
 的实验过程可表示为
的实验过程可表示为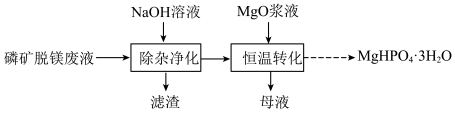
 及少量
及少量 、
、 、
、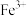 、
、 和
和 。
。①向废液中加入
 溶液调节
溶液调节 为
为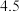 ,可达到
,可达到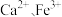 和
和 的最佳沉淀效果。其中
的最佳沉淀效果。其中 转化为
转化为 的离子方程式为
的离子方程式为②将除杂净化后的清液控制在一定温度,加入
 浆液搅拌即可获得
浆液搅拌即可获得 固体。实验测得镁回收率、产品纯度与反应后溶液
固体。实验测得镁回收率、产品纯度与反应后溶液 关系如图所示。
关系如图所示。 小于6时,随着
小于6时,随着 增大,镁回收率上升,其原因是
增大,镁回收率上升,其原因是
 大于6时,随着
大于6时,随着 增大,产品纯度逐渐下降,其可能原因是
增大,产品纯度逐渐下降,其可能原因是(2)实验室用如下方案测定
 产品(含有
产品(含有 杂质)的纯度:准确称取
杂质)的纯度:准确称取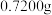 磷酸氢镁产品,加入足量稀硫酸溶解后配成
磷酸氢镁产品,加入足量稀硫酸溶解后配成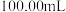 溶液。准确移取
溶液。准确移取 于锥形瓶中,用
于锥形瓶中,用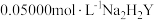 标准液滴定(离子方程式为
标准液滴定(离子方程式为 )至终点,平行滴定三次,平均消耗
)至终点,平行滴定三次,平均消耗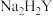 标准液
标准液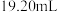 。计算该产品中
。计算该产品中 的纯度
的纯度(3)恒温转化后的母液中主要含
 和
和 。已知:水溶液中各含磷微粒的分布如图-2所示,
。已知:水溶液中各含磷微粒的分布如图-2所示, 和
和 的溶解度曲线如图-3所示;常温下
的溶解度曲线如图-3所示;常温下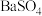 、
、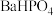 的溶度积常数依次为
的溶度积常数依次为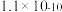 和
和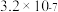 。请补充完整由恒温转化后的母液制备
。请补充完整由恒温转化后的母液制备 晶体的实验方案:用比浊法测定母液中
晶体的实验方案:用比浊法测定母液中 的浓度后,在搅拌下向一定体积的母液中
的浓度后,在搅拌下向一定体积的母液中
您最近一年使用:0次
3 . 工业上处理含铬( )酸性废水有多种方法,其中两种方法如下:
)酸性废水有多种方法,其中两种方法如下:
Ⅰ. 还原法:含铬酸性废水
还原法:含铬酸性废水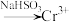 (含
(含 等)
等)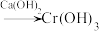 沉淀(含
沉淀(含 等沉淀)
等沉淀)
Ⅱ.电解法:含铬酸性废水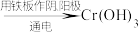 沉淀[含
沉淀[含 等沉淀]
等沉淀]
下列说法错误的是
 )酸性废水有多种方法,其中两种方法如下:
)酸性废水有多种方法,其中两种方法如下:Ⅰ.
 还原法:含铬酸性废水
还原法:含铬酸性废水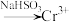 (含
(含 等)
等)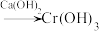 沉淀(含
沉淀(含 等沉淀)
等沉淀)Ⅱ.电解法:含铬酸性废水
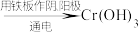 沉淀[含
沉淀[含 等沉淀]
等沉淀]下列说法错误的是
A. 和 和 中的S原子都采用 中的S原子都采用 杂化 杂化 |
B.Ⅰ和Ⅱ中,等量的 发生还原反应时消耗的 发生还原反应时消耗的 的量不同 的量不同 |
C.Ⅰ中参加反应的 |
D.Ⅱ中处理含 的废水转移6mol电子 的废水转移6mol电子 |
您最近一年使用:0次
4 . I.某些常见无机物质存在如图的化学转化关系(部分生成物和反应条件略去),回答下列问题:________ 。
(2)若甲是一种淡黄色固体,丙是一种温室气体,则X的化学式为________ ,当 甲和水生成乙和戊时,反应转移电子的物质的量为
甲和水生成乙和戊时,反应转移电子的物质的量为________ 。
(3)若甲是由两种常见的元素组成的化合物,乙是气体且水溶液呈碱性,X为大气中的一种主要成分,写出丁与水反应的化学方程式________ 。戊是氢氧化物,既能和强酸反应又能和强碱反应,则甲的化学式为________ 。
Ⅱ.固体化合物X由3种元素组成,其转化关系如图,混合气体经过无水 时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题:
时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题:____________ 。
(5)X的化学式为________ ,X能和浓盐酸反应生成黄绿色气体,X在反应中作________ (填“氧化剂”或“还原剂”),若反应了 ,该反应转移电子的个数为
,该反应转移电子的个数为________ 。
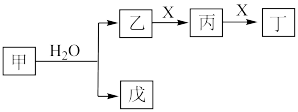
(2)若甲是一种淡黄色固体,丙是一种温室气体,则X的化学式为
 甲和水生成乙和戊时,反应转移电子的物质的量为
甲和水生成乙和戊时,反应转移电子的物质的量为(3)若甲是由两种常见的元素组成的化合物,乙是气体且水溶液呈碱性,X为大气中的一种主要成分,写出丁与水反应的化学方程式
Ⅱ.固体化合物X由3种元素组成,其转化关系如图,混合气体经过无水
 时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题:
时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题: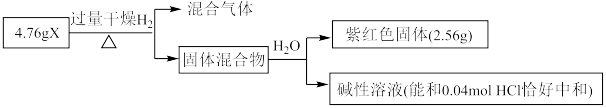
(5)X的化学式为
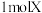 ,该反应转移电子的个数为
,该反应转移电子的个数为
您最近一年使用:0次
5 . 二氧化铈(CeO2)作为一种脱硝催化剂,能在Ce4+和Ce3+之间改变氧化状态,将NO氧化为NO2,并引起氧空位的形成,得到新的铈氧化物[Cex(Ⅲ)Cey(Ⅳ)Oz]。当二氧化铈晶胞发生如下图变化时,有关说法错误的是
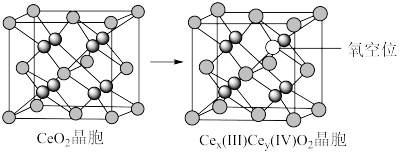
| A.铈位于氧原子形成的八面体空隙中 |
| B.生成新的铈氧化物中x、y、z的最简整数比为2:2:7,当1 mol CeO2发生变化时,可吸收标况下NO的体积为5.6 L |
C.晶胞的俯视图为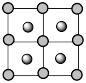 |
D.若晶胞边长为a pm,则CeO2晶体的密度为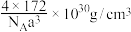 (NA表示阿伏加德罗常数的值) (NA表示阿伏加德罗常数的值) |
您最近一年使用:0次
名校
解题方法
6 . 乙醇是燃料,也是重要的有机化工原料,二氧化碳加氢还原制乙醇已成为研究热点,相关的反应如下:
反应i: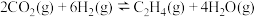
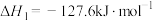
反应ii: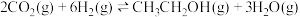
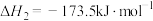
反应iii: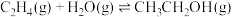
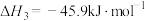
请回答下列问题:
(1)已知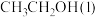 的燃烧热(
的燃烧热( )为
)为 ,表示
,表示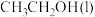 燃烧热的热化学方程式为
燃烧热的热化学方程式为________ 。
(2)在一定温度下,向2L恒容密闭容器中充入 和
和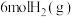 ,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如
,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如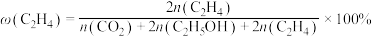 ]与时间的关系如图所示。
]与时间的关系如图所示。
①表示乙烯占比的曲线是________ (填“a”“b”或“c”)。
②若选择对反应i催化效果更好的催化剂,则A点可能移向________ (填“E”“E点上方”或“E点下方”)。
③已知C点、D点均为平衡点,则反应iii的平衡常数K=________ (保留小数点后一位)。
④设反应i和反应ii的化学平衡常数分别为 、
、 ,适当升温后,
,适当升温后,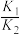
________ (填“增大”“减小”或“无法判断”),理由是________ 。
(3)近日,中国科学技术大学某课题组以Pd掺杂的 原子层为原型,在温和条件下,通过
原子层为原型,在温和条件下,通过 光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴(
光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴( )(
)(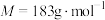 )在空气中受热时固体质量随温度变化的曲线如图所示。
)在空气中受热时固体质量随温度变化的曲线如图所示。________ ,CD段发生反应的化学方程式为________ 。
反应i:
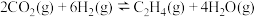
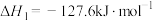
反应ii:
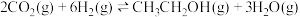
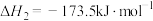
反应iii:
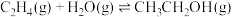
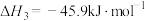
请回答下列问题:
(1)已知
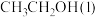 的燃烧热(
的燃烧热( )为
)为 ,表示
,表示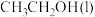 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)在一定温度下,向2L恒容密闭容器中充入
 和
和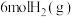 ,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如
,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如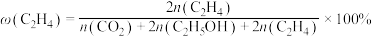 ]与时间的关系如图所示。
]与时间的关系如图所示。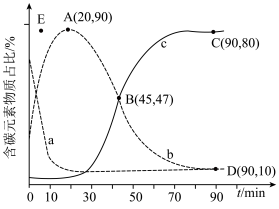
①表示乙烯占比的曲线是
②若选择对反应i催化效果更好的催化剂,则A点可能移向
③已知C点、D点均为平衡点,则反应iii的平衡常数K=
④设反应i和反应ii的化学平衡常数分别为
 、
、 ,适当升温后,
,适当升温后,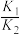
(3)近日,中国科学技术大学某课题组以Pd掺杂的
 原子层为原型,在温和条件下,通过
原子层为原型,在温和条件下,通过 光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴(
光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴( )(
)(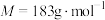 )在空气中受热时固体质量随温度变化的曲线如图所示。
)在空气中受热时固体质量随温度变化的曲线如图所示。
您最近一年使用:0次
名校
解题方法
7 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: ;
;
②室温下,部分离子浓度的对数 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: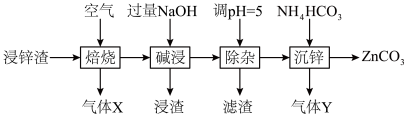
 ;
;②室温下,部分离子浓度的对数
 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):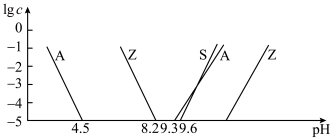
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近一年使用:0次
2024-05-17更新
|
209次组卷
|
2卷引用:云南省罗平第一中学2024年高三二模考试化学试题
8 . 二维磁性材料卤化铬 混合晶体结构如图,在纯氧中发生光氧化反应生成长链状
混合晶体结构如图,在纯氧中发生光氧化反应生成长链状 和
和 。下列说法错误的是
。下列说法错误的是
 混合晶体结构如图,在纯氧中发生光氧化反应生成长链状
混合晶体结构如图,在纯氧中发生光氧化反应生成长链状 和
和 。下列说法错误的是
。下列说法错误的是
A.化学键中离子键成分百分数: |
B. |
| C.生成1mol X―X键转移3mol电子 |
D.熔点: |
您最近一年使用:0次
9 . 某小组进行“反应物浓度对反应速率影响”实验研究。分别取 不同浓度的葡萄糖溶液和
不同浓度的葡萄糖溶液和 溶液于试管中,再依次向试管中滴加
溶液于试管中,再依次向试管中滴加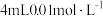 酸性
酸性 溶液,通过色度计监测溶液透光率随时间的变化关系。实验结果如图所示。
溶液,通过色度计监测溶液透光率随时间的变化关系。实验结果如图所示。
(2)酸性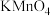 溶液与
溶液与 溶液反应时,某种历程可表示如图。
溶液反应时,某种历程可表示如图。不合理 的是
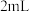 不同浓度的葡萄糖溶液和
不同浓度的葡萄糖溶液和 溶液于试管中,再依次向试管中滴加
溶液于试管中,再依次向试管中滴加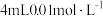 酸性
酸性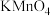 溶液,通过色度计监测溶液透光率随时间的变化关系。实验结果如图所示。
溶液,通过色度计监测溶液透光率随时间的变化关系。实验结果如图所示。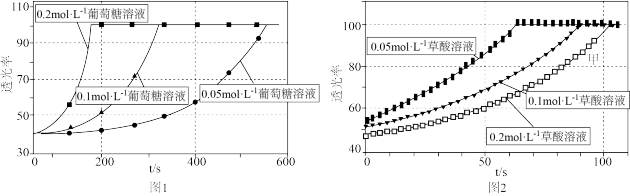
(2)酸性
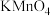 溶液与
溶液与 溶液反应时,某种历程可表示如图。
溶液反应时,某种历程可表示如图。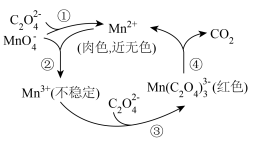
| A.从图1可知,该实验条件下,葡萄糖溶液浓度越大,反应速率越大 |
B.理论上, 和 和 的反应中参与反应的 的反应中参与反应的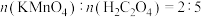 |
| C.图2中曲线甲反应速率加快的原因可能与反应生成有催化作用的物质有关 |
D.图2中 溶液浓度不同时,数据呈现的原因是:随 溶液浓度不同时,数据呈现的原因是:随 浓度增大,反应历程中①、②、③、④速率均减小 浓度增大,反应历程中①、②、③、④速率均减小 |
您最近一年使用:0次
名校
解题方法
10 . 我国最新型055型万吨驱逐舰上使用了最新一代国产有源相控阵雷达,采用了最先进的氮化镓( )半导体技术。某工厂利用铝土矿(主要成分为
)半导体技术。某工厂利用铝土矿(主要成分为 、
、 、
、 )为原料制备
)为原料制备 的流程如下图所示。已知镓与铝同主族,其氧化物和氢氧化物均为两性化合物,能与强酸、强碱溶液反应,
的流程如下图所示。已知镓与铝同主族,其氧化物和氢氧化物均为两性化合物,能与强酸、强碱溶液反应, 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是
 )半导体技术。某工厂利用铝土矿(主要成分为
)半导体技术。某工厂利用铝土矿(主要成分为 、
、 、
、 )为原料制备
)为原料制备 的流程如下图所示。已知镓与铝同主族,其氧化物和氢氧化物均为两性化合物,能与强酸、强碱溶液反应,
的流程如下图所示。已知镓与铝同主族,其氧化物和氢氧化物均为两性化合物,能与强酸、强碱溶液反应, 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是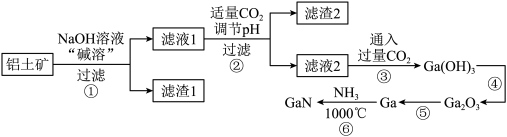
| A.可以通过粉碎铝土矿、搅拌等方法提高“碱溶”效率 |
B.由过程②、③可知,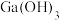 的酸性比 的酸性比 强 强 |
C.已知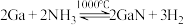 , , 与足量 与足量 反应,转移电子数为 反应,转移电子数为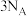 |
D.滤渣1是 ,生成滤渣2的离子方程式可能为 ,生成滤渣2的离子方程式可能为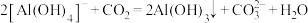 |
您最近一年使用:0次
2024-05-12更新
|
217次组卷
|
2卷引用:安徽师范大学附属中学2024届高三下学期5月测试化学试卷



