名校
1 . 以铝土矿(主要成分为 ,含
,含 和
和 等杂质)为原料制备铝的一种工艺流程如下:
等杂质)为原料制备铝的一种工艺流程如下: 在“碱溶”时转化为铝硅酸钠沉淀
在“碱溶”时转化为铝硅酸钠沉淀
②电解时,阳极发生氧化反应
下列说法正确的是
 ,含
,含 和
和 等杂质)为原料制备铝的一种工艺流程如下:
等杂质)为原料制备铝的一种工艺流程如下: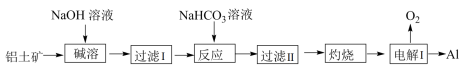
 在“碱溶”时转化为铝硅酸钠沉淀
在“碱溶”时转化为铝硅酸钠沉淀②电解时,阳极发生氧化反应
下列说法正确的是
A.“碱溶”时生成偏铝酸钠的离子方程式为 |
B.“过滤Ⅰ”的滤渣成分为 |
C.“反应”中加入 溶液的作用同于通入 溶液的作用同于通入 |
| D.“电解Ⅰ”中作阳极的石墨易消枆,阳极反应中失电子物质主要是石墨 |
您最近一年使用:0次
名校
解题方法
2 . 钨在自然界的储量只有620万吨,江西独占有520万吨。江西每年产生大量的钨冶炼渣(主要含SiO2、MnO2、Al2O3、CaO、MgO、FeO、Fe2O3以及少量重金属氧化物等),以钨冶炼渣为原料,提炼制备电池级硫酸锰的工艺流程如下: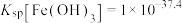 ,
, 。
。
(1)“酸浸”时,为提高锰的浸出率,可采取的措施是_______ (写一种即可),滤渣1的主要成分为SiO2、_______ (填化学式)。
(2)酸浸后所得浸出液中金属阳离子包括Mn2+,写出生成Mn2+的离子方程式_______ 。
(3)若要使 和
和 沉淀完全,则需调节溶液的pH最小值为
沉淀完全,则需调节溶液的pH最小值为_______ 。
(4)滤渣3的主要成分是CaF2和_______ 。
(5)加MnS的目的是_______ 。
(6)如图为MnSO4溶解度曲线。从MnSO4溶液中提取MnSO4晶体的操作为_______ , _______ ,洗涤,干燥,碾磨,即得到了电池级硫酸锰。
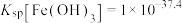 ,
,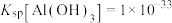 。
。(1)“酸浸”时,为提高锰的浸出率,可采取的措施是
(2)酸浸后所得浸出液中金属阳离子包括Mn2+,写出生成Mn2+的离子方程式
(3)若要使
 和
和 沉淀完全,则需调节溶液的pH最小值为
沉淀完全,则需调节溶液的pH最小值为(4)滤渣3的主要成分是CaF2和
(5)加MnS的目的是
(6)如图为MnSO4溶解度曲线。从MnSO4溶液中提取MnSO4晶体的操作为

您最近一年使用:0次
名校
3 .  (亚硝酸钙)广泛应用于钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂。
(亚硝酸钙)广泛应用于钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂。
(1)用石灰乳吸收硝酸工业尾气中 、
、 ,既能获得
,既能获得 ,亦能净化尾气。
,亦能净化尾气。
① 和
和 与石灰乳生成
与石灰乳生成 的化学方程式为
的化学方程式为_______ 。
②下列措施能提高尾气中 和
和 去除率的有
去除率的有_______ (填字母)
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量石灰乳
③吸收后经处理得到 晶体,该晶体的主要杂质是
晶体,该晶体的主要杂质是_______ (填化学式);吸收后排放的尾气含量较高的氮氧化物是_______ (填化学式)。
(2)实验室可用反应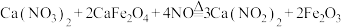 制备
制备 ,该反应中氧化产物与还原产物的物质的量之比为
,该反应中氧化产物与还原产物的物质的量之比为_______ 。对于 硫酸和硝酸的混合溶液,若硫酸和硝酸的物质的量浓度存在如下关系:
硫酸和硝酸的混合溶液,若硫酸和硝酸的物质的量浓度存在如下关系: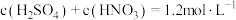 ,则理论上最多能溶解的铜的物质的量为
,则理论上最多能溶解的铜的物质的量为_______  .
.
 (亚硝酸钙)广泛应用于钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂。
(亚硝酸钙)广泛应用于钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂。(1)用石灰乳吸收硝酸工业尾气中
 、
、 ,既能获得
,既能获得 ,亦能净化尾气。
,亦能净化尾气。①
 和
和 与石灰乳生成
与石灰乳生成 的化学方程式为
的化学方程式为②下列措施能提高尾气中
 和
和 去除率的有
去除率的有A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量石灰乳
③吸收后经处理得到
 晶体,该晶体的主要杂质是
晶体,该晶体的主要杂质是(2)实验室可用反应
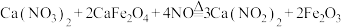 制备
制备 ,该反应中氧化产物与还原产物的物质的量之比为
,该反应中氧化产物与还原产物的物质的量之比为 硫酸和硝酸的混合溶液,若硫酸和硝酸的物质的量浓度存在如下关系:
硫酸和硝酸的混合溶液,若硫酸和硝酸的物质的量浓度存在如下关系: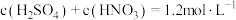 ,则理论上最多能溶解的铜的物质的量为
,则理论上最多能溶解的铜的物质的量为 .
.
您最近一年使用:0次
名校
4 . 金属钴常见化合价有 、
、 等,对应的化合物性质也各有差异。
等,对应的化合物性质也各有差异。
(1)利用钴渣(主要含金属钴,还含有铜、铁等金属)可富集钴,流程如下:_____________ ;“氧化除铁”的化学反应方程式为______________ ;在碱性环境下氧化性
_______  。(填“>”或“<”或“=”)。
。(填“>”或“<”或“=”)。
② 的结构如图所示,用“□”标识出
的结构如图所示,用“□”标识出 中体现强氧化性的基团:
中体现强氧化性的基团:__________ 。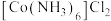 }溶液可用于脱除烟气中的NO,用活性炭作催化剂、水作还原剂可实现
}溶液可用于脱除烟气中的NO,用活性炭作催化剂、水作还原剂可实现 的再生,维持溶液脱除NO的能力,可能机理如图所示。
的再生,维持溶液脱除NO的能力,可能机理如图所示。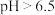 时带负电荷,pH越高,表面所带负电荷越多:
时带负电荷,pH越高,表面所带负电荷越多: 时带正电荷,pH越低,表面所带正电荷越多。
时带正电荷,pH越低,表面所带正电荷越多。
①由步骤(ⅱ)可知活性炭表面有大量的__________ (填“酸性”或“碱性”)基团。
②写出步骤(ⅲ)的离子反应方程式:__________ 。
③一定温度下,pH对再生反应的影响如题图所示。pH在3.5到6.5之间,反应相同时间, 的转化率随温度的升高而增大,可能的原因是
的转化率随温度的升高而增大,可能的原因是__________ 。
 、
、 等,对应的化合物性质也各有差异。
等,对应的化合物性质也各有差异。(1)利用钴渣(主要含金属钴,还含有铜、铁等金属)可富集钴,流程如下:
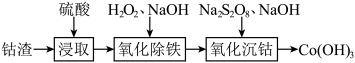

 。(填“>”或“<”或“=”)。
。(填“>”或“<”或“=”)。②
 的结构如图所示,用“□”标识出
的结构如图所示,用“□”标识出 中体现强氧化性的基团:
中体现强氧化性的基团:
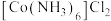 }溶液可用于脱除烟气中的NO,用活性炭作催化剂、水作还原剂可实现
}溶液可用于脱除烟气中的NO,用活性炭作催化剂、水作还原剂可实现 的再生,维持溶液脱除NO的能力,可能机理如图所示。
的再生,维持溶液脱除NO的能力,可能机理如图所示。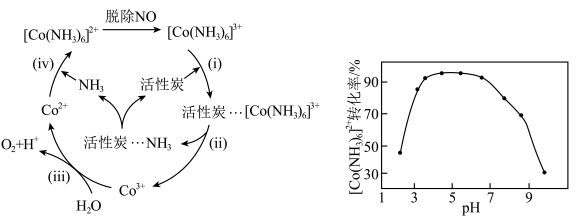
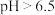 时带负电荷,pH越高,表面所带负电荷越多:
时带负电荷,pH越高,表面所带负电荷越多: 时带正电荷,pH越低,表面所带正电荷越多。
时带正电荷,pH越低,表面所带正电荷越多。①由步骤(ⅱ)可知活性炭表面有大量的
②写出步骤(ⅲ)的离子反应方程式:
③一定温度下,pH对再生反应的影响如题图所示。pH在3.5到6.5之间,反应相同时间,
 的转化率随温度的升高而增大,可能的原因是
的转化率随温度的升高而增大,可能的原因是
您最近一年使用:0次
名校
5 . SO2、NOx为常见的空气污染物,会引起酸雨、光化学烟雾等污染问题。研究者以多种方法进行“脱硫”“脱硝”。
(1)利用工业废碱渣(主要成分为Na2CO3)来吸收含SO2的烟气,同时得到Na2SO3粗品。其流程如图所示:___________ ;
②SO2被Na2CO3溶液吸收时,会释放出一种无色无味气体,该反应的离子方程式为___________ 。
(2)利用含有SO2的烟气制备NaClO2。其流程如图所示:___________ 。
②反应b中的氧化剂和还原剂的物质的量之比为___________ 。
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”“脱硝”。控制溶液的pH=5.5,一定时间内,温度对SO2、NO脱除率的影响如图所示: 、NO
、NO 。
。
①NO在吸收过程中,反应的离子方程式是___________ 。
②50℃时,吸收液中烟气转化生成的Cl‒和NO 的物质的量之比为
的物质的量之比为___________ 。
③烟气中NOx含量的测定:将VL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO ,加水稀释至100mL。量取25mL该溶液,加入V1mLc1mol·L‒1FeSO4溶液(过量),充分反应后,用c2mol·L‒1K2Cr2O7溶液和剩余的Fe2+恰好反应(该反应的还原产物为Cr3+),消耗V2mL。气样中NOx折合成NO的含量为
,加水稀释至100mL。量取25mL该溶液,加入V1mLc1mol·L‒1FeSO4溶液(过量),充分反应后,用c2mol·L‒1K2Cr2O7溶液和剩余的Fe2+恰好反应(该反应的还原产物为Cr3+),消耗V2mL。气样中NOx折合成NO的含量为___________ mg·L‒1。
(1)利用工业废碱渣(主要成分为Na2CO3)来吸收含SO2的烟气,同时得到Na2SO3粗品。其流程如图所示:
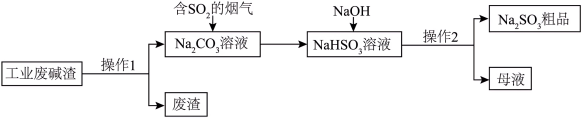
②SO2被Na2CO3溶液吸收时,会释放出一种无色无味气体,该反应的离子方程式为
(2)利用含有SO2的烟气制备NaClO2。其流程如图所示:
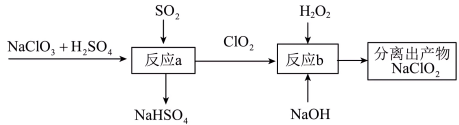
②反应b中的氧化剂和还原剂的物质的量之比为
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”“脱硝”。控制溶液的pH=5.5,一定时间内,温度对SO2、NO脱除率的影响如图所示:
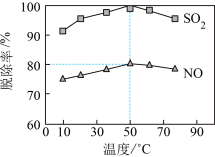
 、NO
、NO 。
。①NO在吸收过程中,反应的离子方程式是
②50℃时,吸收液中烟气转化生成的Cl‒和NO
 的物质的量之比为
的物质的量之比为③烟气中NOx含量的测定:将VL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO
 ,加水稀释至100mL。量取25mL该溶液,加入V1mLc1mol·L‒1FeSO4溶液(过量),充分反应后,用c2mol·L‒1K2Cr2O7溶液和剩余的Fe2+恰好反应(该反应的还原产物为Cr3+),消耗V2mL。气样中NOx折合成NO的含量为
,加水稀释至100mL。量取25mL该溶液,加入V1mLc1mol·L‒1FeSO4溶液(过量),充分反应后,用c2mol·L‒1K2Cr2O7溶液和剩余的Fe2+恰好反应(该反应的还原产物为Cr3+),消耗V2mL。气样中NOx折合成NO的含量为
您最近一年使用:0次
2024-04-27更新
|
330次组卷
|
3卷引用:北师大附属实验中学2023-2024学年度第二学期期中试卷
北师大附属实验中学2023-2024学年度第二学期期中试卷北京师范大学附属实验中学2023-2024学年高一下学期期中考试化学试题(已下线)期末押题卷02-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)
名校
解题方法
6 . 某课外小组探究Cu(Ⅱ)盐与Na2S2O3溶液的反应。
【查阅资料】
ⅰ. 2 +Cu2+
+Cu2+ [Cu(S2O3)2]2-(绿色),2
[Cu(S2O3)2]2-(绿色),2 +Cu+
+Cu+ [Cu(S2O3)2]3-(无色):
[Cu(S2O3)2]3-(无色):
ⅱ. 2NH3+Cu+ [Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
[Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
ⅲ. 易被氧化为
易被氧化为 或
或 。
。
【猜想假设】
同学们根据资料认为Cu(Ⅱ)盐与Na2S2O3可能会发生两种反应:
假设1:Cu2+与 在溶液中发生配合反应生成[Cu(S2O3)2]2-;
在溶液中发生配合反应生成[Cu(S2O3)2]2-;
假设2:Cu(Ⅱ)有氧化性,Cu2+与 在溶液中发生氧化还原反应。
在溶液中发生氧化还原反应。
【实验操作及现象分析】
实验一:探究CuSO4与Na2S2O3溶液的反应。
(1)根据实验a的现象可推测溶液中生成的含Cu微粒是___________ (填化学式)。
(2)甲同学认为实验一可证明假设2成立,他的理由是___________ 。
实验二:探究CuCl2与Na2S2O3的反应。___________ (补全实验方案),则说明含Cu(Ⅰ)。
(4)经检验白色沉淀中含CuCl,请写出继续加Na2S2O3溶液后CuCl沉淀溶解的离子方程式:___________ 。
(5)经检验氧化产物以 形式存在,写出Cu2+与
形式存在,写出Cu2+与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:___________ 。
【获得结论】
(6)综合以上实验,同学们认为Cu(Ⅱ)盐与Na2S2O3在溶液中的反应与多种因素有关,得到实验结论,选择合适的选项填入下面的横线中。
A配合反应 B.氧化还原反应 C.置换反应 D.复分解反应
①随n( ):n(Cu2+)的增大,二者发生
):n(Cu2+)的增大,二者发生___________ 的趋势减弱;
②Cu(Ⅱ)盐的阴离子为Cl-时能增大Cu2+和 发生
发生___________ 的趋势。
【查阅资料】
ⅰ. 2
 +Cu2+
+Cu2+ [Cu(S2O3)2]2-(绿色),2
[Cu(S2O3)2]2-(绿色),2 +Cu+
+Cu+ [Cu(S2O3)2]3-(无色):
[Cu(S2O3)2]3-(无色):ⅱ. 2NH3+Cu+
 [Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
[Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);ⅲ.
 易被氧化为
易被氧化为 或
或 。
。【猜想假设】
同学们根据资料认为Cu(Ⅱ)盐与Na2S2O3可能会发生两种反应:
假设1:Cu2+与
 在溶液中发生配合反应生成[Cu(S2O3)2]2-;
在溶液中发生配合反应生成[Cu(S2O3)2]2-;假设2:Cu(Ⅱ)有氧化性,Cu2+与
 在溶液中发生氧化还原反应。
在溶液中发生氧化还原反应。【实验操作及现象分析】
实验一:探究CuSO4与Na2S2O3溶液的反应。
| 实验操作 | 实验序号 | V1(mL) | V2(mL) | 逐滴加入Na2S2O3溶液时的实验现象 |
| a | 1.5 | 0.5 | 溶液逐渐变为绿色,静置无变化 |
| b | 1.0 | 1.0 | 溶液先变为绿色,后逐渐变成浅绿色,静置无变化 | |
| c | 0 | 2.0 | 溶液先变为绿色,后逐渐变浅至无色,静置无变化 |
(1)根据实验a的现象可推测溶液中生成的含Cu微粒是
(2)甲同学认为实验一可证明假设2成立,他的理由是
实验二:探究CuCl2与Na2S2O3的反应。
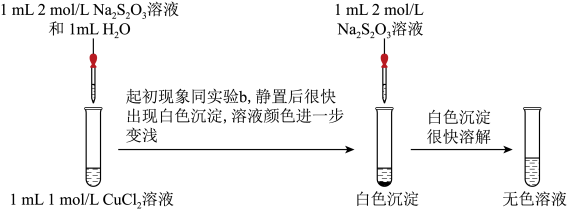
(4)经检验白色沉淀中含CuCl,请写出继续加Na2S2O3溶液后CuCl沉淀溶解的离子方程式:
(5)经检验氧化产物以
 形式存在,写出Cu2+与
形式存在,写出Cu2+与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:【获得结论】
(6)综合以上实验,同学们认为Cu(Ⅱ)盐与Na2S2O3在溶液中的反应与多种因素有关,得到实验结论,选择合适的选项填入下面的横线中。
A配合反应 B.氧化还原反应 C.置换反应 D.复分解反应
①随n(
 ):n(Cu2+)的增大,二者发生
):n(Cu2+)的增大,二者发生②Cu(Ⅱ)盐的阴离子为Cl-时能增大Cu2+和
 发生
发生
您最近一年使用:0次
名校
解题方法
7 . 电池有铅蓄电池、燃料电池(如NO2NH3电池)、锂离子电池、Mg—次氯酸盐电池等,它们可以将化学能转化为电能。NH3、CH4、NaBH4都可用作燃料电池的燃料。CH4的燃烧热为890.3kJ•mol-1。电解则可以将电能转化为化学能,电解饱和NaCl溶液可以得到Cl2,用电解法可制备消毒剂高铁酸钠(Na2FeO4)。下列化学反应表示正确的是
A.铅蓄电池的正极反应:Pb-2e-+SO =PbSO4 =PbSO4 |
B.电解饱和NaCl溶液:2Na++2Cl- 2Na+Cl2↑ 2Na+Cl2↑ |
| C.CH4燃烧:CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=-890.3kJ•mol-1 |
D.一定条件下NO2与NH3的反应:6NO2+8NH3 7N2+12H2O 7N2+12H2O |
您最近一年使用:0次
2024-03-21更新
|
91次组卷
|
2卷引用:江苏省泰州中学2023-2024学年高二下学期5月期中考试化学试题
名校
8 . 氧化还原反应在人类的生产、生活中有着重要的应用。回答下列问题:
(1)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭按一定比例混合而成的,爆炸时发生的反应为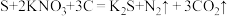 。该反应中,被还原的元素是
。该反应中,被还原的元素是________ (填元素符号),消耗的还原剂和氧化剂质量比为_________ 。
(2)实验室制备Cl2有三种常用方法:
a.
b.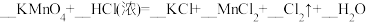
c.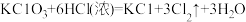
①配平反应b的方程式:___________ 。
②当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是反应_____ (填“a”“b”或“c”)。
(3)以MnO2为原料在加热熔融条件下可以制取K2MnO4,该反应中包含的所有物质为MnO2、K2 MnO4、KCl、KOH、KClO3、H2O。写出该反应的化学方程式:___________ 。
(4)油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3,As为+3价,S为-2价)褪色的主要原因是发生了以下两种化学反应:
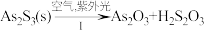 ,
,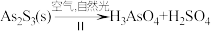 。则反应I和Ⅱ中氧化相同量的As2S3,消耗O2与H2O的化学计量数之比:I
。则反应I和Ⅱ中氧化相同量的As2S3,消耗O2与H2O的化学计量数之比:I______ Ⅱ(填“>”“<”或“=”),转移的电子数之比为_______ 。
(1)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭按一定比例混合而成的,爆炸时发生的反应为
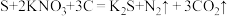 。该反应中,被还原的元素是
。该反应中,被还原的元素是(2)实验室制备Cl2有三种常用方法:
a.

b.
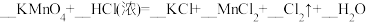
c.
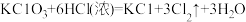
①配平反应b的方程式:
②当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是反应
(3)以MnO2为原料在加热熔融条件下可以制取K2MnO4,该反应中包含的所有物质为MnO2、K2 MnO4、KCl、KOH、KClO3、H2O。写出该反应的化学方程式:
(4)油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3,As为+3价,S为-2价)褪色的主要原因是发生了以下两种化学反应:
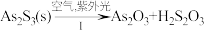 ,
,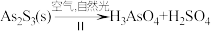 。则反应I和Ⅱ中氧化相同量的As2S3,消耗O2与H2O的化学计量数之比:I
。则反应I和Ⅱ中氧化相同量的As2S3,消耗O2与H2O的化学计量数之比:I
您最近一年使用:0次
9 . 某小组同学探究不同条件下氯气与二价锰化合物的反应
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ii.浓碱条件下, 可被OH-还原为
可被OH-还原为 。
。
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)
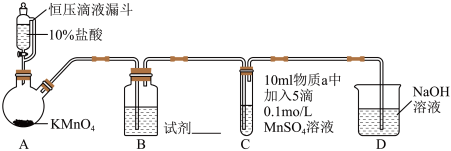
(1)实验室中利用MnO2和浓盐酸加热的反应来制取氯气,对比本实验A中的反应,说明氧化性MnO2_______ KMnO4(填“>”或“<”)。
(2)B中试剂是_______ 。(填序号)
①浓硫酸 ②饱和食盐水
(3)通入Cl2前,Ⅱ、Ⅲ中沉淀由白色[Mn(OH)2]变为棕黑色,补全发生反应的化学方程式:___________ 。
Mn(OH)2+_______=________+H2O
(4)对比实验I、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是:
①__________ ;
②在碱性条件下可以被氧化到更高价态。
(5)根据资料ii,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因___________ ,但通过实验测定,溶液的碱性变化很小。
②针对原因二小组同学做如下探究:
Ⅳ中溶液紫色迅速变为绿色的离子方程式为_________ 。
 +OH-=
+OH-= +___________+___________。
+___________+___________。
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、
 (绿色)、
(绿色)、 (紫色)。
(紫色)。ii.浓碱条件下,
 可被OH-还原为
可被OH-还原为 。
。iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)

| 序号 | I | Ⅱ | Ⅲ |
| 物质a | 水 | 5%NaOH溶液 | 40%NaOH溶液 |
| 通入Cl2前 C中实验现象 | 得到无色溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 |
| 通入Cl2后 C中实验现象 | 产生棕黑色沉淀,且放置后不发生变化 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(1)实验室中利用MnO2和浓盐酸加热的反应来制取氯气,对比本实验A中的反应,说明氧化性MnO2
(2)B中试剂是
①浓硫酸 ②饱和食盐水
(3)通入Cl2前,Ⅱ、Ⅲ中沉淀由白色[Mn(OH)2]变为棕黑色,补全发生反应的化学方程式:
Mn(OH)2+_______=________+H2O
(4)对比实验I、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是:
①
②在碱性条件下可以被氧化到更高价态。
(5)根据资料ii,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①用化学方程式表示可能导致溶液碱性减弱的原因
②针对原因二小组同学做如下探究:
| 序号 | Ⅳ | Ⅴ |
| 操作 | 取Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液 | 取Ⅲ中放置后的1mL悬浊液,加入4mL水, |
| 现象 | 溶液紫色迅速变为绿色,且绿色缓慢加深 | 溶液紫色缓慢加深 |
 +OH-=
+OH-= +___________+___________。
+___________+___________。
您最近一年使用:0次
2022·北京·高考真题
10 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
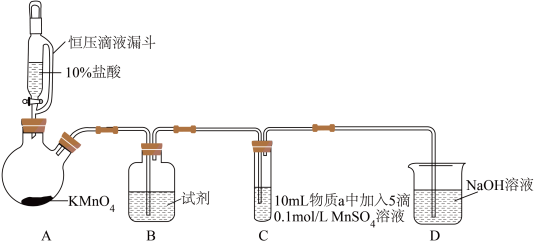
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
2023-11-29更新
|
881次组卷
|
29卷引用:北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题
北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题(已下线)2022年北京市高考真题化学试题(部分试题)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题2022年北京市高考真题化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)2022年北京高考真题变式题1-14(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)2022年北京高考真题化学试题变式题(实验探究题)(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)北京一零一中学2023-2024学年高三上学期11月统练五化学试题(已下线)微专题 物质性质综合实验探究北京市日坛中学2023-2024学年高三上学期10月检测化学试题江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题




