名校
1 . 已知某反应的反应物与生成物为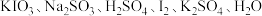 和未知物X,其中
和未知物X,其中 是反应物之一,下列说法错误的是
是反应物之一,下列说法错误的是
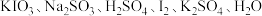 和未知物X,其中
和未知物X,其中 是反应物之一,下列说法错误的是
是反应物之一,下列说法错误的是A.未知物X为 | B.该反应的氧化剂是 |
C.还原性: | D.该反应中, 发生氧化反应 发生氧化反应 |
您最近一年使用:0次
名校
2 . 某化学自主实验小组通过实验探究 、
、 的性质。
的性质。
探究Ⅰ:利用如图所示装置探究 能否被
能否被 还原(
还原( 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。 的化学方程式是
的化学方程式是___________ 。
(2)甲、乙分别是___________ (填字母)。
a.浓硫酸、碱石灰 b.碱石灰、碱石灰
c.碱石灰、无水氯化钙 d.五氧化二磷、五氧化二磷
(3)若 能够被
能够被 还原,预期C装置中能观察到的现象是
还原,预期C装置中能观察到的现象是___________ 。
(4)此实验装置存在一个明显的缺陷是___________ 。
探究Ⅱ:探究 、
、 混合气体的喷泉实验。
混合气体的喷泉实验。___________ 。
(6)G装置中浓硫酸有三种作用:混合 、
、 气体;干燥
气体;干燥 、
、 ;
;___________ 。
(7)将G装置上面的圆底烧瓶收集满气体进行喷泉实验,若混合气体全部被吸收,则所得溶液物质的量浓度为___________  (标准状况下,保留两位有效数字)。
(标准状况下,保留两位有效数字)。
 、
、 的性质。
的性质。探究Ⅰ:利用如图所示装置探究
 能否被
能否被 还原(
还原( 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。
 的化学方程式是
的化学方程式是(2)甲、乙分别是
a.浓硫酸、碱石灰 b.碱石灰、碱石灰
c.碱石灰、无水氯化钙 d.五氧化二磷、五氧化二磷
(3)若
 能够被
能够被 还原,预期C装置中能观察到的现象是
还原,预期C装置中能观察到的现象是(4)此实验装置存在一个明显的缺陷是
探究Ⅱ:探究
 、
、 混合气体的喷泉实验。
混合气体的喷泉实验。
(6)G装置中浓硫酸有三种作用:混合
 、
、 气体;干燥
气体;干燥 、
、 ;
;(7)将G装置上面的圆底烧瓶收集满气体进行喷泉实验,若混合气体全部被吸收,则所得溶液物质的量浓度为
 (标准状况下,保留两位有效数字)。
(标准状况下,保留两位有效数字)。
您最近一年使用:0次
2023-12-26更新
|
248次组卷
|
4卷引用:甘肃省武威市银科致远补习学校2023-2024学年高三上学期第三次调研化学试题
解题方法
3 . 由软锰矿(主要成分为MnO2,含有少量CaO、MgO)制备MnO2的工艺流程如下:
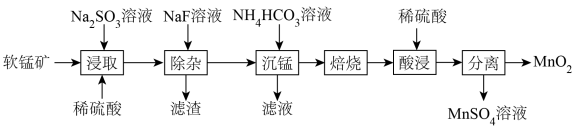
已知:“沉锰”所得MnCO3在空气中“焙烧”时转化为MnO2、Mn2O3、MnO的混合物。
回答下列问题:
(1)基态Mn的价电子排布式为_______ 。
(2)加快“浸取”速率可采取的措施为_______ (答出一种方法即可);“滤渣”的主要成分为_______ 。
(3)“浸取”步骤中发生的氧化还原反应的化学方程式为_______ 。
(4)可用惰性电极电解MnSO4溶液的方法制取MnO2,写出阳极的电极反应式:_______ 。
(5)① 、
、 两种离子的中心原子杂化方式分别为
两种离子的中心原子杂化方式分别为_______ 、_______ 。
②MgO的晶体结构与MnO的晶体结构相似,但MgO熔点高于MnO的熔点,其原因是_______ 。
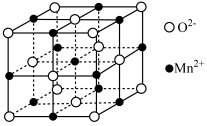
③MnO晶胞结构如图所示,平均每个晶胞中 组成的正四面体空隙有
组成的正四面体空隙有_______ 个,2个 之间的最近距离为acm,则MnO晶体的密度为
之间的最近距离为acm,则MnO晶体的密度为 =
=_______ g·cm-3。

已知:“沉锰”所得MnCO3在空气中“焙烧”时转化为MnO2、Mn2O3、MnO的混合物。
回答下列问题:
(1)基态Mn的价电子排布式为
(2)加快“浸取”速率可采取的措施为
(3)“浸取”步骤中发生的氧化还原反应的化学方程式为
(4)可用惰性电极电解MnSO4溶液的方法制取MnO2,写出阳极的电极反应式:
(5)①
 、
、 两种离子的中心原子杂化方式分别为
两种离子的中心原子杂化方式分别为②MgO的晶体结构与MnO的晶体结构相似,但MgO熔点高于MnO的熔点,其原因是
③MnO晶胞结构如图所示,平均每个晶胞中
 组成的正四面体空隙有
组成的正四面体空隙有 之间的最近距离为acm,则MnO晶体的密度为
之间的最近距离为acm,则MnO晶体的密度为 =
=
您最近一年使用:0次
2023-12-08更新
|
293次组卷
|
2卷引用:甘肃省平凉市静宁县文萃中学2023-2024学年高三上学期第三次模拟考试化学试题
4 . 少量 与
与 溶液能发生如下反应:
溶液能发生如下反应: (方程式未配平),设
(方程式未配平),设 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是
A.1L 1  溶液含 溶液含 的数目为2 的数目为2 | B.1mol  可制得 可制得 的胶粒数为 的胶粒数为 |
C.78g  含有共价键的数目为 含有共价键的数目为 | D.每生成1mol X,转移的电子数为 |
您最近一年使用:0次
2023-12-01更新
|
166次组卷
|
6卷引用:广东省东莞市部分名校高三上(9月联考)-化学试题
名校
5 . 碳酸亚铁晶体[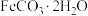 为白色固体,不溶于水,干燥品在空气中稳定、湿品在空气中缓慢氧化为
为白色固体,不溶于水,干燥品在空气中稳定、湿品在空气中缓慢氧化为 呈茶色]可用作阻燃剂、动物饲料铁添加剂、补血剂等。回答下列问题:
呈茶色]可用作阻燃剂、动物饲料铁添加剂、补血剂等。回答下列问题:
(1)实验室利用 溶液和
溶液和 溶液制备
溶液制备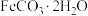 ,实验装置(夹持仪器已省略)如图所示:
,实验装置(夹持仪器已省略)如图所示:

①方框内为制取 的装置,下列装置和药品较为适宜的是
的装置,下列装置和药品较为适宜的是_____ (填字母)。
A.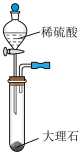 B.
B.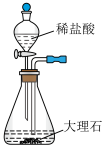 C.
C.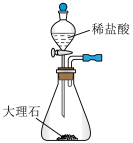 D.
D.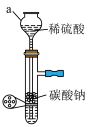 E.
E.
②装置D中仪器a的名称是_____ 。
③根据①的选择,装置甲中试剂a的名称是_____ 。
(2) 的制备,步骤如下:
的制备,步骤如下:
通入一段时间 后,向
后,向 溶液中加入过量
溶液中加入过量 溶液,搅拌,反应后过滤,将沉淀洗涤、干燥,得到
溶液,搅拌,反应后过滤,将沉淀洗涤、干燥,得到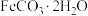 。
。
①生成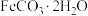 的离子方程式为
的离子方程式为_____ 。
②装置丙的作用是_____ 。
(3)某同学查阅资料得知,煅烧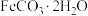 的产物中含有
的产物中含有 价铁元素,于是他设计了由
价铁元素,于是他设计了由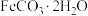 制备
制备 的方案。先向
的方案。先向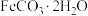 中依次加入试剂:稀硫酸、
中依次加入试剂:稀硫酸、_____ 和_____ ;然后再_____ (填操作)、灼烧,即可得到 。
。
(4)草酸亚铁和碳酸亚铁晶体均能受热分解。称取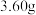
 ,用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示。
,用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示。
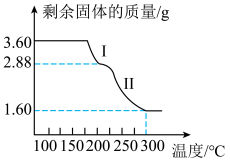
①过程Ⅰ发生反应的化学方程式为_____ 。
②300℃时剩余固体只有一种且是铁的氧化物,则其化学式为_____ 。
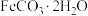 为白色固体,不溶于水,干燥品在空气中稳定、湿品在空气中缓慢氧化为
为白色固体,不溶于水,干燥品在空气中稳定、湿品在空气中缓慢氧化为 呈茶色]可用作阻燃剂、动物饲料铁添加剂、补血剂等。回答下列问题:
呈茶色]可用作阻燃剂、动物饲料铁添加剂、补血剂等。回答下列问题:(1)实验室利用
 溶液和
溶液和 溶液制备
溶液制备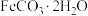 ,实验装置(夹持仪器已省略)如图所示:
,实验装置(夹持仪器已省略)如图所示:
①方框内为制取
 的装置,下列装置和药品较为适宜的是
的装置,下列装置和药品较为适宜的是A.
 B.
B. C.
C. D.
D. E.
E.
②装置D中仪器a的名称是
③根据①的选择,装置甲中试剂a的名称是
(2)
 的制备,步骤如下:
的制备,步骤如下:通入一段时间
 后,向
后,向 溶液中加入过量
溶液中加入过量 溶液,搅拌,反应后过滤,将沉淀洗涤、干燥,得到
溶液,搅拌,反应后过滤,将沉淀洗涤、干燥,得到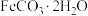 。
。①生成
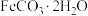 的离子方程式为
的离子方程式为②装置丙的作用是
(3)某同学查阅资料得知,煅烧
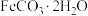 的产物中含有
的产物中含有 价铁元素,于是他设计了由
价铁元素,于是他设计了由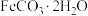 制备
制备 的方案。先向
的方案。先向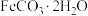 中依次加入试剂:稀硫酸、
中依次加入试剂:稀硫酸、 。
。(4)草酸亚铁和碳酸亚铁晶体均能受热分解。称取
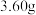
 ,用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示。
,用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示。
①过程Ⅰ发生反应的化学方程式为
②300℃时剩余固体只有一种且是铁的氧化物,则其化学式为
您最近一年使用:0次
2023-10-30更新
|
243次组卷
|
2卷引用:甘肃省武威市多校联考2024届高三上学期9月质量检测化学试题
名校
6 . 氮化钛(TiN)是一种新型多功能金属陶瓷材料,以四氯化钛为原料,在氢气氛围下,与氨气在700℃时制得TiN的反应方程式为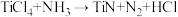 (未配平),下列说法正确的是
(未配平),下列说法正确的是
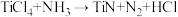 (未配平),下列说法正确的是
(未配平),下列说法正确的是| A.TiCl4作氧化剂,氯被还原 |
B.参加反应的NH3有 被氧化 被氧化 |
| C.TiN既是还原产物又是氧化产物 |
| D.反应中每转移1.2mol电子,会生成2.5mol气体 |
您最近一年使用:0次
2023-10-29更新
|
157次组卷
|
2卷引用:甘肃省兰州第一中学2023-2024学年高三上学期12月月考化学试题
解题方法
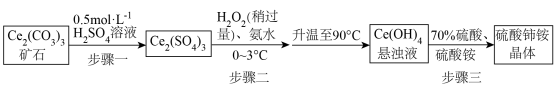
7 . 硫酸铈铵 微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈
微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈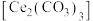 矿石制备硫酸铈铵的工艺流程如图:
矿石制备硫酸铈铵的工艺流程如图:
已知:①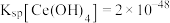 。
。
②硫酸铈铵的熔点为 ,沸点为
,沸点为 。
。
回答下列问题:
(1)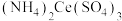 中铈元素的化合价为
中铈元素的化合价为_______ 。
(2)步骤一中,先将
 矿石粉碎,目的是
矿石粉碎,目的是_______ 。
(3)步骤二中,反应温度需要控制在
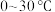 ,原因是
,原因是_______ 。反应完全后,要将混合物升温至
 ,目的是
,目的是_______ 。
(4)步骤二中,
 与
与
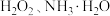 反应生成
反应生成
 的化学方程式为
的化学方程式为_______ 。
(5)步骤三反应完全后的溶液经_______ 、_______ 、过滤,得到晶体。最后用_______ 洗涤
 次后,得到高纯硫酸铈铵晶体。
次后,得到高纯硫酸铈铵晶体。
(6)若最初称取一定量的碳酸铈矿石,其中含
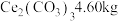 ,经该工艺流程最终获得
,经该工艺流程最终获得
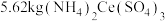 晶体,则
晶体,则
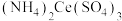 的产率为
的产率为_______ (保留三位有效数字)。
 微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈
微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈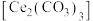 矿石制备硫酸铈铵的工艺流程如图:
矿石制备硫酸铈铵的工艺流程如图:
已知:①
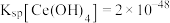 。
。②硫酸铈铵的熔点为
 ,沸点为
,沸点为 。
。回答下列问题:
(1)
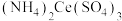 中铈元素的化合价为
中铈元素的化合价为(2)步骤一中,先将
 矿石粉碎,目的是
矿石粉碎,目的是(3)步骤二中,反应温度需要控制在
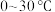 ,原因是
,原因是 ,目的是
,目的是(4)步骤二中,
 与
与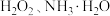 反应生成
反应生成 的化学方程式为
的化学方程式为(5)步骤三反应完全后的溶液经
 次后,得到高纯硫酸铈铵晶体。
次后,得到高纯硫酸铈铵晶体。(6)若最初称取一定量的碳酸铈矿石,其中含
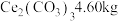 ,经该工艺流程最终获得
,经该工艺流程最终获得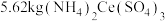 晶体,则
晶体,则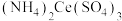 的产率为
的产率为
您最近一年使用:0次
2023-10-29更新
|
764次组卷
|
4卷引用:甘肃省平凉市静宁县2023-2024学年高三上学期11月月考化学试题
甘肃省平凉市静宁县2023-2024学年高三上学期11月月考化学试题广西北海市2024届高三一模考试化学试题西藏林芝市2023-2024学年高三上学期期末考试化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
解题方法
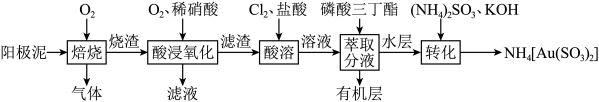
8 . 某化学兴趣小组通过查阅文献,设计了从阳极泥(成分为 、
、 、Au、Pt)中回收贵重金属的工艺,其流程如图所示。已知:“酸溶”时,Pt、Au分别转化为
、Au、Pt)中回收贵重金属的工艺,其流程如图所示。已知:“酸溶”时,Pt、Au分别转化为 和
和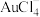 。下列判断正确的是
。下列判断正确的是
 、
、 、Au、Pt)中回收贵重金属的工艺,其流程如图所示。已知:“酸溶”时,Pt、Au分别转化为
、Au、Pt)中回收贵重金属的工艺,其流程如图所示。已知:“酸溶”时,Pt、Au分别转化为 和
和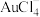 。下列判断正确的是
。下列判断正确的是
A.“焙烧”时, 转化为CuO的化学方程式为 转化为CuO的化学方程式为 |
B.“转化”后所得溶液经过在空气中加热蒸发结晶可得到 |
C.“酸溶”时,铂溶解的离子方程式为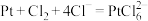 |
| D.结合工艺流程可知盐酸的氧化性强于硝酸 |
您最近一年使用:0次
2023-10-26更新
|
1169次组卷
|
9卷引用:甘肃省部分校2024届高三上学期10月月考化学试题
甘肃省部分校2024届高三上学期10月月考化学试题山西省部分学校2023-2024学年高三上学期10月月考(一轮复习联考(二))化学试题辽宁省部分学校2023-2024学年高三上学期一轮复习联考(二)化学试题河北省保定市唐县第二中学2023-2024学年高三上学期12月月考化学试题河南省豫北名校2024届高三毕业班上学期一轮复习联考(二)化学试题河北省石家庄部分高中2023-2024学年高三上学期10月期中考试化学试题福建省“宁化、永安、尤溪、大田、沙县一中”五校协作2023-2024学年高三上学期期中联考化学试题重庆市百师联盟2024届高三一轮复习联考(二)(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
名校
解题方法
9 . 下列离子方程式书写正确的是
A.向 溶液中通入过量 溶液中通入过量 : :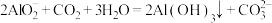 |
B.CuO溶于 溶液: 溶液: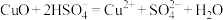 |
C.向 溶液中通入 溶液中通入 : : |
D.Fe与稀硝酸反应,当 时: 时: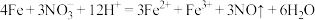 |
您最近一年使用:0次
2023-10-26更新
|
917次组卷
|
7卷引用:甘肃省部分校2024届高三上学期10月月考化学试题
名校
解题方法
10 . K2FeO4是一种绿色净水剂,易溶于水。某小组在实验室条件下制备K2FeO4并探究其性质。回答下列问题:
实验(一)制备K2FeO4。
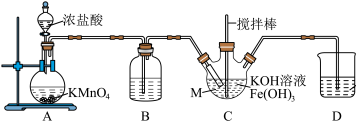
(1)仪器M的名称是_______ ,装置B的作用是________ 。
(2)装置C中生成K2FeO4的化学方程式为_______ 。
(3)实验得知装置D中吸收的Cl2为装置A中生成Cl2的25%,不考虑其他消耗,若装置D中生成的氧化产物只有0.01molNaClO,则生成________ gK2FeO4。
实验(二)探究K2FeO4的性质。
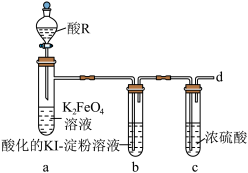
实验中观察到b中溶液变为蓝色,a中溶液由紫红色变为黄色,并产生气泡。
(4)酸R选择稀硫酸,不选择盐酸,其主要原因是_______ ,从d口逸出的气体_______ (填“可以”或“不可以”)直接排放至大气中。
(5)当选用硫酸时,装置a中的离子方程式为_______ 。
(6)另设计一种方案确认有O2产生:_______ 。
实验(一)制备K2FeO4。

(1)仪器M的名称是
(2)装置C中生成K2FeO4的化学方程式为
(3)实验得知装置D中吸收的Cl2为装置A中生成Cl2的25%,不考虑其他消耗,若装置D中生成的氧化产物只有0.01molNaClO,则生成
实验(二)探究K2FeO4的性质。

实验中观察到b中溶液变为蓝色,a中溶液由紫红色变为黄色,并产生气泡。
(4)酸R选择稀硫酸,不选择盐酸,其主要原因是
(5)当选用硫酸时,装置a中的离子方程式为
(6)另设计一种方案确认有O2产生:
您最近一年使用:0次



