名校
1 . 磁性纳米四氧化三铁在催化剂、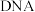 检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米
检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米 的流程如下:
的流程如下:
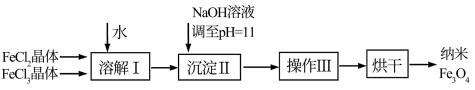
(1)Ⅱ中的反应温度需控制在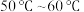 之间,生成
之间,生成 的离子方程式是
的离子方程式是_______ 。
(2)操作Ⅲ分离 的方法为过滤,所需的玻璃仪器为烧杯、
的方法为过滤,所需的玻璃仪器为烧杯、_______ 、_______ 。
(3)某同学依据上述“共沉淀法”的思路在实验室模拟制备纳米 ;为得到较纯净的纳米
;为得到较纯净的纳米 ,
, 与
与 的物质的量之比最好为
的物质的量之比最好为_______ 。但实际操作时,却很难控制这一比例,原因是_______ 。
(4)经过多次实验发现,当混合溶液中 时,容易得到理想的纳米
时,容易得到理想的纳米 。在此条件下,如何检验
。在此条件下,如何检验 是否沉淀完全
是否沉淀完全_______ 。
(5)以太阳能为热源分解 ,铁氧化合物循环分解水制
,铁氧化合物循环分解水制 的过程如图所示。
的过程如图所示。
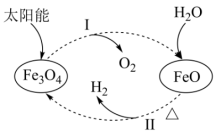
①下列叙述正确的是_______ (填字母)。
A.过程Ⅰ的能量转化为太阳能→化学能
B.过程Ⅰ中 为氧化剂
为氧化剂
C.过程中的 为碱性氧化物
为碱性氧化物
D.铁氧化合物循环制 与电解水制
与电解水制 相比,具有节约能源的优点
相比,具有节约能源的优点
②请写出反应Ⅱ对应的化学方程式_______ 。
(6)为了防止枪支生锈,常采用化学处理使钢铁零件表面生成 的致密保护层——“发蓝”。化学处理过程中其中一步的反应为:
的致密保护层——“发蓝”。化学处理过程中其中一步的反应为: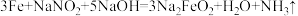 。下列有关的叙述不正确的是_______(填字母)。
。下列有关的叙述不正确的是_______(填字母)。
 检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米
检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米 的流程如下:
的流程如下:
(1)Ⅱ中的反应温度需控制在
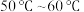 之间,生成
之间,生成 的离子方程式是
的离子方程式是(2)操作Ⅲ分离
 的方法为过滤,所需的玻璃仪器为烧杯、
的方法为过滤,所需的玻璃仪器为烧杯、(3)某同学依据上述“共沉淀法”的思路在实验室模拟制备纳米
 ;为得到较纯净的纳米
;为得到较纯净的纳米 ,
, 与
与 的物质的量之比最好为
的物质的量之比最好为(4)经过多次实验发现,当混合溶液中
 时,容易得到理想的纳米
时,容易得到理想的纳米 。在此条件下,如何检验
。在此条件下,如何检验 是否沉淀完全
是否沉淀完全(5)以太阳能为热源分解
 ,铁氧化合物循环分解水制
,铁氧化合物循环分解水制 的过程如图所示。
的过程如图所示。
①下列叙述正确的是
A.过程Ⅰ的能量转化为太阳能→化学能
B.过程Ⅰ中
 为氧化剂
为氧化剂C.过程中的
 为碱性氧化物
为碱性氧化物D.铁氧化合物循环制
 与电解水制
与电解水制 相比,具有节约能源的优点
相比,具有节约能源的优点②请写出反应Ⅱ对应的化学方程式
(6)为了防止枪支生锈,常采用化学处理使钢铁零件表面生成
 的致密保护层——“发蓝”。化学处理过程中其中一步的反应为:
的致密保护层——“发蓝”。化学处理过程中其中一步的反应为: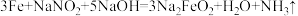 。下列有关的叙述不正确的是_______(填字母)。
。下列有关的叙述不正确的是_______(填字母)。A. 的氧化性大于 的氧化性大于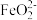 的氧化性 的氧化性 |
B.反应中转移电子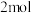 ,则生成还原产物 ,则生成还原产物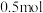 |
| C.枪支“发蓝”实质上是使铁表面钝化生成致密保护层导致难以生锈 |
D.上述反应中,若有 单质铁被氧化,生成的氨气在标准状况下的体积为1.12升(假设氨气完全逸出) 单质铁被氧化,生成的氨气在标准状况下的体积为1.12升(假设氨气完全逸出) |
您最近一年使用:0次
2022-01-19更新
|
287次组卷
|
2卷引用:辽宁省抚顺市六校协作体2021-2022学年高一上学期期末考试化学试题
2 . 某离子反应中涉及 、
、 、
、 、H+、N2、Cl-六种粒子,其中
、H+、N2、Cl-六种粒子,其中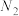 的物质的量随时间变化的曲线如图所示.下列判断正确的是
的物质的量随时间变化的曲线如图所示.下列判断正确的是

 、
、 、
、 、H+、N2、Cl-六种粒子,其中
、H+、N2、Cl-六种粒子,其中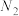 的物质的量随时间变化的曲线如图所示.下列判断正确的是
的物质的量随时间变化的曲线如图所示.下列判断正确的是
| A.反应后溶液的酸性增强 | B.标准状况下,生成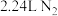 时,反应中转移 时,反应中转移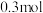 电子 电子 |
| C.氧化产物与还原产物的物质的量之比为2∶1 | D. 被还原,是还原剂 被还原,是还原剂 |
您最近一年使用:0次
2022-01-18更新
|
317次组卷
|
2卷引用:辽宁省锦州市2021-2022学年高一上学期期末考试化学试题
解题方法
3 . 已知氢碘酸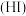 是一种具有强还原性的强酸,
是一种具有强还原性的强酸, 可以与多种物质【如:
可以与多种物质【如: 、
、 、
、 、
、 、
、 、
、 等】发生不同类型的化学反应.请回答下列问题:
等】发生不同类型的化学反应.请回答下列问题:
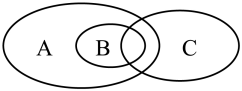
(1)下图可表示离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是_________ (填标号).
(2) 在水溶液中的电离方程式为
在水溶液中的电离方程式为_________________ .
(3)常温下 溶液与
溶液与 反应的化学方程式为
反应的化学方程式为 ,说明还原性
,说明还原性
______  (填“>”、“<”或“=).
(填“>”、“<”或“=).
(4)在反应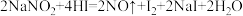 ,氧化剂与还原剂的物质的量之比为
,氧化剂与还原剂的物质的量之比为________ .
(5)下列三种氧化剂均可以将 氧化生成
氧化生成 ,自身对应的还原产物情况如下:
,自身对应的还原产物情况如下:
请判断等物质的量的三种氧化剂分别与足量HI作用,得到I2质量最多的是________ (填选项标号).
(6)向 胶体中逐滴加入HI稀溶液,会出现如下一系列变化:先出现红褐色沉淀;随后沉淀溶解,溶液呈黄色:最后溶液颜色加深.
胶体中逐滴加入HI稀溶液,会出现如下一系列变化:先出现红褐色沉淀;随后沉淀溶解,溶液呈黄色:最后溶液颜色加深.
①红褐色沉淀溶解,反应的离子方程式为___________________________ .
②最后溶液颜色加深,反应的离子方程式为______________________________ .
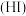 是一种具有强还原性的强酸,
是一种具有强还原性的强酸, 可以与多种物质【如:
可以与多种物质【如: 、
、 、
、 、
、 、
、 、
、 等】发生不同类型的化学反应.请回答下列问题:
等】发生不同类型的化学反应.请回答下列问题:(1)下图可表示离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是

(2)
 在水溶液中的电离方程式为
在水溶液中的电离方程式为(3)常温下
 溶液与
溶液与 反应的化学方程式为
反应的化学方程式为 ,说明还原性
,说明还原性
 (填“>”、“<”或“=).
(填“>”、“<”或“=).(4)在反应
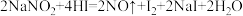 ,氧化剂与还原剂的物质的量之比为
,氧化剂与还原剂的物质的量之比为(5)下列三种氧化剂均可以将
 氧化生成
氧化生成 ,自身对应的还原产物情况如下:
,自身对应的还原产物情况如下:选项 | A | B | C |
氧化剂 |
|
|
|
还原产物 |
|
|
|
(6)向
 胶体中逐滴加入HI稀溶液,会出现如下一系列变化:先出现红褐色沉淀;随后沉淀溶解,溶液呈黄色:最后溶液颜色加深.
胶体中逐滴加入HI稀溶液,会出现如下一系列变化:先出现红褐色沉淀;随后沉淀溶解,溶液呈黄色:最后溶液颜色加深.①红褐色沉淀溶解,反应的离子方程式为
②最后溶液颜色加深,反应的离子方程式为
您最近一年使用:0次
解题方法
4 . 下列反应对应的离子方程式正确的是
A.将 溶液与酸性 溶液与酸性 溶液混合: 溶液混合: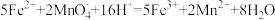 |
B.向稀硫酸中加入少量氧化亚铁: |
C.向稀盐酸中加入少量铁粉: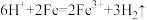 |
D.向氢氧化钠稀溶液中加入适量的铝片: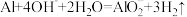 |
您最近一年使用:0次
名校
解题方法
5 . 亚氯酸钠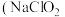 )在溶液中会生成
)在溶液中会生成 、
、 、
、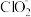 、
、 等,其中
等,其中 和
和 都是具有漂白作用。已知
都是具有漂白作用。已知 ,经测定
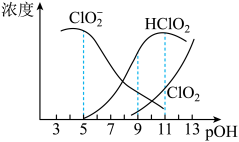
,经测定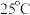 时各组分含量随
时各组分含量随 变化情况如图所示(
变化情况如图所示( 浓度没有画出),此温度下,下列分析正确的是
浓度没有画出),此温度下,下列分析正确的是
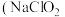 )在溶液中会生成
)在溶液中会生成 、
、 、
、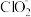 、
、 等,其中
等,其中 和
和 都是具有漂白作用。已知
都是具有漂白作用。已知 ,经测定
,经测定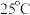 时各组分含量随
时各组分含量随 变化情况如图所示(
变化情况如图所示( 浓度没有画出),此温度下,下列分析正确的是
浓度没有画出),此温度下,下列分析正确的是
A. 的电离平衡常数的数值 的电离平衡常数的数值 |
B. 时, 时,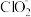 部分转化成 部分转化成 和 和 离子的方程式为: 离子的方程式为: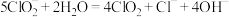 |
C. 时,溶液中含氯微粒的浓度大小为: 时,溶液中含氯微粒的浓度大小为: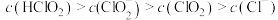 |
D.同浓度 溶液和 溶液和 溶液等体积混合,则混合溶液中有: 溶液等体积混合,则混合溶液中有: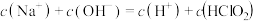 |
您最近一年使用:0次
2022-11-02更新
|
418次组卷
|
9卷引用:辽宁省大连市普兰店区第二中学2018届高三上学期期末考试化学试题
辽宁省大连市普兰店区第二中学2018届高三上学期期末考试化学试题山东省济南大学城实验高中2021-2022学年高三3月阶段性调研化学试题四川省遂宁市2018届高三第一次诊断考试理综化学试题【全国百强校】四川省棠湖中学2019届高三二诊模拟理综-化学试题【全国百强校】四川省棠湖中学2019届高三下学期4月月考理科综合化学试题四川省泸县第四中学2018-2019学年高二下学期下学期期中考试化学试题【懂做原理题】2020届高三化学选修4二轮专题练——电解质溶液中的曲线分析【精编23题】天津市耀华中学2022-2023学年高二上学期期中调研化学试题河南省南阳市第一中学校2022-2023学年高三上学期12月月考化学试题
名校
解题方法
6 . 亚硝酸钠(NaNO2)可用作建筑钢材的缓蚀剂;也可用作食品添加剂,抑制微生物,保持肉制品的结构和营养价值,但是过量摄入会导致中毒。
I.某工厂以浓HNO3、SO2、Na2CO3溶液等为原料生产NaNO2, 其流程如图:
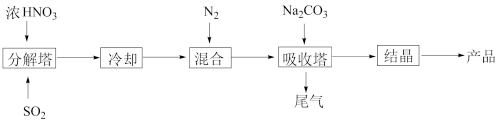
(1)在“分解塔”中,按一定比通入SO2和喷入浓HNO3,产生NO和NO2。操作时将SO2从塔底通入,浓HNO3从塔顶向下喷淋,这种加料操作的目的是_______ 。
(2)“分解塔”中的温度不宜过高,其主要原因是_______ 。
(3)“吸收塔”中主要发生NO、NO2与Na2CO3溶液反应生成NaNO2。写出NO、NO2按物质的量之比1: 1与Na2CO3反应生成NaNO2的化学方程式:_______ 。
II.某化学研究小组在实验室用稀HNO3、Cu、 Na2O2 为原料制备NaNO2,实验装置如图(夹持装置已省略)。
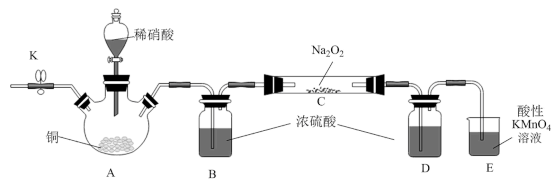
已知:①2NO+Na2O2 = 2NaNO2, 2NO2+Na2O2 =2NaNO3
②酸性条件下,NO、NO2或NO 都能与MnO
都能与MnO 反应生成NO
反应生成NO 和Mn2+
和Mn2+
(4)实验开始加入稀HNO3前,需要先打开止水夹K,向装置中通入一段时间N2,目的是_______ 。
(5)装置A中发生反应的离子方程式为_______ 。
(6)装置B、D不可省去,否则会导致产品中混有_______ 杂质(填化学式)。
III. NaNO2含量测定
工业亚硝酸钠产品中往往混有少量NaNO3等杂质,可以采用KMnO4测定含量。称取5.000g该亚硝酸钠产品溶于水配制成250mL的样品溶液。取25.00mL该样品溶液于锥形瓶中,用稀H2SO4酸化后,再向锥形瓶中滴加0.1000 mol·L-1KMnO4溶液,至恰好完全反应时,消耗28.00 mL KMnO4溶液。计算该产品中NaNO2的质量分数____ 。(写出计算过程)
I.某工厂以浓HNO3、SO2、Na2CO3溶液等为原料生产NaNO2, 其流程如图:

(1)在“分解塔”中,按一定比通入SO2和喷入浓HNO3,产生NO和NO2。操作时将SO2从塔底通入,浓HNO3从塔顶向下喷淋,这种加料操作的目的是
(2)“分解塔”中的温度不宜过高,其主要原因是
(3)“吸收塔”中主要发生NO、NO2与Na2CO3溶液反应生成NaNO2。写出NO、NO2按物质的量之比1: 1与Na2CO3反应生成NaNO2的化学方程式:
II.某化学研究小组在实验室用稀HNO3、Cu、 Na2O2 为原料制备NaNO2,实验装置如图(夹持装置已省略)。

已知:①2NO+Na2O2 = 2NaNO2, 2NO2+Na2O2 =2NaNO3
②酸性条件下,NO、NO2或NO
 都能与MnO
都能与MnO 反应生成NO
反应生成NO 和Mn2+
和Mn2+(4)实验开始加入稀HNO3前,需要先打开止水夹K,向装置中通入一段时间N2,目的是
(5)装置A中发生反应的离子方程式为
(6)装置B、D不可省去,否则会导致产品中混有
III. NaNO2含量测定
工业亚硝酸钠产品中往往混有少量NaNO3等杂质,可以采用KMnO4测定含量。称取5.000g该亚硝酸钠产品溶于水配制成250mL的样品溶液。取25.00mL该样品溶液于锥形瓶中,用稀H2SO4酸化后,再向锥形瓶中滴加0.1000 mol·L-1KMnO4溶液,至恰好完全反应时,消耗28.00 mL KMnO4溶液。计算该产品中NaNO2的质量分数
您最近一年使用:0次
2021-04-29更新
|
343次组卷
|
2卷引用:辽宁省辽阳市2022-2023学年高一下学期期末考试化学试题
名校
解题方法
7 . NaNO2是一种食品添加剂,但它也能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式为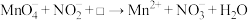 。下列叙述中正确的是
。下列叙述中正确的是
 。下列叙述中正确的是
。下列叙述中正确的是A.该反应中 被还原 被还原 | B.Mn2+的还原性强于 |
| C.生成1molNaNO3需消耗0.4molKMnO4 | D.□中的粒子是OH- |
您最近一年使用:0次
名校
8 . 某工厂的工业废水中含有大量FeSO4和较多的Cu2+。为了减小污染并变废为宝,工厂计划从该废水中回收FeSO4和金属铜。现根据以下流程图,在实验室模拟该过程,回答下列问题。
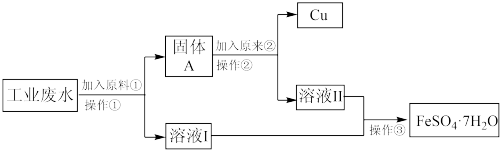
(1)原料①代表的物质为_______ ,原料②代表的物质为_______ 。
(2)实验室模拟操作①和②用到的玻璃仪器有_______ 。
(3)向盛有2mL溶液Ⅱ的试管中,滴入少量过氧化氢溶液,试写出发生反应的离子方程式,并用双线桥标出电子转移的方向和数目_______ ,再向所得溶液中滴加适量的淀粉KI溶液,现象为_______ ,发生反应的离子方程式为_______ ;向另一支盛有2mLKMnO4溶液的试管中,滴入适量溶液Ⅱ,发生反应的离子方程式为_______ 。

(1)原料①代表的物质为
(2)实验室模拟操作①和②用到的玻璃仪器有
(3)向盛有2mL溶液Ⅱ的试管中,滴入少量过氧化氢溶液,试写出发生反应的离子方程式,并用双线桥标出电子转移的方向和数目
您最近一年使用:0次
名校
9 . 随着新型冠状病毒感染的肺炎确诊病例越来越多,消毒已成了人们关注的话题。前不久李兰娟院士说过新冠病毒的几个弱点,比如含氯的消毒剂就可以有效的灭活病毒。某校化学兴趣小组为制备并收集氯气,设计下图装置,装置中的夹持装置和加热装置均已略去。
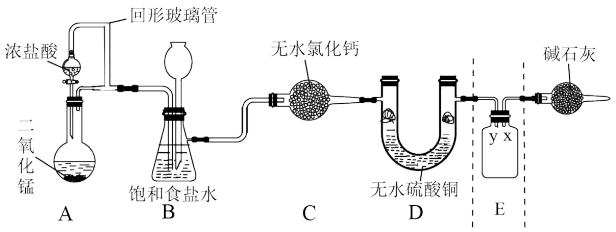
回答下列问题:
(1)写出盛放浓盐酸的仪器名称_______ ,回形玻璃管的作用是_______ 。
(2)写出装置A中发生反应的化学方程式_______ 。
(3)装置C的作用是_______ 。
(4)E装置中导管_______ (填“x”或“y”)应伸至靠近集气瓶底部。
(5)ClO2是目前国际上公认的新一代高效、广谱、安全的杀菌、保鲜剂,在水处理等方面具有广泛的应用。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
①我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:
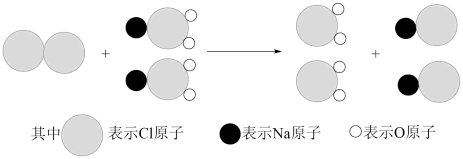
该反应的化学方程式_______ 。
②将ClO2通入酸性淀性粉碘化钾溶液,溶液变成蓝色,ClO2被还原为氯离子,该反应的离子方程式为:_______ 。

回答下列问题:
(1)写出盛放浓盐酸的仪器名称
(2)写出装置A中发生反应的化学方程式
(3)装置C的作用是
(4)E装置中导管
(5)ClO2是目前国际上公认的新一代高效、广谱、安全的杀菌、保鲜剂,在水处理等方面具有广泛的应用。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
①我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:

该反应的化学方程式
②将ClO2通入酸性淀性粉碘化钾溶液,溶液变成蓝色,ClO2被还原为氯离子,该反应的离子方程式为:
您最近一年使用:0次
10 . Ⅰ、含氮废水是造成水体污染的重要原因之一、研究含氮废水的处理对水体净化有重要意义。利用 O2 和 H2 可高效去除水体中同时存在的 NH 和 NO
和 NO 。
。
具体方法是:①先利用氧气将 NH 氧化成 NO
氧化成 NO ,
,
②再利用 H2 将 NO 还原为N2 (2NO
还原为N2 (2NO +5H2
+5H2 N2+2OH-+4H2O)。
N2+2OH-+4H2O)。
(1)反应①中氧化剂与还原剂物质的量之比为___________ 。
(2)若完全处理 100g 含 NH4NO3 4%的废水,至少需要标准状况下的 H2___________ L。
(3)该污水处理的好处是___________ (列举一条即可)
Ⅱ、焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是___________ (写化学式)。
(2)写出并配平该反应的化学方程式:___________ ;
(3)发生还原反应的物质是___________ ,反应中2mol氧化剂能___________ (填“失去”或“得到”)___________ mol电子。
(4)反应中产生5.6L(标准状况)的气体时,被还原的物质的质量为___________ 。
 和 NO
和 NO 。
。具体方法是:①先利用氧气将 NH
 氧化成 NO
氧化成 NO ,
,②再利用 H2 将 NO
 还原为N2 (2NO
还原为N2 (2NO +5H2
+5H2 N2+2OH-+4H2O)。
N2+2OH-+4H2O)。(1)反应①中氧化剂与还原剂物质的量之比为
(2)若完全处理 100g 含 NH4NO3 4%的废水,至少需要标准状况下的 H2
(3)该污水处理的好处是
Ⅱ、焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是
(2)写出并配平该反应的化学方程式:
(3)发生还原反应的物质是
(4)反应中产生5.6L(标准状况)的气体时,被还原的物质的质量为
您最近一年使用:0次




