名校
解题方法
1 . 下列化学反应表示正确的是
| A.向碘化钾中通入过量氯气:2I- + Cl2 = 2Cl- + I2 |
| B.向稀硝酸中加入过量铁粉:3Fe + 8HNO3=3Fe(NO3)2 + 2NO↑ +4H2O |
| C.氯化亚铁溶液中加入少量过氧化钠:4Fe2+ + 4Na2O2 + 6H2O =4Fe(OH)3↓ + 8Na+ + O2↑ |
D.硫酸铵溶液和氢氧化钡溶液反应:NH + SO + SO + Ba2+ + OH−= BaSO4↓+NH3·H2O + Ba2+ + OH−= BaSO4↓+NH3·H2O |
您最近一年使用:0次
名校
解题方法
2 . 超细银粉在光学、生物医疗等领域有着广阔的应用前景。由含银废催化剂制备超细银粉的过程如下:
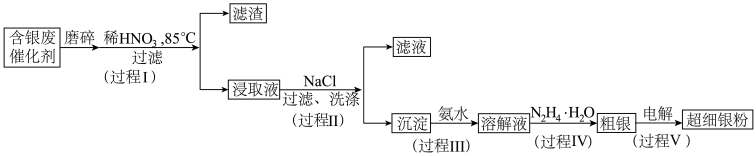
资料:
i.含银废催化剂成分:主要含Ag、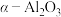 及少量MgO、
及少量MgO、 、
、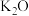 、
、 等
等
ii.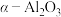 为载体,且不溶于硝酸
为载体,且不溶于硝酸
iii.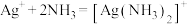
(1)预处理
过程I中,为提高银的浸取速率采取的措施有_______
(2)分离除杂
①过程Ⅱ中,检验沉淀表面的 已洗涤干净的操作是
已洗涤干净的操作是_______ 。
②过程Ⅲ中,请结合平衡移动原理解释沉淀溶解的原因_______ 。
③过程Ⅳ中, 被氧化为
被氧化为 ,同时获得粗银,该反应的离子方程式为
,同时获得粗银,该反应的离子方程式为_______ 。
(3)回收率测定
采用如下方法测定粗银中银的回收率:取m g粗银样品用硝酸溶解,以铁铵矾[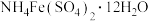 ]为指示剂,用c mol/L的KSCN标准溶液滴定,消耗标准溶液v mL。
]为指示剂,用c mol/L的KSCN标准溶液滴定,消耗标准溶液v mL。
已知:i.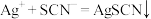 (白色)
(白色) 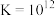
 (红色)
(红色) 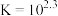
ii. 开始沉淀的pH为1.5,完全沉淀的pH为2.8
开始沉淀的pH为1.5,完全沉淀的pH为2.8
iii.AgSCN可溶于较浓硝酸判断已达滴定终点时的现象是_______ 。
(4)精炼
①精炼时粗银应连接电源_______ 极;
②电解质溶液中溶质为_______ 。

资料:
i.含银废催化剂成分:主要含Ag、
 及少量MgO、
及少量MgO、 、
、 、
、 等
等ii.
 为载体,且不溶于硝酸
为载体,且不溶于硝酸iii.
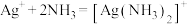
(1)预处理
过程I中,为提高银的浸取速率采取的措施有
(2)分离除杂
①过程Ⅱ中,检验沉淀表面的
 已洗涤干净的操作是
已洗涤干净的操作是②过程Ⅲ中,请结合平衡移动原理解释沉淀溶解的原因
③过程Ⅳ中,
 被氧化为
被氧化为 ,同时获得粗银,该反应的离子方程式为
,同时获得粗银,该反应的离子方程式为(3)回收率测定
采用如下方法测定粗银中银的回收率:取m g粗银样品用硝酸溶解,以铁铵矾[
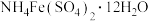 ]为指示剂,用c mol/L的KSCN标准溶液滴定,消耗标准溶液v mL。
]为指示剂,用c mol/L的KSCN标准溶液滴定,消耗标准溶液v mL。已知:i.
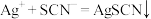 (白色)
(白色) 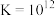
 (红色)
(红色) 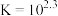
ii.
 开始沉淀的pH为1.5,完全沉淀的pH为2.8
开始沉淀的pH为1.5,完全沉淀的pH为2.8iii.AgSCN可溶于较浓硝酸判断已达滴定终点时的现象是
(4)精炼
①精炼时粗银应连接电源
②电解质溶液中溶质为
您最近一年使用:0次
2023-01-05更新
|
296次组卷
|
2卷引用:辽宁省沈阳市东北育才学校2022-2023学年高二上学期期末测试化学试题
名校
解题方法
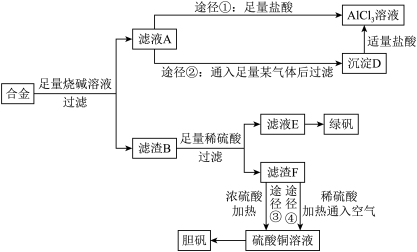
3 . 某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体[ ]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式_______ 。
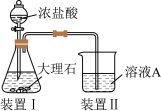
(2)进行途径②时,该小组用下图所示装置及试剂,将制得的 气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是
气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是_______ (用离子方程式表示);为了避免沉淀D减少,应该在装置Ⅰ和装置Ⅱ之间增加一个盛有_______ 的洗气瓶。
(3)通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、蒸发浓缩、冷却结晶、过滤、自然干燥。其中“加热通氧气”所起的作用为_______ (用离子方程式表示)。
(4)白磷有剧毒,不慎沾到皮肤上,可取少量胆矾配制成 溶液冲洗解毒。白磷可与热的
溶液冲洗解毒。白磷可与热的 溶液反应生成
溶液反应生成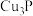 ,与冷溶液则析出Cu,反应方程式分别(均未配平)为:
,与冷溶液则析出Cu,反应方程式分别(均未配平)为:
①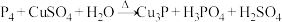
②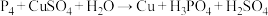
若上述两反应中被氧化的 的物质的量相等,则消耗的
的物质的量相等,则消耗的 的物质的量之比为
的物质的量之比为_______ 。
(5)将绿矾加热失去结晶水后的产物 ,进行如下转化(无关物质已略去)
,进行如下转化(无关物质已略去)
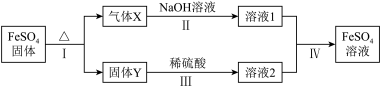
已知:X由两种化合物组成,将X通入氯水,溶液褪色;通入 溶液,产生白色沉淀。Y是红棕色的化合物。
溶液,产生白色沉淀。Y是红棕色的化合物。
①请写出X使氯水褪色所发生的反应的化学方程式_______ 。
②若经反应Ⅰ得到16g固体Y,产生的气体X恰好被0.4L1mol/L NaOH溶液完全吸收,则反应Ⅳ中生成 的离子方程式是
的离子方程式是_______ 。
 ]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式
(2)进行途径②时,该小组用下图所示装置及试剂,将制得的
 气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是
气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是
(3)通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、蒸发浓缩、冷却结晶、过滤、自然干燥。其中“加热通氧气”所起的作用为
(4)白磷有剧毒,不慎沾到皮肤上,可取少量胆矾配制成
 溶液冲洗解毒。白磷可与热的
溶液冲洗解毒。白磷可与热的 溶液反应生成
溶液反应生成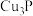 ,与冷溶液则析出Cu,反应方程式分别(均未配平)为:
,与冷溶液则析出Cu,反应方程式分别(均未配平)为:①
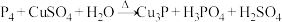
②
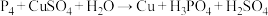
若上述两反应中被氧化的
 的物质的量相等,则消耗的
的物质的量相等,则消耗的 的物质的量之比为
的物质的量之比为(5)将绿矾加热失去结晶水后的产物
 ,进行如下转化(无关物质已略去)
,进行如下转化(无关物质已略去)
已知:X由两种化合物组成,将X通入氯水,溶液褪色;通入
 溶液,产生白色沉淀。Y是红棕色的化合物。
溶液,产生白色沉淀。Y是红棕色的化合物。①请写出X使氯水褪色所发生的反应的化学方程式
②若经反应Ⅰ得到16g固体Y,产生的气体X恰好被0.4L1mol/L NaOH溶液完全吸收,则反应Ⅳ中生成
 的离子方程式是
的离子方程式是
您最近一年使用:0次
名校
解题方法
4 . 某溶液仅含 、
、 、
、 、
、 、
、 、
、 、
、 中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
 、
、 、
、 、
、 、
、 、
、 、
、 中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是| A.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
B.加入稀硫酸发生反应的离子方程式为: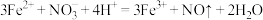 |
C.该溶液中一定有 |
| D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
您最近一年使用:0次
解题方法
5 . 羟基氧化铁 是一种重要的化工原料,一种以工厂废料(含
是一种重要的化工原料,一种以工厂废料(含 、
、 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
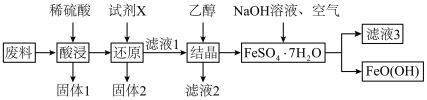
已知: 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。
(1)羟基氧化铁中铁元素的化合价是_______ ,“固体1”的主要成分是_______ 。
(2)“酸浸”时 与硫酸发生反应的离子方程式为
与硫酸发生反应的离子方程式为_______ 。“试剂X”宜选择的是_______ 。
A.双氧水 B.铁粉 C.铜粉 D.钠块
(3)“结晶”时加入乙醇即可析出 晶体,乙醇的作用是
晶体,乙醇的作用是_______ 。
(4)将 配制成一定浓度的溶液,恒温条件下边搅拌边按一定比例加入
配制成一定浓度的溶液,恒温条件下边搅拌边按一定比例加入 溶液,同时鼓入空气进行氧化,至反应液全部变为棕黄色悬浊液,即可得到
溶液,同时鼓入空气进行氧化,至反应液全部变为棕黄色悬浊液,即可得到 。该反应的离子方程式为
。该反应的离子方程式为_______ 。
(5)“滤液3”中,溶质的主要成分是_______ (写化学式)。
 是一种重要的化工原料,一种以工厂废料(含
是一种重要的化工原料,一种以工厂废料(含 、
、 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
已知:
 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。(1)羟基氧化铁中铁元素的化合价是
(2)“酸浸”时
 与硫酸发生反应的离子方程式为
与硫酸发生反应的离子方程式为A.双氧水 B.铁粉 C.铜粉 D.钠块
(3)“结晶”时加入乙醇即可析出
 晶体,乙醇的作用是
晶体,乙醇的作用是(4)将
 配制成一定浓度的溶液,恒温条件下边搅拌边按一定比例加入
配制成一定浓度的溶液,恒温条件下边搅拌边按一定比例加入 溶液,同时鼓入空气进行氧化,至反应液全部变为棕黄色悬浊液,即可得到
溶液,同时鼓入空气进行氧化,至反应液全部变为棕黄色悬浊液,即可得到 。该反应的离子方程式为
。该反应的离子方程式为(5)“滤液3”中,溶质的主要成分是
您最近一年使用:0次
解题方法
6 . 探究化学反应速率的影响因素,对工农业生产有着非常重要的意义。为探究反应速率与 溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
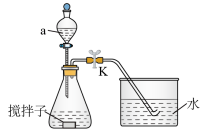
实验步骤:往锥形瓶中加入一定体积的
 溶液、
溶液、
 溶液和水,充分搅拌。控制体系温度,通过
溶液和水,充分搅拌。控制体系温度,通过 往锥形瓶中加入一定浓度的醋酸,发生反应:
往锥形瓶中加入一定浓度的醋酸,发生反应: 。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集
。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集
 所需时间。回答下列问题:
所需时间。回答下列问题:
(1)仪器a的名称为_______ 。
(2)若需控制体系的温度为36℃,采取的合理加热方式为_______ 。
(3)每组实验过程的实验数据如下表所示:
i.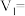
_______ ,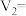
_______ 。
ii.该反应的速率方程为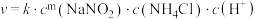 ,k为反应速率常数。利用实验数据计算得m=
,k为反应速率常数。利用实验数据计算得m=_______ (填整数)。
iii.醋酸的作用是_______ 。
(4)如果用同浓度的盐酸代替醋酸进行实验1, 与盐酸反应生成
与盐酸反应生成 ,
, 分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。
分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。 分解的化学方程式为
分解的化学方程式为_______ 。
 溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
实验步骤:往锥形瓶中加入一定体积的

 溶液、
溶液、
 溶液和水,充分搅拌。控制体系温度,通过
溶液和水,充分搅拌。控制体系温度,通过 往锥形瓶中加入一定浓度的醋酸,发生反应:
往锥形瓶中加入一定浓度的醋酸,发生反应: 。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集
。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集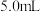
 所需时间。回答下列问题:
所需时间。回答下列问题:(1)仪器a的名称为
(2)若需控制体系的温度为36℃,采取的合理加热方式为
(3)每组实验过程的实验数据如下表所示:
| 实验编号 | 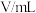 | 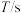 | |||
 溶液 溶液 |  溶液 溶液 | 醋酸 | 水 | ||
| 1 | 4.0 |  | 4.0 | 8.0 | 340 |
| 2 | 6.0 | 4.0 | 4.0 |  | 151 |
| 3 | 8.0 | 4.0 | 4.0 | 4.0 | 85 |
| 4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |
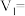
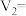
ii.该反应的速率方程为
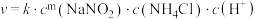 ,k为反应速率常数。利用实验数据计算得m=
,k为反应速率常数。利用实验数据计算得m=iii.醋酸的作用是
(4)如果用同浓度的盐酸代替醋酸进行实验1,
 与盐酸反应生成
与盐酸反应生成 ,
, 分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。
分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。 分解的化学方程式为
分解的化学方程式为
您最近一年使用:0次
2022-12-17更新
|
235次组卷
|
2卷引用:辽宁省鞍山市一般高中协作校2022-2023学年高一下学期期末考试化学试题
名校
解题方法
7 . 正高碘酸(H5IO6)是白色结晶性粉末,溶于水,主要用作氧化剂和分析试剂。由NaI制取H5IO6的实验流程如图所示:
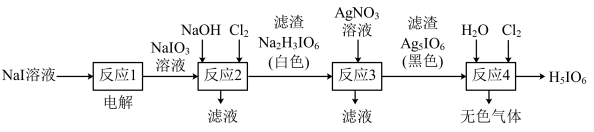
下列说法正确的是

下列说法正确的是
A.电解过程中阳极反应为:I-+6OH--6e-=IO +3H2O +3H2O |
| B.“反应2”中Cl2与NaIO3的物质的量之比为1∶1 |
| C.“反应3”的滤液中含有NaNO3,NaI等 |
| D.“反应4”为非氧化还原反应 |
您最近一年使用:0次
2022-12-17更新
|
191次组卷
|
3卷引用:辽宁省锦州市渤大附中2022-2023学年高三上学期期末考试化学试题
名校
解题方法
8 . 能正确表示下列反应的离子方程式的是
| A.向CuSO4溶液中加入金属钠:2Na+Cu2+=2Na++Cu |
B.向高锰酸钾溶液中滴加双氧水:2Mn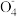 +3H2O2+6H+=2Mn2++4O2↑+6H2O +3H2O2+6H+=2Mn2++4O2↑+6H2O |
C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使S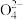 完全沉淀:N 完全沉淀:N +Al3++2S +Al3++2S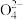 +2Ba2++4OH-=Al(OH)3↓+NH3·H2O+2BaSO4↓ +2Ba2++4OH-=Al(OH)3↓+NH3·H2O+2BaSO4↓ |
| D.氢氧化铁与氢碘酸反应:Fe(OH)3+3H+=Fe3++3H2O |
您最近一年使用:0次
2022-12-13更新
|
171次组卷
|
3卷引用:辽宁省锦州市渤大附中2022-2023学年高三上学期期末考试化学试题
9 . 在高温高压的水溶液中,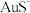 与
与 发生反应沉积出磁铁矿(主要成分
发生反应沉积出磁铁矿(主要成分 )和金矿(含单质
)和金矿(含单质 ),且硫元素全部转化为
),且硫元素全部转化为 气体放出。对于该反应的说法一定正确的是
气体放出。对于该反应的说法一定正确的是
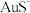 与
与 发生反应沉积出磁铁矿(主要成分
发生反应沉积出磁铁矿(主要成分 )和金矿(含单质
)和金矿(含单质 ),且硫元素全部转化为
),且硫元素全部转化为 气体放出。对于该反应的说法一定正确的是
气体放出。对于该反应的说法一定正确的是A.反应后溶液的 降低 降低 | B.每生成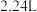 气体,转移电子数为 气体,转移电子数为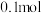 |
C. 既作氧化剂又作还原剂 既作氧化剂又作还原剂 | D.氧化剂和还原剂的物质的量之比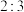 |
您最近一年使用:0次
2022-12-10更新
|
135次组卷
|
2卷引用:辽宁省鞍山市普通高中2023-2024学年高三上学期期末联考化学试题
名校
解题方法
10 . 亚氯酸钠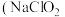 )在溶液中会生成
)在溶液中会生成 、
、 、
、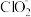 、
、 等,其中
等,其中 和
和 都是具有漂白作用。已知
都是具有漂白作用。已知 ,经测定
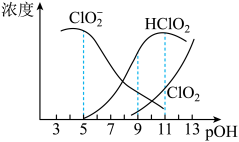
,经测定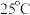 时各组分含量随
时各组分含量随 变化情况如图所示(
变化情况如图所示( 浓度没有画出),此温度下,下列分析正确的是
浓度没有画出),此温度下,下列分析正确的是
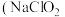 )在溶液中会生成
)在溶液中会生成 、
、 、
、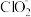 、
、 等,其中
等,其中 和
和 都是具有漂白作用。已知
都是具有漂白作用。已知 ,经测定
,经测定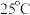 时各组分含量随
时各组分含量随 变化情况如图所示(
变化情况如图所示( 浓度没有画出),此温度下,下列分析正确的是
浓度没有画出),此温度下,下列分析正确的是
A. 的电离平衡常数的数值 的电离平衡常数的数值 |
B. 时, 时,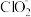 部分转化成 部分转化成 和 和 离子的方程式为: 离子的方程式为: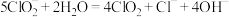 |
C. 时,溶液中含氯微粒的浓度大小为: 时,溶液中含氯微粒的浓度大小为: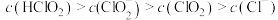 |
D.同浓度 溶液和 溶液和 溶液等体积混合,则混合溶液中有: 溶液等体积混合,则混合溶液中有: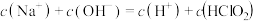 |
您最近一年使用:0次
2022-11-02更新
|
418次组卷
|
9卷引用:辽宁省大连市普兰店区第二中学2018届高三上学期期末考试化学试题
辽宁省大连市普兰店区第二中学2018届高三上学期期末考试化学试题山东省济南大学城实验高中2021-2022学年高三3月阶段性调研化学试题四川省遂宁市2018届高三第一次诊断考试理综化学试题【全国百强校】四川省棠湖中学2019届高三二诊模拟理综-化学试题【全国百强校】四川省棠湖中学2019届高三下学期4月月考理科综合化学试题四川省泸县第四中学2018-2019学年高二下学期下学期期中考试化学试题【懂做原理题】2020届高三化学选修4二轮专题练——电解质溶液中的曲线分析【精编23题】天津市耀华中学2022-2023学年高二上学期期中调研化学试题河南省南阳市第一中学校2022-2023学年高三上学期12月月考化学试题



