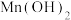解题方法
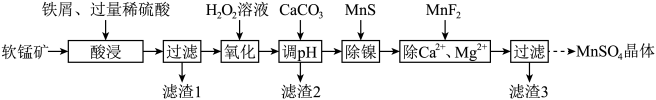
1 . 利用软锰矿(主要成分是 ,其中还含有少量
,其中还含有少量 、MgO、CaO、
、MgO、CaO、 )生产高纯硫酸锰晶体的一种工艺流程如下:
)生产高纯硫酸锰晶体的一种工艺流程如下:
已知:常温下, ,
, ,
, ,
, 。
。
回答下列问题:
(1)“酸浸”前将矿石粉碎的目的是_______ ;“酸浸”后溶液中检测到 、
、 ,则此过程中铁屑与软锰矿反应的化学方程式为
,则此过程中铁屑与软锰矿反应的化学方程式为________ ;“滤渣1”的主要成分为________ (填化学式)。
(2)“氧化”时发生反应的离子方程式为___________ ,“调pH”的目的是___________ 。
(3)“除镍”时,使用MnS作为沉淀剂的原因是___________ 。
(4)加入 使
使 、
、 的浓度均不高于
的浓度均不高于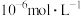 ,此时溶液中
,此时溶液中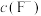 至少为
至少为_______  。
。
(5)硫酸锰的溶解度随温度变化关系如图所示,从“除 、
、 ”所得滤液中获得硫酸锰晶体的方法是
”所得滤液中获得硫酸锰晶体的方法是________ 。

 ,其中还含有少量
,其中还含有少量 、MgO、CaO、
、MgO、CaO、 )生产高纯硫酸锰晶体的一种工艺流程如下:
)生产高纯硫酸锰晶体的一种工艺流程如下:
已知:常温下,
 ,
, ,
, ,
, 。
。回答下列问题:
(1)“酸浸”前将矿石粉碎的目的是
 、
、 ,则此过程中铁屑与软锰矿反应的化学方程式为
,则此过程中铁屑与软锰矿反应的化学方程式为(2)“氧化”时发生反应的离子方程式为
(3)“除镍”时,使用MnS作为沉淀剂的原因是
(4)加入
 使
使 、
、 的浓度均不高于
的浓度均不高于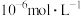 ,此时溶液中
,此时溶液中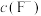 至少为
至少为 。
。(5)硫酸锰的溶解度随温度变化关系如图所示,从“除
 、
、 ”所得滤液中获得硫酸锰晶体的方法是
”所得滤液中获得硫酸锰晶体的方法是
您最近一年使用:0次
2 . 从酸性含铬废水(主要阴离子为 )中回收铬元素(
)中回收铬元素( )的部分工艺流程如图所示。
)的部分工艺流程如图所示。
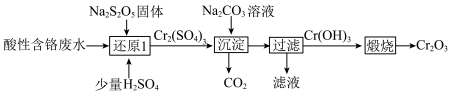
下列有关说法正确的是
 )中回收铬元素(
)中回收铬元素( )的部分工艺流程如图所示。
)的部分工艺流程如图所示。
下列有关说法正确的是
| A.“过滤”时需用玻璃棒搅拌 |
| B.“煅烧”过程中发生了氧化还原反应 |
C.若分别用 、 、 还原等量的 还原等量的 ,消耗 ,消耗 与 与 的物质的量之比为1∶3 的物质的量之比为1∶3 |
D.“还原1”时反应的离子方程式为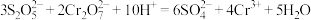 |
您最近一年使用:0次
2024-01-08更新
|
266次组卷
|
6卷引用:辽宁省朝阳市建平县第二高级中学2023-2024学年高一上学期1月期末化学试题
解题方法
3 . 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,已知K2FeO4在Fe3+催化下会分解,在强碱性条件下稳定。高铁酸钾(K2FeO4)生产流程如图:
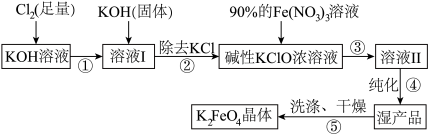
(1)在溶液Ⅰ中加入KOH固体的目的是 。
(2)写出③反应的离子方程式_______ 。
(3)制备K2FeO4时,将90%的Fe(NO3)3溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是_______ 。
(4)K2FeO4在酸性或弱碱性条件下能与水反应生成一种胶体和一种氧化性气体单质,该气体单质为_______ (写出化学式)。
(5)K2FeO4净水时能吸附悬浮物的原因是_______ 。

(1)在溶液Ⅰ中加入KOH固体的目的是 。
| A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高KClO产率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为KClO |
(2)写出③反应的离子方程式
(3)制备K2FeO4时,将90%的Fe(NO3)3溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是
(4)K2FeO4在酸性或弱碱性条件下能与水反应生成一种胶体和一种氧化性气体单质,该气体单质为
(5)K2FeO4净水时能吸附悬浮物的原因是
您最近一年使用:0次
4 . 高铁酸钾(K2FeO4)是一种既能杀菌 消毒、又能絮凝净水的水处理剂,工业制备高铁酸钾的离子方程式为Fe(OH)3+ClO-+OH-
 +Cl-+H2O (未配平)。下列有关说法不正确的是
+Cl-+H2O (未配平)。下列有关说法不正确的是

 +Cl-+H2O (未配平)。下列有关说法不正确的是
+Cl-+H2O (未配平)。下列有关说法不正确的是A.由上述反应可知,FeO 的氧化性强于ClO- 的氧化性强于ClO- |
| B.生成0.4molCl-时转移电子数0.8NA |
| C.上述反应中氧化剂和还原剂的物质的量之比为3∶2 |
D.K2FeO4处理水的原理可为:  |
您最近一年使用:0次
2023-11-17更新
|
316次组卷
|
3卷引用:辽宁省沈阳市重点高中五校协作体2023-2024学年高一上学期1月期末化学试题
5 . 氮氧化物(NOx)会对生态系统和人体健康造成危害。一种以沸石笼作为载体对NOₓ进行催化还原的原理如图所示。下列说法错误的是
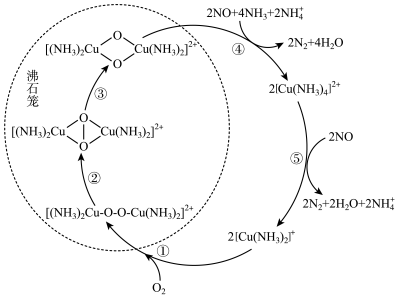
| A.反应①每消耗lmolO2, 转移 2mol电子 |
| B.反应⑤中[Cu(NH3)4]2+作还原剂 |
| C.反应④有σ键和π键的形成 |
D.脱除NO 的总反应可表示为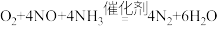 |
您最近一年使用:0次
2023-10-19更新
|
297次组卷
|
4卷引用:辽宁省沈阳市辽中区第一私立高级中学2023-2024学年高二上学期1月期末化学试题
解题方法
6 . 氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业。实验室常用 溶液和
溶液和 制备CuCl,装置如图所示(夹持装置已省略)。
制备CuCl,装置如图所示(夹持装置已省略)。
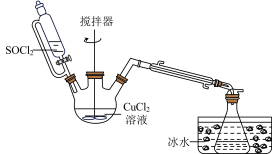
已知:①CuCl,白色粉末,难溶于水,在潮湿的空气中易被氧化;在溶液中存在如下平衡: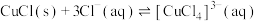 (无色)。
(无色)。
② ,无色易挥发液体,熔点-105℃,沸点79℃,遇水剧烈水解。
,无色易挥发液体,熔点-105℃,沸点79℃,遇水剧烈水解。
请回答以下问题:
(1)盛装 的仪器的名称是
的仪器的名称是________ 。
(2)配置 溶液所需的蒸馏水需要加热煮沸,目的是
溶液所需的蒸馏水需要加热煮沸,目的是________ 。
(3)制备CuCl的离子方程式为________ 。
(4)当三颈烧瓶的溶液________ 时(填实验现象),则说明反应已经完成,可以停止实验。
(5)实验结束后需要先向三颈烧瓶中加入蒸馏水,然后再进行过滤得到CuCl,加水的作用是________ 。
(6)产品纯度测定:准确称取氯化亚铜产品mg,溶于过量的 溶液中得
溶液中得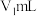 待测液,从中量取
待测液,从中量取 于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用
于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用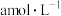 硫酸铈
硫酸铈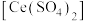 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗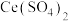 溶液bmL。产品中CuCl的质量分数为
溶液bmL。产品中CuCl的质量分数为________ %。(已知: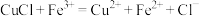 ,
, )
)
(7)下列有关滴定的说法错误的是________(填字母)。
 溶液和
溶液和 制备CuCl,装置如图所示(夹持装置已省略)。
制备CuCl,装置如图所示(夹持装置已省略)。
已知:①CuCl,白色粉末,难溶于水,在潮湿的空气中易被氧化;在溶液中存在如下平衡:
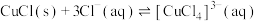 (无色)。
(无色)。②
 ,无色易挥发液体,熔点-105℃,沸点79℃,遇水剧烈水解。
,无色易挥发液体,熔点-105℃,沸点79℃,遇水剧烈水解。请回答以下问题:
(1)盛装
 的仪器的名称是
的仪器的名称是(2)配置
 溶液所需的蒸馏水需要加热煮沸,目的是
溶液所需的蒸馏水需要加热煮沸,目的是(3)制备CuCl的离子方程式为
(4)当三颈烧瓶的溶液
(5)实验结束后需要先向三颈烧瓶中加入蒸馏水,然后再进行过滤得到CuCl,加水的作用是
(6)产品纯度测定:准确称取氯化亚铜产品mg,溶于过量的
 溶液中得
溶液中得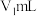 待测液,从中量取
待测液,从中量取 于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用
于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用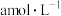 硫酸铈
硫酸铈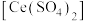 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗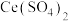 溶液bmL。产品中CuCl的质量分数为
溶液bmL。产品中CuCl的质量分数为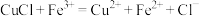 ,
, )
)(7)下列有关滴定的说法错误的是________(填字母)。
| A.未用标准溶液润洗滴定管会使测定结果偏低 |
| B.滴定时要适当控制滴定速度 |
| C.在接近终点时,使用“半滴操作”可提高滴定的准确度 |
| D.滴定前滴定管尖嘴部分有气泡,滴定后无气泡会使测定结果偏低 |
您最近一年使用:0次
名校
解题方法
7 . 铈(Ce)是一种典型的稀土元素,属于国家战略资源。以某废料(主要含 ,还含少量
,还含少量 、
、 、
、 及微量MnO)为原料可制备无水氯化铈
及微量MnO)为原料可制备无水氯化铈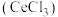 ,主要步骤如下:
,主要步骤如下:
(1)酸浸:用稀硫酸和双氧水的混合溶液浸取废料粉末,浸取液中含有 、
、 、
、 、
、 等金属阳离子。已知
等金属阳离子。已知 不溶于水,写出其发生反应的离子方程式:
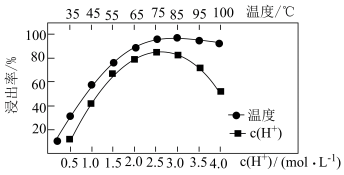
不溶于水,写出其发生反应的离子方程式:________ 。Ce的浸出率与 、温度的关系如图所示。生产中应选择的适宜条件为
、温度的关系如图所示。生产中应选择的适宜条件为________ 。
(2)除杂:向浸出液中加入NaOH溶液调节pH除去 、
、 。注:当
。注:当 时,
时, 沉淀开始溶解。有关沉淀数据(25℃)如下表(“完全沉淀”时金属离子浓度
沉淀开始溶解。有关沉淀数据(25℃)如下表(“完全沉淀”时金属离子浓度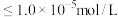 )。
)。
则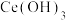 的
的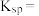
________ ,若浸取液中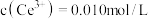 ,则须调节溶液pH的范围是
,则须调节溶液pH的范围是________ (加入NaOH溶液过程忽略体积变化)。
(3)萃取与反萃取:向除杂后的溶液中,加入有机物HT,发生反应: (水层)+3HT(有机层)
(水层)+3HT(有机层)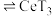 (有机层)
(有机层)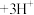 (水层)。向分离所得有机层中加入
(水层)。向分离所得有机层中加入_______ 能获得较纯的 溶液。
溶液。
结晶析出:将 溶液蒸发浓缩、冷却结晶,过滤,得到
溶液蒸发浓缩、冷却结晶,过滤,得到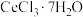 晶体。
晶体。
(4)加热脱水:将 固体和
固体和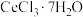 混合,在真空中加热可得无水
混合,在真空中加热可得无水 。加入
。加入 固体的作用是
固体的作用是________ 。
(5)对 样品纯度进行测定的方法:准确称取样品62.50g,配成1000mL溶液,取50.00mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵
样品纯度进行测定的方法:准确称取样品62.50g,配成1000mL溶液,取50.00mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵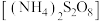 溶液使
溶液使 被氧化为
被氧化为 ,萃取剂萃取
,萃取剂萃取 ,再用
,再用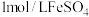 标准溶液滴定至终点,重复2~3次,平均消耗标准液10.00mL,则
标准溶液滴定至终点,重复2~3次,平均消耗标准液10.00mL,则 样品的纯度为
样品的纯度为________ %(保留小数点后两位)。
 ,还含少量
,还含少量 、
、 、
、 及微量MnO)为原料可制备无水氯化铈
及微量MnO)为原料可制备无水氯化铈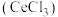 ,主要步骤如下:
,主要步骤如下:(1)酸浸:用稀硫酸和双氧水的混合溶液浸取废料粉末,浸取液中含有
 、
、 、
、 、
、 等金属阳离子。已知
等金属阳离子。已知 不溶于水,写出其发生反应的离子方程式:
不溶于水,写出其发生反应的离子方程式: 、温度的关系如图所示。生产中应选择的适宜条件为
、温度的关系如图所示。生产中应选择的适宜条件为
(2)除杂:向浸出液中加入NaOH溶液调节pH除去
 、
、 。注:当
。注:当 时,
时, 沉淀开始溶解。有关沉淀数据(25℃)如下表(“完全沉淀”时金属离子浓度
沉淀开始溶解。有关沉淀数据(25℃)如下表(“完全沉淀”时金属离子浓度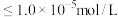 )。
)。沉淀 |
|
|
|
|
恰好完全沉淀时pH | 5.2 | 2.8 | 9.0 | 10.1 |
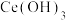 的
的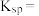
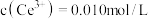 ,则须调节溶液pH的范围是
,则须调节溶液pH的范围是(3)萃取与反萃取:向除杂后的溶液中,加入有机物HT,发生反应:
 (水层)+3HT(有机层)
(水层)+3HT(有机层)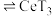 (有机层)
(有机层)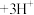 (水层)。向分离所得有机层中加入
(水层)。向分离所得有机层中加入 溶液。
溶液。结晶析出:将
 溶液蒸发浓缩、冷却结晶,过滤,得到
溶液蒸发浓缩、冷却结晶,过滤,得到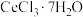 晶体。
晶体。(4)加热脱水:将
 固体和
固体和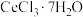 混合,在真空中加热可得无水
混合,在真空中加热可得无水 。加入
。加入 固体的作用是
固体的作用是(5)对
 样品纯度进行测定的方法:准确称取样品62.50g,配成1000mL溶液,取50.00mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵
样品纯度进行测定的方法:准确称取样品62.50g,配成1000mL溶液,取50.00mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵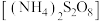 溶液使
溶液使 被氧化为
被氧化为 ,萃取剂萃取
,萃取剂萃取 ,再用
,再用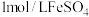 标准溶液滴定至终点,重复2~3次,平均消耗标准液10.00mL,则
标准溶液滴定至终点,重复2~3次,平均消耗标准液10.00mL,则 样品的纯度为
样品的纯度为
您最近一年使用:0次
2023-08-08更新
|
434次组卷
|
2卷引用:辽宁省丹东市等2地大石桥市第三高级中学等2校2022-2023学年高三上学期1月期末考试化学试题
名校
解题方法
8 . 下列反应的离子方程式书写正确的是
A.向 溶液中通入少量 溶液中通入少量 : :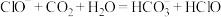 |
B.惰性电极电解 溶液: 溶液: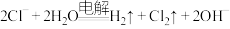 |
C. 溶液中加入足量的 溶液中加入足量的 : :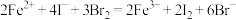 |
D. 溶于 溶于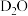 中: 中: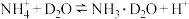 |
您最近一年使用:0次
2023-08-08更新
|
91次组卷
|
2卷引用:辽宁省丹东市等2地大石桥市第三高级中学等2校2022-2023学年高三上学期1月期末考试化学试题
9 . 将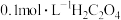 溶液逐滴滴入同浓度的酸性KMnO4溶液中(如图所示),下列说法正确的是
溶液逐滴滴入同浓度的酸性KMnO4溶液中(如图所示),下列说法正确的是
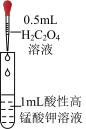
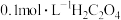 溶液逐滴滴入同浓度的酸性KMnO4溶液中(如图所示),下列说法正确的是
溶液逐滴滴入同浓度的酸性KMnO4溶液中(如图所示),下列说法正确的是
| A.H2C2O4属于二元强酸 |
| B.该反应中,每生成0.2molC=O键,转移的电子的物质的量为0.1mol |
| C.当胶头滴管中的溶液全部滴加完,一段时间后,试管中溶液的颜色由紫色变为无色 |
D.该反应的化学方程式为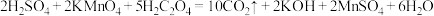 |
您最近一年使用:0次
2023-07-25更新
|
120次组卷
|
2卷引用:辽宁省部分学校2022-2023学年高二下学期期末考试化学试题
名校
解题方法
10 . 氮元素与人类的生命、生产等活动息息相关。
(1)亚硝酸钠( )在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
)在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。 ;
;
②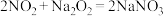
③酸性条件下, 、
、 和
和 都能与
都能与 反应生成
反应生成 和
和
请回答下列问题:
①装置A中发生反应的化学方程式为___________ 。
②装置B中的实验现象为___________ 。
③装置C的作用为___________ 。
④装置F中发生反应的离子方程式为___________ 。
(2)生物脱氮法流程如下: 的消除速率为
的消除速率为 ,则
,则 的消耗速率为
的消耗速率为___________  。
。
(3)目前,湿法 和
和 一体化脱除法是解决燃煤烟气领域的途径之一
一体化脱除法是解决燃煤烟气领域的途径之一
已知:两组实验中 溶液浓度均为
溶液浓度均为 ,
, 浓度均为
浓度均为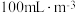
①图1是 、
、 、
、 对
对 的液相吸收。已知
的液相吸收。已知 溶液在脱除
溶液在脱除 时生成一种对空气无污染的气体,请写出该反应化学方程式
时生成一种对空气无污染的气体,请写出该反应化学方程式___________ 。 溶液同时吸收
溶液同时吸收 和
和 ,
, 脱除率在60%左右;单独吸收
脱除率在60%左右;单独吸收 时,
时, 脱除率在33%左右。结合①信息及图像解释原因
脱除率在33%左右。结合①信息及图像解释原因___________ 。
(1)亚硝酸钠(
 )在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
)在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。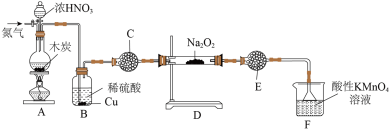
 ;
;②
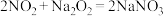
③酸性条件下,
 、
、 和
和 都能与
都能与 反应生成
反应生成 和
和
请回答下列问题:
①装置A中发生反应的化学方程式为
②装置B中的实验现象为
③装置C的作用为
④装置F中发生反应的离子方程式为
(2)生物脱氮法流程如下:
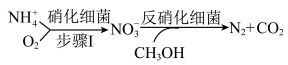
 的消除速率为
的消除速率为 ,则
,则 的消耗速率为
的消耗速率为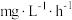 。
。(3)目前,湿法
 和
和 一体化脱除法是解决燃煤烟气领域的途径之一
一体化脱除法是解决燃煤烟气领域的途径之一已知:两组实验中
 溶液浓度均为
溶液浓度均为 ,
, 浓度均为
浓度均为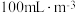
①图1是
 、
、 、
、 对
对 的液相吸收。已知
的液相吸收。已知 溶液在脱除
溶液在脱除 时生成一种对空气无污染的气体,请写出该反应化学方程式
时生成一种对空气无污染的气体,请写出该反应化学方程式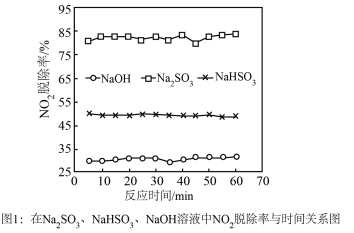
 溶液同时吸收
溶液同时吸收 和
和 ,
, 脱除率在60%左右;单独吸收
脱除率在60%左右;单独吸收 时,
时, 脱除率在33%左右。结合①信息及图像解释原因
脱除率在33%左右。结合①信息及图像解释原因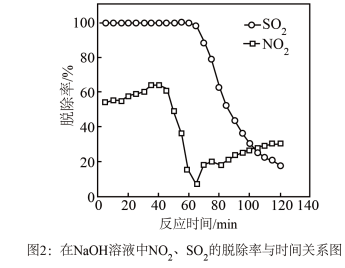
您最近一年使用:0次
2023-07-14更新
|
571次组卷
|
4卷引用:辽宁省辽南协作校2022-2023学年高一下学期期末考试化学试题
辽宁省辽南协作校2022-2023学年高一下学期期末考试化学试题(已下线)综合突破02 期末压轴80题之非选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)(已下线)综合02 期末压轴80题之非选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)四川省泸州市泸县第五中学2023-2024学年高二上学期开学考试化学试题