名校
1 . 二氧化碳的循环对生活、生产和环境有着重要的影响。
Ⅰ、传统蒸馒头常采用酵头发面,酵头可使面团在微生物作用下产生 ,从而使面团疏松,同时生成乳酸和醋酸等酸性物质,再加入
,从而使面团疏松,同时生成乳酸和醋酸等酸性物质,再加入 可调节面团酸度。
可调节面团酸度。
(1)等质量的碳酸钠和碳酸氢钠,消耗酸更多的是______ 。
(2)若面团发得不好,面团内的气孔少,会略有酸味。厨师会选择向面团中添加 ,而不再用
,而不再用 ,继续揉面后,上锅蒸也能蒸出松软的馒头。请解释添加
,继续揉面后,上锅蒸也能蒸出松软的馒头。请解释添加 的两个作用
的两个作用______ 。
(3)已知磷的含氧酸盐难分解,复合膨松剂发酵的效果更明显。某品牌复合膨松剂的说明书如图所示。其中葡萄糖酸-δ-内酯和淀粉是助剂(防止膨松剂分解、吸潮结块而失效)。推测焦磷酸二氢二钠的作用是______ 。
Ⅱ、二氧化碳的捕捉与封存是未来实现低碳经济转型的重要途径。
(4)科学家设计出烧碱溶液捕捉 法,原理如图所示
法,原理如图所示
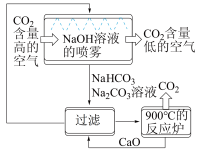
①该过程中能实现NaOH溶液再生的反应为 和
和______ 。
②若喷洒完100mL5mol/L的NaOH溶液后,测得吸收液中的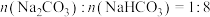 ,则被吸收的
,则被吸收的 在标况下的体积为
在标况下的体积为______ L。
③下列溶液中,也能用作“捕捉”二氧化碳试剂的是______ (填序号)。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.稀硫酸
溶液 D.稀硫酸
(5)Au@ 蛋黄型空心球催化剂技术实现了
蛋黄型空心球催化剂技术实现了 封存和能量储存双重效果,其原理如图1所示。制得的甲烷(
封存和能量储存双重效果,其原理如图1所示。制得的甲烷( )通过两步法可制取
)通过两步法可制取 ,原理如图2所示。
,原理如图2所示。
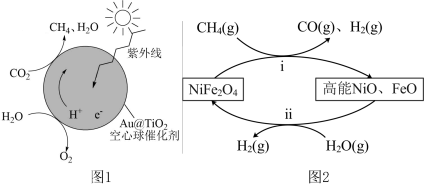
①已知 中H为+1价,则空心球催化剂技术中获得的
中H为+1价,则空心球催化剂技术中获得的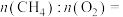
______ 。
②若不考虑过程中原料损失,则16g 通过两步法最多可制得
通过两步法最多可制得 的物质的量为
的物质的量为______ mol。
Ⅰ、传统蒸馒头常采用酵头发面,酵头可使面团在微生物作用下产生
 ,从而使面团疏松,同时生成乳酸和醋酸等酸性物质,再加入
,从而使面团疏松,同时生成乳酸和醋酸等酸性物质,再加入 可调节面团酸度。
可调节面团酸度。(1)等质量的碳酸钠和碳酸氢钠,消耗酸更多的是
(2)若面团发得不好,面团内的气孔少,会略有酸味。厨师会选择向面团中添加
 ,而不再用
,而不再用 ,继续揉面后,上锅蒸也能蒸出松软的馒头。请解释添加
,继续揉面后,上锅蒸也能蒸出松软的馒头。请解释添加 的两个作用
的两个作用(3)已知磷的含氧酸盐难分解,复合膨松剂发酵的效果更明显。某品牌复合膨松剂的说明书如图所示。其中葡萄糖酸-δ-内酯和淀粉是助剂(防止膨松剂分解、吸潮结块而失效)。推测焦磷酸二氢二钠的作用是
| 【名称】xx复合膨松剂 【保质期】24个月 【净含量】1kg 【使用量】面粉用量的0.5%~2.5% 【配料】碳酸氢钠、焦磷酸二氢二钠、碳酸钙、葡萄糖酸-δ-内酯、淀粉 【适用范围】适用于各类馒头、包子等发酵面制品以及面包、糕点等的制作 【保存方法】阴凉干燥处存储 |
Ⅱ、二氧化碳的捕捉与封存是未来实现低碳经济转型的重要途径。
(4)科学家设计出烧碱溶液捕捉
 法,原理如图所示
法,原理如图所示
①该过程中能实现NaOH溶液再生的反应为
 和
和②若喷洒完100mL5mol/L的NaOH溶液后,测得吸收液中的
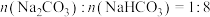 ,则被吸收的
,则被吸收的 在标况下的体积为
在标况下的体积为③下列溶液中,也能用作“捕捉”二氧化碳试剂的是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.稀硫酸
溶液 D.稀硫酸(5)Au@
 蛋黄型空心球催化剂技术实现了
蛋黄型空心球催化剂技术实现了 封存和能量储存双重效果,其原理如图1所示。制得的甲烷(
封存和能量储存双重效果,其原理如图1所示。制得的甲烷( )通过两步法可制取
)通过两步法可制取 ,原理如图2所示。
,原理如图2所示。
①已知
 中H为+1价,则空心球催化剂技术中获得的
中H为+1价,则空心球催化剂技术中获得的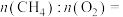
②若不考虑过程中原料损失,则16g
 通过两步法最多可制得
通过两步法最多可制得 的物质的量为
的物质的量为
您最近一年使用:0次
名校
解题方法
2 . 几种常见其化合物:Na、 、
、 、
、 、NaOH、
、NaOH、 。回答下列问题:
。回答下列问题:
(1)属于钠盐是___________ 。
(2)写出 的一种用途:
的一种用途:___________ 。
(3)向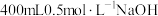 溶液中通入
溶液中通入 3.36L(标准状况),发生反应的离子方程式为
3.36L(标准状况),发生反应的离子方程式为___________ 。
(4)在密闭容器中,将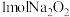 和
和 固体混合物加热至250℃,充分反应后,残留固体为
固体混合物加热至250℃,充分反应后,残留固体为___________ 。
(5)铁酸盐(钠、钾)为六价铁盐,是一种新型消毒剂。干法制备 的主要反应化学方程式为
的主要反应化学方程式为 ___________
___________ ___________
___________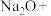 ___________
___________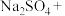 ___________,完成并配平该方程式
___________,完成并配平该方程式_______ 。
 、
、 、
、 、NaOH、
、NaOH、 。回答下列问题:
。回答下列问题:(1)属于钠盐是
(2)写出
 的一种用途:
的一种用途:(3)向
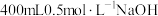 溶液中通入
溶液中通入 3.36L(标准状况),发生反应的离子方程式为
3.36L(标准状况),发生反应的离子方程式为(4)在密闭容器中,将
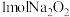 和
和 固体混合物加热至250℃,充分反应后,残留固体为
固体混合物加热至250℃,充分反应后,残留固体为(5)铁酸盐(钠、钾)为六价铁盐,是一种新型消毒剂。干法制备
 的主要反应化学方程式为
的主要反应化学方程式为 ___________
___________ ___________
___________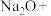 ___________
___________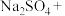 ___________,完成并配平该方程式
___________,完成并配平该方程式
您最近一年使用:0次
名校
3 . 亚硝酸( )是一种用途广泛的工业盐,有像食盐一样的外观和咸味,它能将血红蛋白氧化为高铁血红蛋白,使血红蛋白中的铁元素由+2价变为+3价,失去携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂。由于
)是一种用途广泛的工业盐,有像食盐一样的外观和咸味,它能将血红蛋白氧化为高铁血红蛋白,使血红蛋白中的铁元素由+2价变为+3价,失去携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂。由于 有毒,所以含该物质的废水必须处理后才能排放。回答以下问题:
有毒,所以含该物质的废水必须处理后才能排放。回答以下问题:
(1) 也可作为食品防腐剂,但由于亚硝酸钠具有一定的毒性,因此食品中用量和残留量均有严格规定.可用酸性
也可作为食品防腐剂,但由于亚硝酸钠具有一定的毒性,因此食品中用量和残留量均有严格规定.可用酸性 溶液测定
溶液测定 样品纯度,反应原理如下:
样品纯度,反应原理如下: ,
,
请完成该离子方程式并配平______ 。(请将离子方程式抄写在答题卡上并完成配平)
(2)从物质分类来看, 是
是______ 。
a.酸 b.正盐 c.酸式盐 d.碱 e.电解质 f.非电解质
(3)下列关于中毒与解毒原理中说法正确的是______。
(4)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列______反应中
表现出的性质与下列______反应中 表现出的性质完全相同。
表现出的性质完全相同。
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:______ 。
 )是一种用途广泛的工业盐,有像食盐一样的外观和咸味,它能将血红蛋白氧化为高铁血红蛋白,使血红蛋白中的铁元素由+2价变为+3价,失去携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂。由于
)是一种用途广泛的工业盐,有像食盐一样的外观和咸味,它能将血红蛋白氧化为高铁血红蛋白,使血红蛋白中的铁元素由+2价变为+3价,失去携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂。由于 有毒,所以含该物质的废水必须处理后才能排放。回答以下问题:
有毒,所以含该物质的废水必须处理后才能排放。回答以下问题:(1)
 也可作为食品防腐剂,但由于亚硝酸钠具有一定的毒性,因此食品中用量和残留量均有严格规定.可用酸性
也可作为食品防腐剂,但由于亚硝酸钠具有一定的毒性,因此食品中用量和残留量均有严格规定.可用酸性 溶液测定
溶液测定 样品纯度,反应原理如下:
样品纯度,反应原理如下: ,
,请完成该离子方程式并配平
(2)从物质分类来看,
 是
是a.酸 b.正盐 c.酸式盐 d.碱 e.电解质 f.非电解质
(3)下列关于中毒与解毒原理中说法正确的是______。
| A.中毒时亚硝酸盐被氧化 | B.中毒过程中血红蛋白显氧化性 |
| C.解毒时高铁血红蛋白被还原 | D.解毒剂美蓝应该具有还原性 |
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列______反应中
表现出的性质与下列______反应中 表现出的性质完全相同。
表现出的性质完全相同。A. |
B. |
C.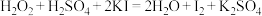 |
D.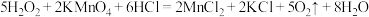 |
您最近一年使用:0次
4 . 亚硝酸钠 是一种防腐剂和护色剂,有一定的毒性。将亚硝酸钠加热到
是一种防腐剂和护色剂,有一定的毒性。将亚硝酸钠加热到 以上会分解产生
以上会分解产生 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:____
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:____ ___
___ ___
___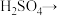 ___
___ ____
____ ___
___ _____
_____ ______
______ 。
。
(1)完成该化学方程式并配平:___________ 。
(2)上述反应的氧化产物与还原产物的个数比为___________ 。
(3)写出 与
与 反应的离子方程式:
反应的离子方程式:___________ 。
(4)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填字母)反应中
表现出的性质与下列___________(填字母)反应中 表现出的性质相同。
表现出的性质相同。
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学方程式,并用单线桥表示其电子转移的方向和数目:___________ 。
 是一种防腐剂和护色剂,有一定的毒性。将亚硝酸钠加热到
是一种防腐剂和护色剂,有一定的毒性。将亚硝酸钠加热到 以上会分解产生
以上会分解产生 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:____
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:____ ___
___ ___
___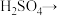 ___
___ ____
____ ___
___ _____
_____ ______
______ 。
。(1)完成该化学方程式并配平:
(2)上述反应的氧化产物与还原产物的个数比为
(3)写出
 与
与 反应的离子方程式:
反应的离子方程式:(4)误食
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填字母)反应中
表现出的性质与下列___________(填字母)反应中 表现出的性质相同。
表现出的性质相同。A. |
B. |
C.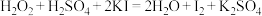 |
D.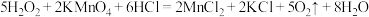 |
您最近一年使用:0次
解题方法
5 . 工厂烟气中含有的 ,直接排放会污染空气。
,直接排放会污染空气。
(1)从元素价态、物质类别的角度,预测并验证 的部分化学性质。
的部分化学性质。
①从硫元素的价态角度分析,预测 既有氧化性又有还原性。将
既有氧化性又有还原性。将 通入酸性高锰酸钾溶液中,紫色褪去,生成了
通入酸性高锰酸钾溶液中,紫色褪去,生成了 ,反应中体现了
,反应中体现了 的
的___________ 性。 还能与
还能与 反应,生成硫单质和水,反应的化学方程式为
反应,生成硫单质和水,反应的化学方程式为___________ ,该反应中,作氧化剂的是___________ (填化学式)。
②从物质类别角度分析, 属于酸性氧化物,类似
属于酸性氧化物,类似 ,
, 和过量
和过量 溶液反应的离子方程式为
溶液反应的离子方程式为___________ 。
(2)工业上燃煤时常在煤炭中加入石灰石,从源头上减少 排放。在煤炭中加入一定量石灰石,850℃在氧气的作用下,发生反应
排放。在煤炭中加入一定量石灰石,850℃在氧气的作用下,发生反应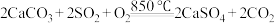 。
。
①通入的气体中氧气的浓度偏低时,产生的CO与 反应生成CaO等三种氧化物,该反应的化学方程式为
反应生成CaO等三种氧化物,该反应的化学方程式为___________ ,被氧化的元素为___________ (填元素符号)。
②从物质类别角度分析,上述涉及的物质中,既属于电解质又属于盐的是___________ 。
 ,直接排放会污染空气。
,直接排放会污染空气。(1)从元素价态、物质类别的角度,预测并验证
 的部分化学性质。
的部分化学性质。①从硫元素的价态角度分析,预测
 既有氧化性又有还原性。将
既有氧化性又有还原性。将 通入酸性高锰酸钾溶液中,紫色褪去,生成了
通入酸性高锰酸钾溶液中,紫色褪去,生成了 ,反应中体现了
,反应中体现了 的
的 还能与
还能与 反应,生成硫单质和水,反应的化学方程式为
反应,生成硫单质和水,反应的化学方程式为②从物质类别角度分析,
 属于酸性氧化物,类似
属于酸性氧化物,类似 ,
, 和过量
和过量 溶液反应的离子方程式为
溶液反应的离子方程式为(2)工业上燃煤时常在煤炭中加入石灰石,从源头上减少
 排放。在煤炭中加入一定量石灰石,850℃在氧气的作用下,发生反应
排放。在煤炭中加入一定量石灰石,850℃在氧气的作用下,发生反应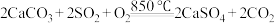 。
。①通入的气体中氧气的浓度偏低时,产生的CO与
 反应生成CaO等三种氧化物,该反应的化学方程式为
反应生成CaO等三种氧化物,该反应的化学方程式为②从物质类别角度分析,上述涉及的物质中,既属于电解质又属于盐的是
您最近一年使用:0次
2023-11-23更新
|
312次组卷
|
4卷引用:广东省茂名市七迳中学2023-2024学年高一上学期期中考试化学试卷
广东省茂名市七迳中学2023-2024学年高一上学期期中考试化学试卷广东省湛江市2023-2024学年高一上学期11月期中考试化学试题辽宁省葫芦岛市协作校2023-2024学年高一上学期第二次考试化学试题(已下线)第01讲 硫及其化合物-【寒假自学课】2024年高一化学寒假提升学与练(人教版2019)
名校
解题方法
6 . 按要求完成下列填空:
(1)碳酸钡在水中的电离方程式:___________ 。
(2)硫酸氢钠在熔融状态的电离方程式:___________ 。
(3)盐酸和小苏打反应的离子方程式:___________ 。
(4)向澄清石灰水中通入过量CO2反应的离子方程式:___________ 。
(5)铜绿Cu2(OH)2CO3溶于硫酸溶液的离子方程式:___________ 。
(6)配平方程式:___________ 。
_______K2CrO4+______HCl(浓)=_______KCl+______CrCl3+_______Cl2↑+________
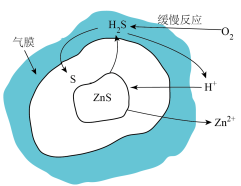
(7)锌矿(主要成分ZnS),浸出过程原理如图所示,ZnS浸出总反应的离子方程式为_______ 。
(1)碳酸钡在水中的电离方程式:
(2)硫酸氢钠在熔融状态的电离方程式:
(3)盐酸和小苏打反应的离子方程式:
(4)向澄清石灰水中通入过量CO2反应的离子方程式:
(5)铜绿Cu2(OH)2CO3溶于硫酸溶液的离子方程式:
(6)配平方程式:
_______K2CrO4+______HCl(浓)=_______KCl+______CrCl3+_______Cl2↑+________
(7)锌矿(主要成分ZnS),浸出过程原理如图所示,ZnS浸出总反应的离子方程式为

您最近一年使用:0次
名校
7 . I.高铁酸钠 是水处理过程中的一种新型的绿色多功能净水剂。,其净水过程中所发生的化学反应主要为
是水处理过程中的一种新型的绿色多功能净水剂。,其净水过程中所发生的化学反应主要为 (胶体)
(胶体)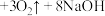 。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:
。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:
(1)高铁酸钠 属于
属于___________ (“酸”、“碱”、“盐”或“氧化物”,其中铁的化合价为___________ 价。
(2)将上述反应的化学方程式改写成离子方程式:___________ 。
(3)工业制备高铁酸钠有多种方法。其中一种方法的化学原理可用离子方程式表示为: 。用
。用单线桥 标出上述方程式的电子转移方向和数目___________ 。
(4)①实验室制得的氢氧化铁胶体中,氢氧化铁胶体粒子直径大小的范围是___________ 。
②某同学按要求制备了 胶体,但是他又向
胶体,但是他又向 胶体中逐滴加入了稀
胶体中逐滴加入了稀 溶液,结果出现了一系列变化。
溶液,结果出现了一系列变化。
现象1:先出现沉淀,原因是___________ 。
现象2:随后沉淀溶解,此反应的离子方程式是___________ 。
II、亚硝酸钠 像食盐一样有咸味,但有很强的毒性,误食
像食盐一样有咸味,但有很强的毒性,误食 会使人中每。已知亚硝酸钠能发生如下反应:
会使人中每。已知亚硝酸钠能发生如下反应: (未配平)。
(未配平)。
(5) 表现的性质是___________(填字母)
表现的性质是___________(填字母)
(6)利用氧化还原反应化合价升降总数相等配平该方程式:___________ 。
 是水处理过程中的一种新型的绿色多功能净水剂。,其净水过程中所发生的化学反应主要为
是水处理过程中的一种新型的绿色多功能净水剂。,其净水过程中所发生的化学反应主要为 (胶体)
(胶体)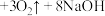 。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:
。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:(1)高铁酸钠
 属于
属于(2)将上述反应的化学方程式改写成离子方程式:
(3)工业制备高铁酸钠有多种方法。其中一种方法的化学原理可用离子方程式表示为:
 。用
。用(4)①实验室制得的氢氧化铁胶体中,氢氧化铁胶体粒子直径大小的范围是
②某同学按要求制备了
 胶体,但是他又向
胶体,但是他又向 胶体中逐滴加入了稀
胶体中逐滴加入了稀 溶液,结果出现了一系列变化。
溶液,结果出现了一系列变化。现象1:先出现沉淀,原因是
现象2:随后沉淀溶解,此反应的离子方程式是
II、亚硝酸钠
 像食盐一样有咸味,但有很强的毒性,误食
像食盐一样有咸味,但有很强的毒性,误食 会使人中每。已知亚硝酸钠能发生如下反应:
会使人中每。已知亚硝酸钠能发生如下反应: (未配平)。
(未配平)。(5)
 表现的性质是___________(填字母)
表现的性质是___________(填字母)| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
您最近一年使用:0次
名校
8 . Ⅰ.氧化还原反应在工农业生产、日常生活中具有广泛的用途。
(1)“服用维生素C,可以使食物中的 转化为
转化为 ”,说明维生素C具有
”,说明维生素C具有___________ (填“氧化”或“还原”)性。
(2)二氧化氯是一种高效消毒剂。工业制备 的反应为:
的反应为: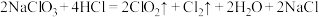 。
。
①氧化性:
___________ (填“>”或“<”) 。
。
② 在杀菌消毒过程中会产生副产物亚氯酸盐(
在杀菌消毒过程中会产生副产物亚氯酸盐( ),需将其转化为
),需将其转化为 除去,下列试剂中可将
除去,下列试剂中可将 转化为
转化为 的是
的是___________ (填字母)。
a. b.
b. c.KI d.
c.KI d.
③先将下述反应配平,再用单线桥标出该反应中电子转移的方向和数目_______________ 。

Ⅱ.实验室可用 和浓盐酸反应制取氯气,反应原理如下:
和浓盐酸反应制取氯气,反应原理如下:
(3)用双线桥标出电子得失情况_______________ 。
(4)若参加反应的HCl是73g,则被氧化的HCl有___________ g(保留一位小数点)。
(5)某同学设计如下实验研究 的性质:
的性质:
能证明 具有还原性的实验是
具有还原性的实验是___________ (填序号)。可作为证据的实验现象是___________ (填字母序号)。
(1)“服用维生素C,可以使食物中的
 转化为
转化为 ”,说明维生素C具有
”,说明维生素C具有(2)二氧化氯是一种高效消毒剂。工业制备
 的反应为:
的反应为: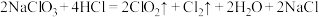 。
。①氧化性:

 。
。②
 在杀菌消毒过程中会产生副产物亚氯酸盐(
在杀菌消毒过程中会产生副产物亚氯酸盐( ),需将其转化为
),需将其转化为 除去,下列试剂中可将
除去,下列试剂中可将 转化为
转化为 的是
的是a.
 b.
b. c.KI d.
c.KI d.
③先将下述反应配平,再用单线桥标出该反应中电子转移的方向和数目

Ⅱ.实验室可用
 和浓盐酸反应制取氯气,反应原理如下:
和浓盐酸反应制取氯气,反应原理如下:
(3)用双线桥标出电子得失情况
(4)若参加反应的HCl是73g,则被氧化的HCl有
(5)某同学设计如下实验研究
 的性质:
的性质:| 序号 | 实验 | 实验现象 |
| ⅰ | 向5% 溶液中滴加酸性 溶液中滴加酸性 溶液 溶液 | a.溶液紫色褪去 b.有大量气泡产生 |
| ⅱ | 向5% 溶液中滴加淀粉碘化钾溶液 溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
 具有还原性的实验是
具有还原性的实验是
您最近一年使用:0次
名校
解题方法
9 . 早期人们用氯气(Cl2)为自来水消毒。下列方法均可制得氯气:
①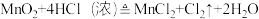 ;
;
②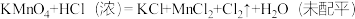 ;
;
③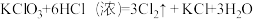 。
。
(1)反应①中,MnO2是___________ 剂;氧化产物是___________ (填化学式)。
(2)反应②中KMnO4、Cl2的氧化性由强到弱的顺序是___________ 。
(3)用单线桥法表示反应①化学方程式中的电子转移方向和数目:___________ 。
(4)反应③中,氧化产物与还原产物的质量比为___________ 。
(5)请将反应②配平:___________ 。
_______KMnO4+______HCl(浓)=_______KCl+_______MnCl2+_______Cl2↑+_______H2O
(6)工业废水中的 有毒,常在酸性条件下用Fe2+作处理剂,将
有毒,常在酸性条件下用Fe2+作处理剂,将 号转化为Cr3+,其中Fe2+会被转化为Fe3+,反应的离子方程式为
号转化为Cr3+,其中Fe2+会被转化为Fe3+,反应的离子方程式为___________ 。
①
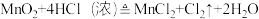 ;
;②
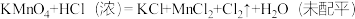 ;
;③
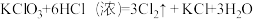 。
。(1)反应①中,MnO2是
(2)反应②中KMnO4、Cl2的氧化性由强到弱的顺序是
(3)用单线桥法表示反应①化学方程式中的电子转移方向和数目:
(4)反应③中,氧化产物与还原产物的质量比为
(5)请将反应②配平:
_______KMnO4+______HCl(浓)=_______KCl+_______MnCl2+_______Cl2↑+_______H2O
(6)工业废水中的
 有毒,常在酸性条件下用Fe2+作处理剂,将
有毒,常在酸性条件下用Fe2+作处理剂,将 号转化为Cr3+,其中Fe2+会被转化为Fe3+,反应的离子方程式为
号转化为Cr3+,其中Fe2+会被转化为Fe3+,反应的离子方程式为
您最近一年使用:0次
10 . 在三支试管中分别加入 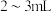
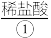 ,
, 溶液、
溶液、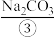 溶液,然后各滴入几滴
溶液,然后各滴入几滴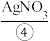 溶液,观察现象;再分别滴入少量
溶液,观察现象;再分别滴入少量 ,观察现象。回答下列问题:
,观察现象。回答下列问题:
(1)AgNO3 在水中电离的电离方程式为_______ 。
(2)①中分散质粒子直径为_______ (填“<1 nm”或“>100 nm”)。
(3)常温下,饱和②溶液_______ (填“能”或“不能”)发生丁达尔效应。
(4)从物质的组成来看,④属于_______ (填“酸”、“碱”、“盐”或“氧化物”),将其加入稀盐酸中,发生反应的化学方程式为_______ 。
(5)查阅资料可知,硝酸具有强氧化性,其浓度越小,氧化能力越弱。对于反应
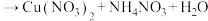 (未配平),该反应的化学方程式为
(未配平),该反应的化学方程式为_______ ,该反应中,每生成0.8gNH4NO3,转移的电子数为_______ NA。
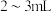
 ,
, 溶液、
溶液、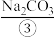 溶液,然后各滴入几滴
溶液,然后各滴入几滴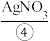 溶液,观察现象;再分别滴入少量
溶液,观察现象;再分别滴入少量 ,观察现象。回答下列问题:
,观察现象。回答下列问题:(1)AgNO3 在水中电离的电离方程式为
(2)①中分散质粒子直径为
(3)常温下,饱和②溶液
(4)从物质的组成来看,④属于
(5)查阅资料可知,硝酸具有强氧化性,其浓度越小,氧化能力越弱。对于反应

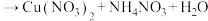 (未配平),该反应的化学方程式为
(未配平),该反应的化学方程式为
您最近一年使用:0次
2023-11-03更新
|
77次组卷
|
2卷引用:广东省部分名校2023-2024学年高一上学期联合质量监测化学试卷



