解题方法
1 . 某兴趣小组在实验室模拟海带提取碘的实验,并探究氧化剂及其作用原理。
Ⅰ.模拟海带提碘实验
该小组同学按如下实验流程进行实验:

(1)“步骤①”中发生反应生成碘单质,其离子方程式为_______ 。
(2)“步骤②”的操作名称是_______ 、_______ 。
Ⅱ.探究可用于海带提碘的氧化剂
ⅰ.实验准备
(3)配制 溶液
溶液
①需要称量 固体的质量是
固体的质量是_______  (保留2位小数)。
(保留2位小数)。
②在实验室配制上述溶液的过程中,需使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、_______ (填仪器名称)。
ⅱ.选用 作氧化剂
作氧化剂
(4)向试管中加入 溶液,再加入
溶液,再加入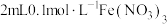 溶液(
溶液(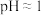 ),充分混合,溶液呈棕黄色;再向上述溶液中滴加2滴淀粉溶液,溶液变蓝。针对上述实验现象,该小组同学提出以下假设并进行相关实验探究。
),充分混合,溶液呈棕黄色;再向上述溶液中滴加2滴淀粉溶液,溶液变蓝。针对上述实验现象,该小组同学提出以下假设并进行相关实验探究。
假设1: 作氧化剂;
作氧化剂;
假设2:酸性条件下 作氧化剂;
作氧化剂;
假设3: 和酸性条件下的
和酸性条件下的 都作氧化剂。
都作氧化剂。
限选试剂: 溶液、
溶液、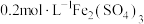 溶液、
溶液、 溶液、
溶液、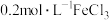 溶液
溶液
ⅲ.选用 作氧化剂
作氧化剂
(5)向试管中加入 溶液,再加入
溶液,再加入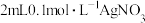 溶液
溶液 ,充分混合,试管中出现黄色沉淀,该黄色沉淀的主要成分为
,充分混合,试管中出现黄色沉淀,该黄色沉淀的主要成分为_______ (填化学式);静置后取上层清液,向其中滴加2滴淀粉溶液,溶液未变篮,说明 未氧化
未氧化 。
。
(6)资料显示,同浓度的 的氧化能力强于
的氧化能力强于 的。为进一步探究
的。为进一步探究 能否氧化
能否氧化 ,该小组设计如图所示装置进行实验。实验过程中,观察到电流表指针发生偏转。
,该小组设计如图所示装置进行实验。实验过程中,观察到电流表指针发生偏转。

①上述装置的盐桥中应选择_______ 作为电解质(填标号)。
A. B.
B. C.
C. D.
D.
②与(5)中实验相比,(6)中装置能够实现 氧化
氧化 的原因是
的原因是_______ 。
Ⅰ.模拟海带提碘实验
该小组同学按如下实验流程进行实验:

(1)“步骤①”中发生反应生成碘单质,其离子方程式为
(2)“步骤②”的操作名称是
Ⅱ.探究可用于海带提碘的氧化剂
ⅰ.实验准备
(3)配制
 溶液
溶液①需要称量
 固体的质量是
固体的质量是 (保留2位小数)。
(保留2位小数)。②在实验室配制上述溶液的过程中,需使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、
ⅱ.选用
 作氧化剂
作氧化剂(4)向试管中加入
 溶液,再加入
溶液,再加入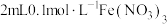 溶液(
溶液(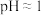 ),充分混合,溶液呈棕黄色;再向上述溶液中滴加2滴淀粉溶液,溶液变蓝。针对上述实验现象,该小组同学提出以下假设并进行相关实验探究。
),充分混合,溶液呈棕黄色;再向上述溶液中滴加2滴淀粉溶液,溶液变蓝。针对上述实验现象,该小组同学提出以下假设并进行相关实验探究。假设1:
 作氧化剂;
作氧化剂;假设2:酸性条件下
 作氧化剂;
作氧化剂;假设3:
 和酸性条件下的
和酸性条件下的 都作氧化剂。
都作氧化剂。限选试剂:
 溶液、
溶液、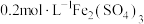 溶液、
溶液、 溶液、
溶液、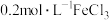 溶液
溶液| 实验操作 | 实验现象 | 实验结论 |
向试管中加入 溶液,再加入 溶液,再加入 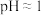 ),充分混合,再滴加2滴淀粉溶液 ),充分混合,再滴加2滴淀粉溶液 | 溶海变蓝 | 假设3成立 |
向试管中加入 溶液,再加入 溶液,再加入 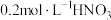 溶液和 溶液和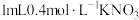 溶液,充分反应后,再滴加2滴淀粉溶液 溶液,充分反应后,再滴加2滴淀粉溶液 |
ⅲ.选用
 作氧化剂
作氧化剂(5)向试管中加入
 溶液,再加入
溶液,再加入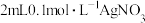 溶液
溶液 ,充分混合,试管中出现黄色沉淀,该黄色沉淀的主要成分为
,充分混合,试管中出现黄色沉淀,该黄色沉淀的主要成分为 未氧化
未氧化 。
。(6)资料显示,同浓度的
 的氧化能力强于
的氧化能力强于 的。为进一步探究
的。为进一步探究 能否氧化
能否氧化 ,该小组设计如图所示装置进行实验。实验过程中,观察到电流表指针发生偏转。
,该小组设计如图所示装置进行实验。实验过程中,观察到电流表指针发生偏转。
①上述装置的盐桥中应选择
A.
 B.
B. C.
C. D.
D.
②与(5)中实验相比,(6)中装置能够实现
 氧化
氧化 的原因是
的原因是
您最近一年使用:0次
解题方法
2 . 亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原NaClO3,可较安全地生成ClO2,反应的离子方程式为_______ 。
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法做如下检测(已知ClO2存在于pH为4~6的溶液中,ClO 存在于中性溶液中):
存在于中性溶液中):
①取0.50 L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:_______ 。
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4 mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00 mL。该水样中ClO2的浓度是_______ mg·L-1。
(3)某学习小组设计如下装置制取亚氯酸钠(NaClO2)。
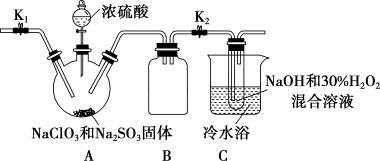
①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式:_______ 。
②将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。装置B的作用是_______ 。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原NaClO3,可较安全地生成ClO2,反应的离子方程式为
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法做如下检测(已知ClO2存在于pH为4~6的溶液中,ClO
 存在于中性溶液中):
存在于中性溶液中):①取0.50 L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4 mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00 mL。该水样中ClO2的浓度是
(3)某学习小组设计如下装置制取亚氯酸钠(NaClO2)。

①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式:
②将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。装置B的作用是
您最近一年使用:0次
名校
3 . 人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用且能够更好地保护环境,请回答下列问题:
(1)工业合成氨为氮肥的生产作出了巨大贡献。 和
和 在催化剂表面合成氨的微观历程及能量变化的示意图如下,用
在催化剂表面合成氨的微观历程及能量变化的示意图如下,用 、
、 、
、 分别
分别 、
、 、
、 。
。
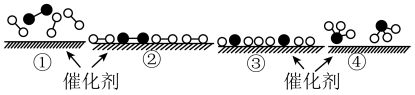
已知工业合成氨: 是一个放热反应。
是一个放热反应。
下列说法正确的是___________。
(2)以下是 (
( 和
和 的起始物质的量之比为1∶3)在不同条件下达到平衡状态时
的起始物质的量之比为1∶3)在不同条件下达到平衡状态时 的转化率,由表中数据可知:
的转化率,由表中数据可知:
①提高该化学反应限度的途径是___________ 。
② 含量达到98.8%的条件是
含量达到98.8%的条件是___________ ,而实际工业生产通常选择温度400~500℃,原因是___________ ,压强选择10MPa~30MPa,原因是___________ 。
(3)过渡施用氮肥将导致大气中 含量增高,加剧雾霾的形成。
含量增高,加剧雾霾的形成。 是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)
是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)
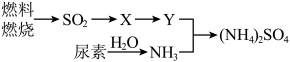
①X可能是 或
或___________ ,Y是___________
②尿素 是一种常用(有机氮肥,缓慢与
是一种常用(有机氮肥,缓慢与 发生非氧化还原反应释放出
发生非氧化还原反应释放出 和另外一种气体,该反应的化学方程式为
和另外一种气体,该反应的化学方程式为___________ 。
(1)工业合成氨为氮肥的生产作出了巨大贡献。
 和
和 在催化剂表面合成氨的微观历程及能量变化的示意图如下,用
在催化剂表面合成氨的微观历程及能量变化的示意图如下,用 、
、 、
、 分别
分别 、
、 、
、 。
。
已知工业合成氨:
 是一个放热反应。
是一个放热反应。下列说法正确的是___________。
| A.使用催化剂,可以加快合成氨的反应速率 |
| B.②→③过程,是吸热过程且只有H-H键断裂 |
C.③→④过程,N原子和H原子形成了含有极性键的 |
| D.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量 |
 (
( 和
和 的起始物质的量之比为1∶3)在不同条件下达到平衡状态时
的起始物质的量之比为1∶3)在不同条件下达到平衡状态时 的转化率,由表中数据可知:
的转化率,由表中数据可知:压强/MPa
温度/℃ | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
②
 含量达到98.8%的条件是
含量达到98.8%的条件是(3)过渡施用氮肥将导致大气中
 含量增高,加剧雾霾的形成。
含量增高,加剧雾霾的形成。 是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)
是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)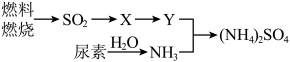
①X可能是
 或
或②尿素
 是一种常用(有机氮肥,缓慢与
是一种常用(有机氮肥,缓慢与 发生非氧化还原反应释放出
发生非氧化还原反应释放出 和另外一种气体,该反应的化学方程式为
和另外一种气体,该反应的化学方程式为
您最近一年使用:0次
名校
4 . 某含硫酸的酸性工业废水中含有 。光照下,草酸(化学式为
。光照下,草酸(化学式为 ,是二元弱酸)能将其中的
,是二元弱酸)能将其中的 转化为
转化为 。某课题组研究发现,少量铁明矾
。某课题组研究发现,少量铁明矾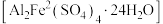 即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:在
即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:在 下,控制光照强度、废水样品、初始浓度和催化剂用量相同,调节不同的初始
下,控制光照强度、废水样品、初始浓度和催化剂用量相同,调节不同的初始 和一定浓度草酸溶液用量,作对比实验,完成了以下实验设计表。
和一定浓度草酸溶液用量,作对比实验,完成了以下实验设计表。
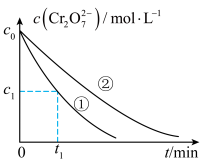
测得实验①和②溶液中的 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(1)写出草酸与重铬酸钾反应的离子方程式:_______ 。
(2)
_______ ,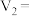
_______ ,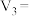
_______ 。
(3)实验①和②的结果表明_______ 。
(4)实验①中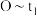 时段反应速率
时段反应速率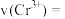
_______  (用代数式表示)。
(用代数式表示)。
 。光照下,草酸(化学式为
。光照下,草酸(化学式为 ,是二元弱酸)能将其中的
,是二元弱酸)能将其中的 转化为
转化为 。某课题组研究发现,少量铁明矾
。某课题组研究发现,少量铁明矾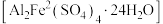 即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:在
即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:在 下,控制光照强度、废水样品、初始浓度和催化剂用量相同,调节不同的初始
下,控制光照强度、废水样品、初始浓度和催化剂用量相同,调节不同的初始 和一定浓度草酸溶液用量,作对比实验,完成了以下实验设计表。
和一定浓度草酸溶液用量,作对比实验,完成了以下实验设计表。| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 |  | 30 |
| ③ | 5 |  | 20 |  |
 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(1)写出草酸与重铬酸钾反应的离子方程式:
(2)

(3)实验①和②的结果表明
(4)实验①中
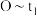 时段反应速率
时段反应速率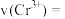
 (用代数式表示)。
(用代数式表示)。
您最近一年使用:0次
解题方法
5 . 化学方程式书写:
(1)氧化银(Ⅰ)被过氧化氢还原______ 。
(2)四氟合金酸(Ⅲ)银遇冷水后,分解出一酸一碱一盐(盐是常见的可溶性盐)______ 。
(3)二氯亚砜与二氧化铅反应制备二氯化铅______ 。
(4)由三氟化氮、氟气及五氟化砷反应制备四氟铵盐______ 。
(5)氯化亚锡在盐酸溶液中还原氯化汞,得到抗磁性的一价汞盐沉淀和六氯合锡酸______ 。
(1)氧化银(Ⅰ)被过氧化氢还原
(2)四氟合金酸(Ⅲ)银遇冷水后,分解出一酸一碱一盐(盐是常见的可溶性盐)
(3)二氯亚砜与二氧化铅反应制备二氯化铅
(4)由三氟化氮、氟气及五氟化砷反应制备四氟铵盐
(5)氯化亚锡在盐酸溶液中还原氯化汞,得到抗磁性的一价汞盐沉淀和六氯合锡酸
您最近一年使用:0次
名校
解题方法
6 . 生活无处不化学,例如生活中常见消毒剂:臭氧、“84”消毒液、二氧化氯、高铁酸钠等。
(1)臭氧和氧气互为_______ (填“同位素”或“同素异形体”),它们在一定条件下可以相互转化,该变化过程属于_______ (填“氧化还原反应”或“非氧化还原反应”)。
(2)常温下,将氯气通入NaOH溶液中,可以制得“84”消毒液,写出发生反应的离子方程式:_______ 。生活中“84”消毒液和洁厕灵(主要成分是稀盐酸)不能混合使用,原因是_______ 。
(3) 是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得:
是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得: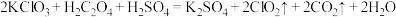 。产生1 mol
。产生1 mol  时,转移的电子的物质的量为
时,转移的电子的物质的量为_______ ;该反应中的氧化剂是_______ (填化学式)。
(4)高铁酸钠( )是一种新型的净水剂。其净水过程中发生的化学反应主要为
)是一种新型的净水剂。其净水过程中发生的化学反应主要为 (胶体)
(胶体)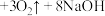 ,证明有
,证明有 胶体生成的方法为
胶体生成的方法为_______ 。
(1)臭氧和氧气互为
(2)常温下,将氯气通入NaOH溶液中,可以制得“84”消毒液,写出发生反应的离子方程式:
(3)
 是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得:
是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得: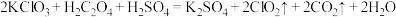 。产生1 mol
。产生1 mol  时,转移的电子的物质的量为
时,转移的电子的物质的量为(4)高铁酸钠(
 )是一种新型的净水剂。其净水过程中发生的化学反应主要为
)是一种新型的净水剂。其净水过程中发生的化学反应主要为 (胶体)
(胶体)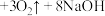 ,证明有
,证明有 胶体生成的方法为
胶体生成的方法为
您最近一年使用:0次
解题方法
7 . 明胶磷酸盐缓冲液可以用于肉毒梭菌检样的制备、微生物的分离和鉴别等。
I.央视《每周质量报告》曝光了少数明胶企业将皮革废料熬制成工业明胶,出售给个别制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,从而对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知有毒胶囊中含有Fe(CrO2)2,其中铬元素是+3价,则其中铁元素的化合价为_______ ,Fe(CrO2)2属于_______ (填“酸”“碱”“盐”或“氧化物”)。
(2)明胶溶于水形成胶体,与溶液相比,胶体最本质的特征是_______ 。
(3)将饱和FeCl3溶液分别滴入下述液体中,并继续加热,能形成胶体的是_______ 。
II.磷元素的含氧酸有H3PO4、H3PO3 (亚磷酸)、H3PO2(次磷酸)等多种。其中已知H3PO2+NaOH(过量)=NaH2PO2+H2O。回答下列问题:
(4)H3PO2中磷元素的化合价是_______ ;上述反应______ (填“属于”或“不属于”)氧化还原反应。
(5)H3PO2属于______ (选填“一”“二”或“三”)元酸。NaH2PO2属于______ (填“正盐”或“酸式盐”)。
(6)H3PO2可将溶液中的Ag+转化为银,自身变为H3PO4,可用于化学镀银。利用H3PO2进行化学镀银的反应中,氧化剂与还原剂的个数比为_______ 。
I.央视《每周质量报告》曝光了少数明胶企业将皮革废料熬制成工业明胶,出售给个别制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,从而对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知有毒胶囊中含有Fe(CrO2)2,其中铬元素是+3价,则其中铁元素的化合价为
(2)明胶溶于水形成胶体,与溶液相比,胶体最本质的特征是
(3)将饱和FeCl3溶液分别滴入下述液体中,并继续加热,能形成胶体的是
| A.冷水 | B.沸水 | C.NaCl溶液 | D.NaOH溶液 |
II.磷元素的含氧酸有H3PO4、H3PO3 (亚磷酸)、H3PO2(次磷酸)等多种。其中已知H3PO2+NaOH(过量)=NaH2PO2+H2O。回答下列问题:
(4)H3PO2中磷元素的化合价是
(5)H3PO2属于
(6)H3PO2可将溶液中的Ag+转化为银,自身变为H3PO4,可用于化学镀银。利用H3PO2进行化学镀银的反应中,氧化剂与还原剂的个数比为
您最近一年使用:0次
8 . 亚硝酸钠( )是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究
)是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究 的性质。
的性质。
(1)已知 能发生如下反应:
能发生如下反应: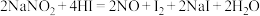 。用双线桥标出该反应的电子转移方向和数目:
。用双线桥标出该反应的电子转移方向和数目:___________ 。
(2)
___________ (填“是”或“不是”)电解质,根据 中N的化合价是
中N的化合价是___________ ,推测 具有
具有___________ (填“氧化性”、“还原性”或“氧化性和还原性”)。
(3)实验操作如表所示,请完善表格中的实验现象和结论(已知 遇淀粉变蓝)。
遇淀粉变蓝)。
③通过上述实验可知, 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_____________ 。
④写出实验3中发生反应的化学方程式:___________ 。
 )是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究
)是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究 的性质。
的性质。(1)已知
 能发生如下反应:
能发生如下反应: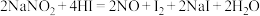 。用双线桥标出该反应的电子转移方向和数目:
。用双线桥标出该反应的电子转移方向和数目:(2)

 中N的化合价是
中N的化合价是 具有
具有(3)实验操作如表所示,请完善表格中的实验现象和结论(已知
 遇淀粉变蓝)。
遇淀粉变蓝)。| 实验 | 实验操作及现象或结果 | 结论 |
| 1 | 取 溶液于试管中,加入少量KI溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 溶液于试管中,加入少量KI溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 |  具有① 具有① |
| 2 | 取 溶液(先酸化好)于试管中,滴加足量的 溶液(先酸化好)于试管中,滴加足量的 溶液,可观察到的实验现象为② 溶液,可观察到的实验现象为② |  具有还原性 具有还原性 |
| 3 |  固体与70%硫酸反应生成了NO和 固体与70%硫酸反应生成了NO和 两种气体 两种气体 |  具有氧化性和还原性 具有氧化性和还原性 |
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为④写出实验3中发生反应的化学方程式:
您最近一年使用:0次
2023-06-08更新
|
346次组卷
|
2卷引用:广东省梅州市五华县田家炳中学2022-2023学年高一上学期12月月考化学试题
9 . 回答下列问题:
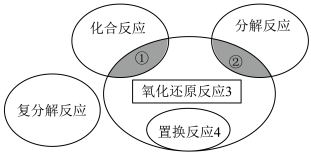
(1)氧化还原反应与四种基本类型反应的关系如图,则下列化学反应属于区域3的反应是 (填序号)。
(2)高锰酸钾和氢溴酸溶液可以发生如下反应: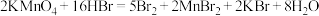 。
。
①其中_______ 元素被氧化(填化学式,下同),_______ 作氧化剂。
②参加反应的 体现出
体现出_______ 性和_______ 性。
③用“双线桥”标出该方程式电子转移的方向和数目:_______ 。
④当反应转移的电子数为15个时,有_______ 个 参与了该化学反应。
参与了该化学反应。
(3)写出下列氧化还原反应方程式或离子方程式:
①在海水提取溴的工艺中,溴气与二氧化硫同时通入水中可以得到一种含氧酸与一种无氧酸。化学方程式:_______ 。
②工业废水中的 有毒,常在酸性条件下用
有毒,常在酸性条件下用 做处理剂,将
做处理剂,将 转化为
转化为 。离子方程式:
。离子方程式:_______ 。
③酸性高锰酸钾溶液与过氧化氢混合可以得到氧气, 只发生了如下过程:
只发生了如下过程: 。离子方程式:
。离子方程式:_______ 。
(1)氧化还原反应与四种基本类型反应的关系如图,则下列化学反应属于区域3的反应是 (填序号)。

A. | B.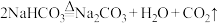 |
C. | D. |
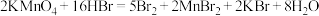 。
。①其中
②参加反应的
 体现出
体现出③用“双线桥”标出该方程式电子转移的方向和数目:
④当反应转移的电子数为15个时,有
 参与了该化学反应。
参与了该化学反应。(3)写出下列氧化还原反应方程式或离子方程式:
①在海水提取溴的工艺中,溴气与二氧化硫同时通入水中可以得到一种含氧酸与一种无氧酸。化学方程式:
②工业废水中的
 有毒,常在酸性条件下用
有毒,常在酸性条件下用 做处理剂,将
做处理剂,将 转化为
转化为 。离子方程式:
。离子方程式:③酸性高锰酸钾溶液与过氧化氢混合可以得到氧气,
 只发生了如下过程:
只发生了如下过程: 。离子方程式:
。离子方程式:
您最近一年使用:0次
名校
10 . 回答下列问题:
(1)已知实验室制备NO的反应为:3Cu + 8HNO3=3Cu(NO3)2+2NO↑ + 4H2O。
①反应中还原剂是_______ (填化学式,下同); 被还原的元素是_______ ;氧化产物是_______ 。
②若有 96克 Cu 参与反应时,则生成的NO质量为_______ g。
(2)配平下列方程式,并在所给方程式上用单线桥法标出电子转移的方向和数目_____ 。
_______Al+_______NaNO3+_______NaOH=_______NaAlO2+_______N2↑+_______H2O
(3)某反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程H2O2 →O2。
①该反应中的氧化剂是_______ 。
②写出该反应的化学方程式_______ 。
(1)已知实验室制备NO的反应为:3Cu + 8HNO3=3Cu(NO3)2+2NO↑ + 4H2O。
①反应中还原剂是
②若有 96克 Cu 参与反应时,则生成的NO质量为
(2)配平下列方程式,并在所给方程式上用单线桥法标出电子转移的方向和数目
_______Al+_______NaNO3+_______NaOH=_______NaAlO2+_______N2↑+_______H2O
(3)某反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程H2O2 →O2。
①该反应中的氧化剂是
②写出该反应的化学方程式
您最近一年使用:0次



