名校
1 . 绿水青山,保护环境是当社会发展必须关注的重要课题。氮氧化物和硫氧化物是造成大气污染的主要原因之一,消除氮氧化物有多种方法。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:
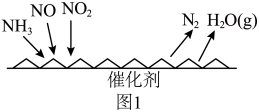
①氮氧化物会带来什么污染___________ (回答任一点);NH3与NO2反应的化学方程式___________ 。
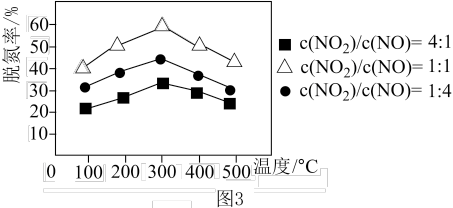
②用Fe做催化剂时,在氨气足量的情况下,不同 对应的脱氮率如图3所示,脱氮效果最佳的
对应的脱氮率如图3所示,脱氮效果最佳的 =
=___________ 。
(2)利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的亚硝酸钙Ca(NO2)2其部分工艺流程如图:
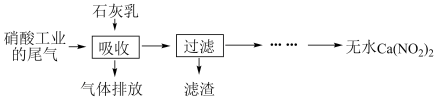
①上述工艺流程中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋)法,其目的是___________ ;
②生产中溶液需保持弱碱性。在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为___________ 。
(3)氢能是可循环利用的清洁能源,在2020年上海进博会展览中,诸多氢能源汽车纷纷亮相。氢-氧燃料电池被誉为氢能源汽车的心脏。某种氢-氧燃料电池的内部结构如图,
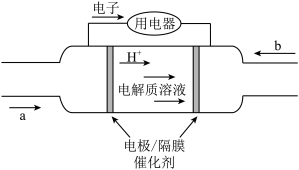

根据原电池的原理,回答下问题:
①a通入的是___________ 。
②右侧的电极反应式为___________ 。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:

①氮氧化物会带来什么污染
②用Fe做催化剂时,在氨气足量的情况下,不同
 对应的脱氮率如图3所示,脱氮效果最佳的
对应的脱氮率如图3所示,脱氮效果最佳的 =
=
(2)利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的亚硝酸钙Ca(NO2)2其部分工艺流程如图:

①上述工艺流程中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋)法,其目的是
②生产中溶液需保持弱碱性。在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为
(3)氢能是可循环利用的清洁能源,在2020年上海进博会展览中,诸多氢能源汽车纷纷亮相。氢-氧燃料电池被誉为氢能源汽车的心脏。某种氢-氧燃料电池的内部结构如图,


根据原电池的原理,回答下问题:
①a通入的是
②右侧的电极反应式为
您最近一年使用:0次
名校
2 . I.某温度时,在0.5L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如下图所示,由图中数据分析可得:
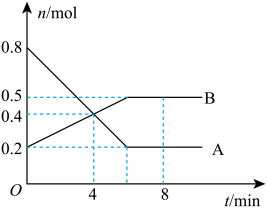
(1)该反应的化学方程式为___________ 。
(2)第4min时,正、逆反应速率的大小关系为v正___________ (填“>” “<”或“=”)v逆
(3)0~ 4min内,用B的浓度变化来表示该反应的平均反应速率为___________ mol ·L-1·min-1。
(4)平衡时混合气体中B的体积分数为___________ 。
II.某同学根据外界条件对化学反应速率影响的原理,设计了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如下表,请结合表中信息,回答有关问题:
(5)写出上述反应的离子方程式___________ 。
(6)若实验探究温度对该反应速率的影响,则a=___________ 采用比较实验的序号是___________ (填实验序号)

(1)该反应的化学方程式为
(2)第4min时,正、逆反应速率的大小关系为v正
(3)0~ 4min内,用B的浓度变化来表示该反应的平均反应速率为
(4)平衡时混合气体中B的体积分数为
II.某同学根据外界条件对化学反应速率影响的原理,设计了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如下表,请结合表中信息,回答有关问题:
| 实验序号 | 反应温度(°C) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | a |
| C | 25 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
(6)若实验探究温度对该反应速率的影响,则a=
您最近一年使用:0次
2023-05-16更新
|
330次组卷
|
2卷引用:广东省广州市真光中学2022-2023学年高一下学期期中考试化学试题
名校
3 . 完成下列问题。
(1)某化学学习小组为探究 和
和 的反应,进行如下实验(如图所示)。
的反应,进行如下实验(如图所示)。
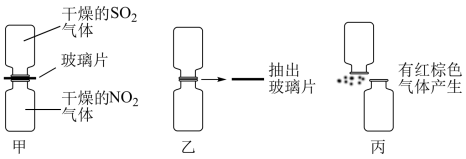
①图甲两集气瓶中___________ (填“上”或“下”)瓶颜色深。
②图丙中“有红棕色气体产生”说明 和
和 反应的产物中有
反应的产物中有___________ ,说明 在该反应中表现
在该反应中表现___________ 性。
③由图乙和图丙中的现象写出 和
和 反应的化学方程式:
反应的化学方程式:___________ 。
(2)为减少汽车尾气的污染,逐步向着新能源汽车发展。肼—空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,其工作原理如图所示,
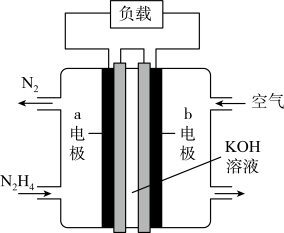
①该燃料电池中正极通入的物质是___________ ,负极发生的反应式为___________ 。
②电池工作时, 移向
移向___________ 电极(填“a”或“b”)。
(1)某化学学习小组为探究
 和
和 的反应,进行如下实验(如图所示)。
的反应,进行如下实验(如图所示)。
①图甲两集气瓶中
②图丙中“有红棕色气体产生”说明
 和
和 反应的产物中有
反应的产物中有 在该反应中表现
在该反应中表现③由图乙和图丙中的现象写出
 和
和 反应的化学方程式:
反应的化学方程式:(2)为减少汽车尾气的污染,逐步向着新能源汽车发展。肼—空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,其工作原理如图所示,

①该燃料电池中正极通入的物质是
②电池工作时,
 移向
移向
您最近一年使用:0次
名校
4 . Ⅰ、现有下列10种物质:①液态 ;②
;② 固体;③
固体;③ 溶液;④
溶液;④ ;⑤蔗糖溶液;⑥
;⑤蔗糖溶液;⑥ 粉末;⑦稀硫酸;⑧氨水;⑨
粉末;⑦稀硫酸;⑧氨水;⑨ ;⑩
;⑩
(1)物质中属于电解质的有___________ (填序号)。
(2)写出⑨与⑩在水溶液中反应的离子方程式:___________ 。
(3)写出过氧化钠与④反应的化学方程式并用双线桥表示其得失电子情况:___________ 。
(4)同温、同压下等质量的 和CO,它们所占的体积比为
和CO,它们所占的体积比为___________ 。
Ⅱ、在一个氧化还原反应体系中,反应物、生成物共有六种粒子: 、
、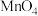 、
、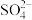 、
、 、
、 、
、 。
。
(5)补充并配平以下离子方程式:___________ 。
_____ +_____
+_____ +_____=_____
+_____=_____ +_____
+_____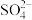 +____
+____
若反应过程中转移 ,则消耗标准状况下
,则消耗标准状况下 的体积为
的体积为___________ L。
 ;②
;② 固体;③
固体;③ 溶液;④
溶液;④ ;⑤蔗糖溶液;⑥
;⑤蔗糖溶液;⑥ 粉末;⑦稀硫酸;⑧氨水;⑨
粉末;⑦稀硫酸;⑧氨水;⑨ ;⑩
;⑩
(1)物质中属于电解质的有
(2)写出⑨与⑩在水溶液中反应的离子方程式:
(3)写出过氧化钠与④反应的化学方程式并用双线桥表示其得失电子情况:
(4)同温、同压下等质量的
 和CO,它们所占的体积比为
和CO,它们所占的体积比为Ⅱ、在一个氧化还原反应体系中,反应物、生成物共有六种粒子:
 、
、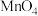 、
、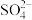 、
、 、
、 、
、 。
。(5)补充并配平以下离子方程式:
_____
 +_____
+_____ +_____=_____
+_____=_____ +_____
+_____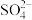 +____
+____若反应过程中转移
 ,则消耗标准状况下
,则消耗标准状况下 的体积为
的体积为
您最近一年使用:0次
2023-05-15更新
|
231次组卷
|
2卷引用:广东省广州中学2022-2023学年高一上学期期中考试化学试题
22-23高一上·广东广州·期中
5 . 某反应中反应物与生成物有: 、
、 、
、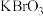 、
、 、
、 、
、 和一种未知物质X。
和一种未知物质X。
(1)已知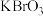 在反应中得到电子,则该反应的还原剂是
在反应中得到电子,则该反应的还原剂是_______ ;
(2)已知2个 在反应中得到10个电子生成X,则X的化学式为
在反应中得到10个电子生成X,则X的化学式为_______ 。
(3)根据上述反应可推知_______ 。
A.氧化性: B.氧化性:
B.氧化性: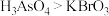
C.还原性: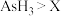 D.还原性:
D.还原性: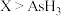
(4)请配平下面反应的反应方程式,并用单线桥法标出转移电子的方向和数目_______ 。

(5)上述反应中,有 铜被氧化,则参加反应的
铜被氧化,则参加反应的 的质量是
的质量是_______ ,被还原的 的质量是
的质量是_______ 。
 、
、 、
、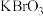 、
、 、
、 、
、 和一种未知物质X。
和一种未知物质X。(1)已知
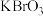 在反应中得到电子,则该反应的还原剂是
在反应中得到电子,则该反应的还原剂是(2)已知2个
 在反应中得到10个电子生成X,则X的化学式为
在反应中得到10个电子生成X,则X的化学式为(3)根据上述反应可推知
A.氧化性:
 B.氧化性:
B.氧化性: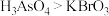
C.还原性:
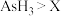 D.还原性:
D.还原性: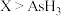
(4)请配平下面反应的反应方程式,并用单线桥法标出转移电子的方向和数目

(5)上述反应中,有
 铜被氧化,则参加反应的
铜被氧化,则参加反应的 的质量是
的质量是 的质量是
的质量是
您最近一年使用:0次
名校
解题方法
6 . I.氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)基态Cu原子核外电子排布式_____ ,CuH是_____ 晶体。
(2)写出CuH在氯气中燃烧的化学反应方程式:_____ 。
(3)CuH溶解在稀盐酸中生成的气体是_____ (填化学式)。
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:_____ 。
II.某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4(难溶盐)、Pb(MnO4)2(强电解质)、H2O、X(水溶液呈无色)、H2SO4,已知X是一种盐,且0.1molX在该反应中失去3.01×1023个电子。
(5)X的化学式为_____ 。
(6)写出该反应的化学方程式:_____ 。
(1)基态Cu原子核外电子排布式
(2)写出CuH在氯气中燃烧的化学反应方程式:
(3)CuH溶解在稀盐酸中生成的气体是
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:
II.某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4(难溶盐)、Pb(MnO4)2(强电解质)、H2O、X(水溶液呈无色)、H2SO4,已知X是一种盐,且0.1molX在该反应中失去3.01×1023个电子。
(5)X的化学式为
(6)写出该反应的化学方程式:
您最近一年使用:0次
名校
解题方法
7 . 写出下列方程式
(1)将SO2通入足量的澄清石灰水中的化学方程式:_________________
(2)过量铁粉与稀硝酸反应的离子方程式:________________________
(3)工业上制备粗硅的化学方程式:_____________
(4)焦亚硫酸钠(Na2S2O5)可用作食品的抗氧化剂,在测定某葡萄酒中Na2S2O5残留量时,用碘溶液(I2)进行滴定,已知氧化产物为SO ,该反应的离子方程式:
,该反应的离子方程式:______________________
(1)将SO2通入足量的澄清石灰水中的化学方程式:
(2)过量铁粉与稀硝酸反应的离子方程式:
(3)工业上制备粗硅的化学方程式:
(4)焦亚硫酸钠(Na2S2O5)可用作食品的抗氧化剂,在测定某葡萄酒中Na2S2O5残留量时,用碘溶液(I2)进行滴定,已知氧化产物为SO
 ,该反应的离子方程式:
,该反应的离子方程式:
您最近一年使用:0次
8 . 废旧锌锰电池中的黑锰粉含有MnO2、MnO(OH)、NH4Cl和少量ZnCl2、Fe2O3及炭黑等,为了保护环境、充分利用锰资源,通过如下流程制备MnSO4。

(1)Mn2+的价电子排布式为___________ 。
(2)“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为___________ 。
(3)探究“酸浸”中MnO2溶解的适宜操作。
实验Ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
实验Ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是___________ ,实验II中发生反应的离子方程式为___________ 。
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是___________ 。
(4)最近科学家研制出超薄铁磁β-MnSe半导体,β-MnSe的晶胞结构如图所示。

①β-MnSe中Mn的配位数为___________ 。
②若β- MnSe晶体的晶胞参数为a nm,阿伏加德罗常数的值为NA.则距离最近的两个锰原子之间的距离为___________ nm,β- MnSe的晶胞密度ρ=___________  (列出计算式)。
(列出计算式)。

(1)Mn2+的价电子排布式为
(2)“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为
(3)探究“酸浸”中MnO2溶解的适宜操作。
实验Ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
实验Ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是
(4)最近科学家研制出超薄铁磁β-MnSe半导体,β-MnSe的晶胞结构如图所示。

①β-MnSe中Mn的配位数为
②若β- MnSe晶体的晶胞参数为a nm,阿伏加德罗常数的值为NA.则距离最近的两个锰原子之间的距离为
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
9 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。下图是氯元素的化合价与部分物质类别的对应关系。

(1)A、B、C三种物质中,属于电解质的是_______ (填化学式)。
(2)写出 的电离方程式
的电离方程式_______ 。
(3)C可与HCl反应生成A,写出该反应的化学方程式_______ 。
(4)已知D可用于实验室制 ,其焰色试验为紫色。D可以用A与某强碱溶液在加热下反应制得,除生成D外,还生成一种无氧酸盐和水,写出该反应的化学方程式
,其焰色试验为紫色。D可以用A与某强碱溶液在加热下反应制得,除生成D外,还生成一种无氧酸盐和水,写出该反应的化学方程式_______ 。

(1)A、B、C三种物质中,属于电解质的是
(2)写出
 的电离方程式
的电离方程式(3)C可与HCl反应生成A,写出该反应的化学方程式
(4)已知D可用于实验室制
 ,其焰色试验为紫色。D可以用A与某强碱溶液在加热下反应制得,除生成D外,还生成一种无氧酸盐和水,写出该反应的化学方程式
,其焰色试验为紫色。D可以用A与某强碱溶液在加热下反应制得,除生成D外,还生成一种无氧酸盐和水,写出该反应的化学方程式
您最近一年使用:0次
名校
10 . 光伏材料是指能将太阳能直接转换成电能的材料,又称太阳能材料,只有半导体材料具有这种功能。可做太阳电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe、CuInSe等。
(1)Ga与B同主族,基态Ga原子价电子排布式为___________ 。
(2)Ga失去电子的逐级电离能(单位:kJ⋅mol⁻¹)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为___________ 和+3。
(3)下列事实能说明硫的非金属性比硒强的是___________ (填字母)。
A.溶解度: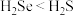
B.沸点: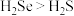
C.酸性: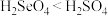
(4)Ga、P、S的电负性从大到小的顺序为___________ 。
(5)与Al元素在元素周期表中处于对角线的铍,在性质上具有相似性,写出铍的氧化物与氢氧化钠溶液反应生成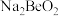 的离子方程式
的离子方程式___________ 。
(6)工业上以镓粉为原料,用镍催化法生产GaN,在氨气流中于1050~1100℃下加热30 min可制得疏松的灰色粉末状GaN,同时得到一种单质,写出该反应的化学方程式___________ 。
(1)Ga与B同主族,基态Ga原子价电子排布式为
(2)Ga失去电子的逐级电离能(单位:kJ⋅mol⁻¹)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为
(3)下列事实能说明硫的非金属性比硒强的是
A.溶解度:
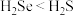
B.沸点:
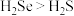
C.酸性:
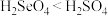
(4)Ga、P、S的电负性从大到小的顺序为
(5)与Al元素在元素周期表中处于对角线的铍,在性质上具有相似性,写出铍的氧化物与氢氧化钠溶液反应生成
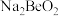 的离子方程式
的离子方程式(6)工业上以镓粉为原料,用镍催化法生产GaN,在氨气流中于1050~1100℃下加热30 min可制得疏松的灰色粉末状GaN,同时得到一种单质,写出该反应的化学方程式
您最近一年使用:0次



