名校
1 . ClO2(黄绿色易溶于水的气体)是一种高效、低毒的消毒剂。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收和释放进行了研究。

(1)仪器A的名称是_______________________ 。
(2)安装F中导管时,应选用图2中的___________________ 。
(3)A中发生反应生成ClO2和Cl2,其氧化产物和还原产物物质的量之比为__________ 。
(4)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是__________________ 。
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为____ 。
(6)ClO2很不稳定,需随用随制,产物用水吸收可得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样,量取V0 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L−1 Na2S2O3溶液滴定至终点。重复2次,测得消耗Na2S2O3溶液平均值为V1 mL。
(已知2ClO2+10I−+8H+=2Cl−+5I2+4H2O 2Na2S2O3+I2 Na2S4O6+2NaI)
Na2S4O6+2NaI)
计算该ClO2的浓度为______ g/L(用含字母的代数式表示,计算结果化简)。

(1)仪器A的名称是
(2)安装F中导管时,应选用图2中的
(3)A中发生反应生成ClO2和Cl2,其氧化产物和还原产物物质的量之比为
(4)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
(6)ClO2很不稳定,需随用随制,产物用水吸收可得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样,量取V0 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L−1 Na2S2O3溶液滴定至终点。重复2次,测得消耗Na2S2O3溶液平均值为V1 mL。
(已知2ClO2+10I−+8H+=2Cl−+5I2+4H2O 2Na2S2O3+I2
 Na2S4O6+2NaI)
Na2S4O6+2NaI)计算该ClO2的浓度为
您最近一年使用:0次
2020-03-27更新
|
388次组卷
|
6卷引用:宁夏回族自治区2020届高三下学期在线模拟化学试题
宁夏回族自治区2020届高三下学期在线模拟化学试题吉林省白城市第四中学2020届高三3月网上模拟测试化学试题江西省南昌市四校联盟2020届高三第二次联考理综化学试题福建省莆田第十五中学2019届高三上学期期中考试化学试题(已下线)专题11 富集在海水中的元素——氯 (限时精炼)-2022年高三毕业班化学常考点归纳与变式演练福建省长汀县第一中学2021-2022学年高三上学期第二次月考化学试题
名校
解题方法
2 . NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下,回答下列问题
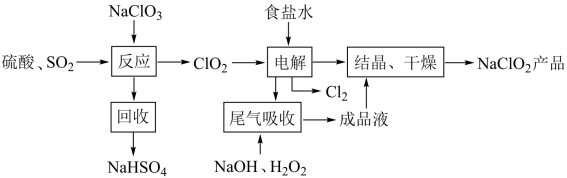
(1)NaClO2中Cl的化合价为______________________ .
(2)写出“反应”步骤中生成ClO2的化学方程式._______________________________ 。
(3)“电解”所用食盐水由粗盐水精制而成。粗盐精制时,为除去其中的Mg 2+和Ca 2+,要加入的试剂分别为_____________________ 、______________________ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应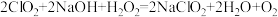 ,氧化剂与氧化产物的质量之比为
,氧化剂与氧化产物的质量之比为_________________ ,在标况下生成44.8LO2则转移电子的物质的量是____ .
(5)双氧水是中学常见的绿色化学试剂,既可以表现氧化性,又可以表现还原性。向双氧水中滴加酸性高锰酸钾溶液,产生气泡,紫红色褪去(已知Mn2+为无色),根据现象写出离子方程式._____________________________ 。

(1)NaClO2中Cl的化合价为
(2)写出“反应”步骤中生成ClO2的化学方程式.
(3)“电解”所用食盐水由粗盐水精制而成。粗盐精制时,为除去其中的Mg 2+和Ca 2+,要加入的试剂分别为
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应
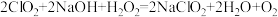 ,氧化剂与氧化产物的质量之比为
,氧化剂与氧化产物的质量之比为(5)双氧水是中学常见的绿色化学试剂,既可以表现氧化性,又可以表现还原性。向双氧水中滴加酸性高锰酸钾溶液,产生气泡,紫红色褪去(已知Mn2+为无色),根据现象写出离子方程式.
您最近一年使用:0次
名校
解题方法
3 . 一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:
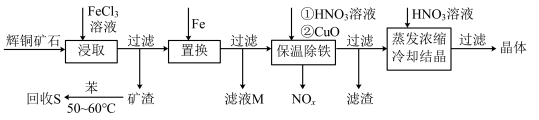
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:___ 。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②___ 。
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是___ 。
(4)向滤液M中加入(或通入)___ (填字母),可得到一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是__ ;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由_ 。
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S___ mol。


(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是
(4)向滤液M中加入(或通入)
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S

您最近一年使用:0次
2019-12-19更新
|
1285次组卷
|
10卷引用:宁夏六盘山高级中学2020届高三下学期第二次模拟考试理综化学试题
宁夏六盘山高级中学2020届高三下学期第二次模拟考试理综化学试题宁夏石嘴山市第三中学2020届高三第五次模拟考试理综化学试题广东省六校联盟(深圳实验,广州二中,珠海一中,惠州一中,东莞中学,中山纪中)2020届高三第二次联考理综化学试题2020届高三《新题速递·化学》1月第01期(考点11-13)江西省南昌市第二中学2020届高三5月模拟理综化学试题江西省南昌市第二中学2021届高三上学期第四次考试理综化学试题江西省新余市第四中学2021届高三化学上学期第四次考试试题2022届陕西省宝鸡市陈仓区高考模拟检测(二)理综化学试题天津市河东区2022-2023学年高三上学期期中检测化学试题(已下线)第三章 金属及其化合物 第15练 金属材料 金属冶炼
名校
解题方法
4 . 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
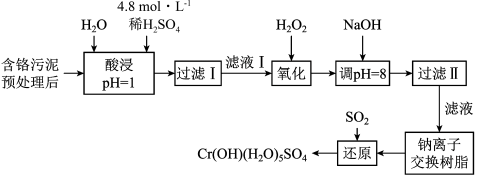
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 ______________________ 。
(2)酸浸时,为了提高浸取率可采取的措施有___________________________ 。(写出两个措施)
(3)加入H2O2的作用是_____________________________________ 。
(4)加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有______ ;但溶液的pH不能超过8,其理由是_______________ 。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是___________________ 。
(6)写出上述流程中用SO2进行还原的离子方程式___________________________ 。

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | —— | —— | 4.7 | —— |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
(2)酸浸时,为了提高浸取率可采取的措施有
(3)加入H2O2的作用是
(4)加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是
(6)写出上述流程中用SO2进行还原的离子方程式
您最近一年使用:0次
2019-12-09更新
|
139次组卷
|
2卷引用:宁夏回族自治区银川市兴庆区长庆高级中学2020届高三上学期第四次月考理综化学试题
名校
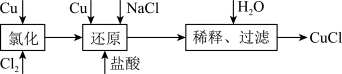
5 . 工业上以废铜为原料经一系列化学反应可生产氯化亚铜(CuCl),其工艺流程如下图所示:
试依据如图转化回答下列问题:
(1)工业生产Cl2时,尾气常用石灰乳吸收,而不用烧碱溶液吸收的原因是_______ 。
(2)还原过程中的产物为Na[CuCl2],试写出该反应的化学方程式:___________ 。
(3)合成结束后所得产品用酒精淋洗的目的是_______________ 。
(4)实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,试写出该反应的离子方程式:____ 。
试依据如图转化回答下列问题:
(1)工业生产Cl2时,尾气常用石灰乳吸收,而不用烧碱溶液吸收的原因是
(2)还原过程中的产物为Na[CuCl2],试写出该反应的化学方程式:
(3)合成结束后所得产品用酒精淋洗的目的是
(4)实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,试写出该反应的离子方程式:
您最近一年使用:0次
名校
6 . 某同学类比镁在二氧化碳中的燃烧反应:2Mg+CO2=2MgO+C,认为钠和二氧化碳也可以发生反应,他在实验室中选择以下装置对该反应能否发生进行了实验探究。
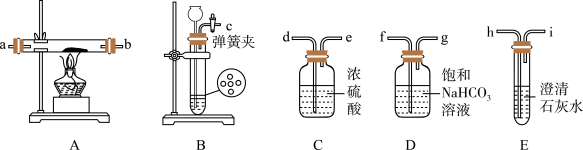
依据要求回答问题:
(1)二氧化碳的发生装置应选用上述装置中的__ (填装置下方对应字母),反应的离子方程式为___ 。
(2)为达到实验目的,选择上图中的装置,其连接顺序为:二氧化碳的发生装置→___ 。(按气流方向,用小写字母表示)。
(3)检查装置气密性良好,装好药品后,打开弹簧夹,待装置中的空气排净后才能点燃酒精灯。能说明装置中空气已经排净的现象是___ 。
(4)若反应过程中CO2足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:①生成的固体物质为Na2CO3,②生成的固体物质为Na2CO3和C的混合物,③生成的固体物质为Na2CO3和Na2O的混合物,④生成的固体物质为Na2O和C的混合物。报告给老师后,老师认为可以排除其中的3种情况,老师排除的理由是___ ;则钠与CO2反应的化学方程式为___ 。
(5)该同学经过反思,认为上述实验设计中存在缺陷。他查阅资料后得知,PdCl2溶液可以吸收CO,同时得到黑色的Pd。于是他在装置后加装一个盛PdCl2溶液的吸收装置,该装置中发生反应的化学方程式为___ 。

依据要求回答问题:
(1)二氧化碳的发生装置应选用上述装置中的
(2)为达到实验目的,选择上图中的装置,其连接顺序为:二氧化碳的发生装置→
(3)检查装置气密性良好,装好药品后,打开弹簧夹,待装置中的空气排净后才能点燃酒精灯。能说明装置中空气已经排净的现象是
(4)若反应过程中CO2足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:①生成的固体物质为Na2CO3,②生成的固体物质为Na2CO3和C的混合物,③生成的固体物质为Na2CO3和Na2O的混合物,④生成的固体物质为Na2O和C的混合物。报告给老师后,老师认为可以排除其中的3种情况,老师排除的理由是
(5)该同学经过反思,认为上述实验设计中存在缺陷。他查阅资料后得知,PdCl2溶液可以吸收CO,同时得到黑色的Pd。于是他在装置后加装一个盛PdCl2溶液的吸收装置,该装置中发生反应的化学方程式为
您最近一年使用:0次
名校
7 . 工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
已知生成氢氧化物沉淀的pH:
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是_____________ ;盐酸溶解MnCO3的离子方程式为___________ ;
(2)向溶液1中加入双氧水,反应的离子方程式是______________________________ ;
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式为_______________ ;
(4)将MnCl2转化为MnO2的一种方法是氧化法,其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式:5Mn2+ + 2ClO3- +____ =______ + ____ + ____ 。
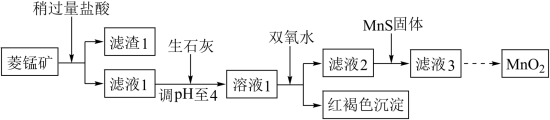
已知生成氢氧化物沉淀的pH:
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是
(2)向溶液1中加入双氧水,反应的离子方程式是
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式为
(4)将MnCl2转化为MnO2的一种方法是氧化法,其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式:5Mn2+ + 2ClO3- +
您最近一年使用:0次
名校
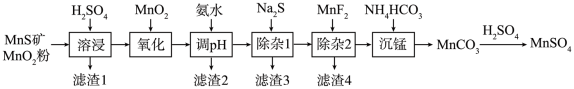
8 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
(1)“滤渣1”含有S和________________ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______ 。
(2)“氧化”中添加适量的MnO2的作用是将________________________ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______ ~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是______
(6)写出“沉锰”的离子方程式_____________________________________ 。

相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(2)“氧化”中添加适量的MnO2的作用是将
(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
您最近一年使用:0次
2019-09-07更新
|
364次组卷
|
7卷引用:宁夏石嘴山市第三中学2020届高三上学期第一次适应性(开学)考试化学试题
9 . 氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下
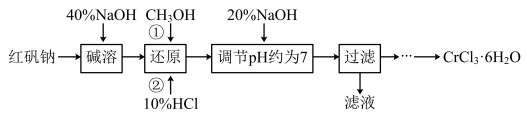
已知:
①Cr2O72-+H2O⇌2CrO42-+2H+;
②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)写出碱溶发生反应的化学方程式___________________________ ,所加40‰NaOH不宜过量太多的原因是_________________________________ 。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式______________________ ,反应后从剩余溶液中分离出CH3OH的实验方法是___________ 。
(3)使用下列用品来测定溶液的pH,合理的是___________ (填字母)。
A.酚酞溶液 B.石蕊试纸 C.pH计
(4)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得的洁净固体完全溶解于过量的盐酸中,蒸发浓缩,___________ ,过滤,___________ ,低温干燥,得到CrC3·6H2O(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)。
(5)若取原料红矾钠26.2g,实验最终得到氯化铬晶体21.32g,则该实验的产率为___________ 。

已知:
①Cr2O72-+H2O⇌2CrO42-+2H+;
②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)写出碱溶发生反应的化学方程式
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式
(3)使用下列用品来测定溶液的pH,合理的是
A.酚酞溶液 B.石蕊试纸 C.pH计
(4)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得的洁净固体完全溶解于过量的盐酸中,蒸发浓缩,
(5)若取原料红矾钠26.2g,实验最终得到氯化铬晶体21.32g,则该实验的产率为
您最近一年使用:0次
2019-01-30更新
|
159次组卷
|
2卷引用:【市级联考】宁夏回族自治区吴忠市2019届高三上学期期末考试化学试题
名校
解题方法
10 . 三氧化二钴(Co2O3)常用于制滤光眼镜的添加剂、催化剂和氧化剂。以含钴废料(主要成分CoO、Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如下:
(1)研磨的目的是____________ 。滤渣1的主要成分为______________ (填化学式)。
(2)酸浸时双氧水的作用有___________ 。不能用盐酸代替硫酸,因为Co2O3与盐酸反应生成Cl2,污染境,该反应的离子方程式为__________ 。
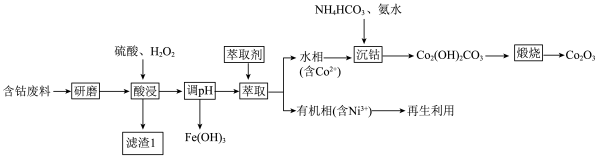
(3)在实验室里,萃取操作要用到的玻璃仪器主要有___________ 。有机相再生时提取出的Ni2+可用于制备氢镍电池,该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH。则放电时正极的电极反应式为__________ 。
(4)沉钴时发生反应的离子方程式为_______ 。煅烧时发生反应的化学方程式为_______ 。
(1)研磨的目的是
(2)酸浸时双氧水的作用有

(3)在实验室里,萃取操作要用到的玻璃仪器主要有
(4)沉钴时发生反应的离子方程式为
您最近一年使用:0次
2018-11-19更新
|
568次组卷
|
4卷引用:宁夏回族自治区银川一中2021届高三上学期第一次月考理综化学试题



