名校
1 . Ⅰ.磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的主要工艺流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采用的措施为_______ (写一条即可)
(2)溶浸过程中主要产生的离子为Fe3+、Mn2+、 ,请写出主要反应的离子方程式
,请写出主要反应的离子方程式_______ 。
(3)溶浸后的溶液中含有少量Fe2+、Cu2+、Ca2+,则“氧化除铁”过程中加入适量的软锰矿的目的是_______ 。
(4)“净化”工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要成分是_______ (填化学式)和CaF2
(5)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是_______ 。
Ⅱ.工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如如图所示:
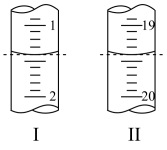
(6)消耗Na2S2O3标准溶液的体积为_______ mL。
(7)原样品中高铁酸钾的质量分数为_______ 。[M(K2FeO4)=198g/mol]
(8)若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数_______ (填“偏高”、“偏低”或“无影响”)。

回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采用的措施为
(2)溶浸过程中主要产生的离子为Fe3+、Mn2+、
 ,请写出主要反应的离子方程式
,请写出主要反应的离子方程式(3)溶浸后的溶液中含有少量Fe2+、Cu2+、Ca2+,则“氧化除铁”过程中加入适量的软锰矿的目的是
(4)“净化”工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要成分是
(5)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是
Ⅱ.工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如如图所示:

(6)消耗Na2S2O3标准溶液的体积为
(7)原样品中高铁酸钾的质量分数为
(8)若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数
您最近一年使用:0次
名校
2 . 某小组探究三草酸合铁酸钾(K3[Fe(C2O4)3]·3H2O)的热分解产物,按图所示装置进行实验。
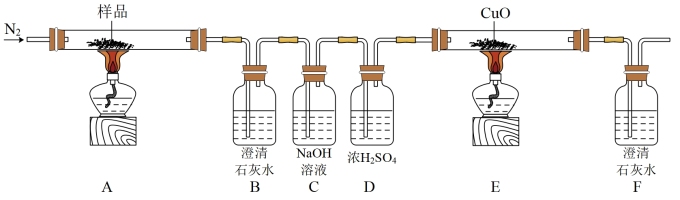
(1)通入N2的目的是___________ 。
(2)实验中观察到装置B变浑浊、E中固体变为红色、F变浑浊,由此可判断分解产物一定有___________ ,___________ 。
(3)样品完全分解后,装置A中的残留固体有FeO,Fe2O3和K2O,且FeO与Fe2O3的物质的量之比为2:1.再结合以上信息,写出三草酸合铁酸钾完全分解的化学方程式___________ 。
(4)为测定Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应,再用0.1000mol∙L-1硫代硫酸钠标准液滴定至终点,消耗标准液20.00mL(已知I2+2 =2I-+
=2I-+ )。
)。
①加热除去过量H2O2的目的是___________ 。
②加入KI溶液发生的离子方程式___________ 。
③溶液中铁元素的总含量为___________ g·L-1

(1)通入N2的目的是
(2)实验中观察到装置B变浑浊、E中固体变为红色、F变浑浊,由此可判断分解产物一定有
(3)样品完全分解后,装置A中的残留固体有FeO,Fe2O3和K2O,且FeO与Fe2O3的物质的量之比为2:1.再结合以上信息,写出三草酸合铁酸钾完全分解的化学方程式
(4)为测定Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应,再用0.1000mol∙L-1硫代硫酸钠标准液滴定至终点,消耗标准液20.00mL(已知I2+2
 =2I-+
=2I-+ )。
)。①加热除去过量H2O2的目的是
②加入KI溶液发生的离子方程式
③溶液中铁元素的总含量为
您最近一年使用:0次
2021-10-01更新
|
361次组卷
|
3卷引用:宁夏银川一中2022届高三第二次月考理科综合化学试题
宁夏银川一中2022届高三第二次月考理科综合化学试题(已下线)专题10 性质探究类综合实验-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)甘肃省会宁县第三中学2021-2022学年高三上学期第三次月考化学试题
解题方法
3 . 用软锰矿(主要成分为MnO2,所含杂质为质量分数约8%Fe3O4和约5%Al2O3)和BaS制备高纯MnCO3,同时制得Ba(OH)2,工艺流程如下:
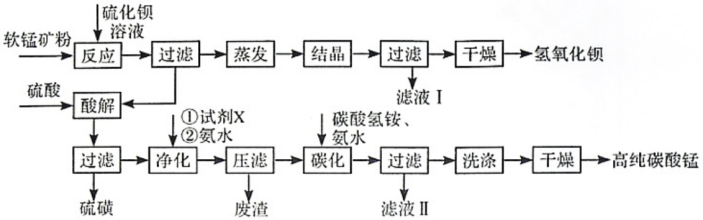
已知:25℃时相关物质的Ksp见下表
回答下列问题:
(1)MnO2与BaS溶液反应转化为MnO的化学方程式为___________ ,能否通过加热的方式加快该反应的速率,___________ (填“能”或“否”)
(2)已知MnO2为两性氧化物,保持BaS投料量不变,随软锰矿粉与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是___________ 。
(3)在实验室进行过滤操作时,除了使用铁架台和烧杯以外,还需要的玻璃仪器为___________ 。
(4)净化时需先加入的试剂X为___________ (填化学式) 。再使用氨水调溶液的pH,则pH的理论最小值为___________ (当溶液中某离子浓度小于1.0×10-5mol•L-1时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为___________ 。

已知:25℃时相关物质的Ksp见下表
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 |
(1)MnO2与BaS溶液反应转化为MnO的化学方程式为
(2)已知MnO2为两性氧化物,保持BaS投料量不变,随软锰矿粉与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是
(3)在实验室进行过滤操作时,除了使用铁架台和烧杯以外,还需要的玻璃仪器为
(4)净化时需先加入的试剂X为
(5)碳化过程中发生反应的离子方程式为
您最近一年使用:0次
2021-03-14更新
|
445次组卷
|
3卷引用:宁夏石嘴山市2021届高三下学期3月高考质量监测(一模) 化学试题
名校
4 . 某实验小组利用酸性KMnO4与H2C2O4反应来探究“外界条件对化学反应速率的影响”。回答下列问题:
(1)上表中V=__ ,若②③组为对比实验,则T__ 25℃(填“>”、“<”或“=”)。
(2)上述反应的化学方程式为__ 。
(3)t1__ t2(填“>”、“<”、“=”),若t3=50秒,则该条件下的反应速率v(KMnO4)=__ mol·L-1·s-1。
(4)有同学做实验时发现,反应开始时溶液褪色慢,但反应一段时间后溶液褪色明显加快。该同学猜测是催化剂加快了化学反应速率,要证实猜测,除选择硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择以下试剂中的__ 。(填字母序号)
A.硫酸钾 B.硫酸锰 C.硫酸 D.氯化锰 E.蒸馏水
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液褪色时间(s) | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||||
| ① | 0.20 | 2.0 | 0.010 | 4.0 | V | 25 | t1 |
| ② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
| ③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | T | t3 |
(2)上述反应的化学方程式为
(3)t1
(4)有同学做实验时发现,反应开始时溶液褪色慢,但反应一段时间后溶液褪色明显加快。该同学猜测是催化剂加快了化学反应速率,要证实猜测,除选择硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择以下试剂中的
A.硫酸钾 B.硫酸锰 C.硫酸 D.氯化锰 E.蒸馏水
您最近一年使用:0次
名校
解题方法
5 . Ⅰ.有A、B、C、D四种化合物,分别由K+、Ba2+、 、
、 、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
(1)推断A、B、C、D的化学式。
A________ ,B________ ,C___________ ,D___________ 。
(2)写出下列反应的离子方程式。
B与盐酸反应:______ 。
C与D反应:_________ 。
E(少量)与澄清石灰水反应:_______ 。
Ⅱ.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.已知该反应中H2O2只发生过程:H2O2→O2
(1)该反应中的还原剂是________ 。
(2)写出该反应的化学方程式,并用标出电子转移的方向和数目(单线桥):______
(3)若反应转移了0.3 mol电子,则产生的气体在标准状况下的体积为_______ 。
 、
、 、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。(1)推断A、B、C、D的化学式。
A
(2)写出下列反应的离子方程式。
B与盐酸反应:
C与D反应:
E(少量)与澄清石灰水反应:
Ⅱ.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.已知该反应中H2O2只发生过程:H2O2→O2
(1)该反应中的还原剂是
(2)写出该反应的化学方程式,并用标出电子转移的方向和数目(单线桥):
(3)若反应转移了0.3 mol电子,则产生的气体在标准状况下的体积为
您最近一年使用:0次
6 . 一种新型高效净水剂PAFC(聚合氯化铁铝[AlFe(OH)nC16-n]m),广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC,设计生产流程如图:

(1)浓盐酸配制一定物质的量浓度的稀盐酸,所用玻璃仪器除量筒和玻璃棒外,还有___ 。
A.容量瓶 B.烧杯 C.烧瓶 D.酒精灯
(2)下列关于PAFC的说法中正确的是____ 。
A.PAFC是一种无机高分子化合物
B.PAFC中Fe显+2价
C.PAFC溶于水能电离出OH-,是一种碱
D.PAFC在强酸性和强碱性溶液中均不能稳定存在
(3)步骤Ⅱ中取样分析的目的是___ 。
A.测定溶液中Fe2+与Fe3+的含量比
B.测定原料是否完全溶解
C.测定溶液中Fe2+的含量,以确定加入NaClO3的量
D.测定溶液中Al3+的含量
(4)写出向溶液中加入NaClO3时,发生反应的离子方程式:___Fe2++___H++___C1O →____Fe3++____Cl-+____H2O
→____Fe3++____Cl-+____H2O___ 。
(5)该化工厂的化验室为测定产品PAFC中A1和Fe的含量,进行下列试剂的选择和基本操作:
①测定时所需的试剂有___ 。
A.NH3·H2O B.NaOH C.CO2 D.NaClO3
②在测定过程中的操作顺序是:过滤、___ 、灼烧、__ 、称量。(写操作名称)。
③测定时,通过灼烧后等操作,直接测定的是___ 和___ 的质量(填化学式)。

(1)浓盐酸配制一定物质的量浓度的稀盐酸,所用玻璃仪器除量筒和玻璃棒外,还有
A.容量瓶 B.烧杯 C.烧瓶 D.酒精灯
(2)下列关于PAFC的说法中正确的是
A.PAFC是一种无机高分子化合物
B.PAFC中Fe显+2价
C.PAFC溶于水能电离出OH-,是一种碱
D.PAFC在强酸性和强碱性溶液中均不能稳定存在
(3)步骤Ⅱ中取样分析的目的是
A.测定溶液中Fe2+与Fe3+的含量比
B.测定原料是否完全溶解
C.测定溶液中Fe2+的含量,以确定加入NaClO3的量
D.测定溶液中Al3+的含量
(4)写出向溶液中加入NaClO3时,发生反应的离子方程式:___Fe2++___H++___C1O
 →____Fe3++____Cl-+____H2O
→____Fe3++____Cl-+____H2O(5)该化工厂的化验室为测定产品PAFC中A1和Fe的含量,进行下列试剂的选择和基本操作:
①测定时所需的试剂有
A.NH3·H2O B.NaOH C.CO2 D.NaClO3
②在测定过程中的操作顺序是:过滤、
③测定时,通过灼烧后等操作,直接测定的是
您最近一年使用:0次
名校
7 . 作为食品添加剂时,亚硝酸钠 可以增加肉类的鲜度,抑制微生物,保持肉制品的结构和营养价值;但是过量振入会导致中毒。某实验小组设计实验制备亚硝酸钠并进行含量测定。
可以增加肉类的鲜度,抑制微生物,保持肉制品的结构和营养价值;但是过量振入会导致中毒。某实验小组设计实验制备亚硝酸钠并进行含量测定。
Ⅰ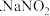 制备
制备
实验室以木炭、浓硝酸、 为主要原料按照如图所示装置制备亚硝酸钠
为主要原料按照如图所示装置制备亚硝酸钠 加热装置及部分夹持装置已略去
加热装置及部分夹持装置已略去 ,反应原理为:
,反应原理为:
回答下列问题:
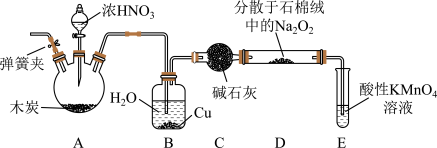
(1)连接好装置之后,下一步实验操作是______ 。
(2) 装置中铜的作用是
装置中铜的作用是______ 。
(3) 装置用于尾气处理,E中反应的离子方程式为
装置用于尾气处理,E中反应的离子方程式为______ 。
(4)实验结束阶段,熄灭酒精灯之后继续通入 直至装置冷却。此时通入
直至装置冷却。此时通入 的目的是
的目的是______ 。
Ⅱ 含量的测定
含量的测定
查阅资料可知:酸性 溶液可将
溶液可将 氧化为
氧化为 ,
, 还原成
还原成 。
。
(5)溶液配制:称取装置D中反应后的固体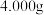 ,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至250mL的
,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至250mL的______ 中,加蒸馏水至______ 。
滴定:取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 酸性
酸性 溶液进行滴定,实验数据如下表所示:
溶液进行滴定,实验数据如下表所示:
(6)第4组实验数据出现异常,造成这种异常的原因可能是______  双项选择
双项选择 。
。
A.锥形瓶洗净后未干燥 滴定终了仰视读数
滴定终了仰视读数
C.滴定终了俯视读数 酸式滴定管用蒸馏水洗净后未用标准液润洗
酸式滴定管用蒸馏水洗净后未用标准液润洗
(7)根据表中数据,计算所得固体中亚硝酸钠的质量分数______ 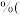 保留2位小数
保留2位小数 。
。
 可以增加肉类的鲜度,抑制微生物,保持肉制品的结构和营养价值;但是过量振入会导致中毒。某实验小组设计实验制备亚硝酸钠并进行含量测定。
可以增加肉类的鲜度,抑制微生物,保持肉制品的结构和营养价值;但是过量振入会导致中毒。某实验小组设计实验制备亚硝酸钠并进行含量测定。Ⅰ
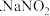 制备
制备实验室以木炭、浓硝酸、
 为主要原料按照如图所示装置制备亚硝酸钠
为主要原料按照如图所示装置制备亚硝酸钠 加热装置及部分夹持装置已略去
加热装置及部分夹持装置已略去 ,反应原理为:
,反应原理为:
回答下列问题:

(1)连接好装置之后,下一步实验操作是
(2)
 装置中铜的作用是
装置中铜的作用是(3)
 装置用于尾气处理,E中反应的离子方程式为
装置用于尾气处理,E中反应的离子方程式为(4)实验结束阶段,熄灭酒精灯之后继续通入
 直至装置冷却。此时通入
直至装置冷却。此时通入 的目的是
的目的是Ⅱ
 含量的测定
含量的测定查阅资料可知:酸性
 溶液可将
溶液可将 氧化为
氧化为 ,
, 还原成
还原成 。
。(5)溶液配制:称取装置D中反应后的固体
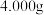 ,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至250mL的
,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至250mL的滴定:取
 溶液于锥形瓶中,用
溶液于锥形瓶中,用 酸性
酸性 溶液进行滴定,实验数据如下表所示:
溶液进行滴定,实验数据如下表所示:| 滴定次数 | 1 | 2 | 3 | 4 |
 溶液体积 溶液体积 | 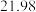 | 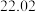 |  | 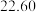 |
 双项选择
双项选择 。
。A.锥形瓶洗净后未干燥
 滴定终了仰视读数
滴定终了仰视读数C.滴定终了俯视读数
 酸式滴定管用蒸馏水洗净后未用标准液润洗
酸式滴定管用蒸馏水洗净后未用标准液润洗(7)根据表中数据,计算所得固体中亚硝酸钠的质量分数
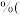 保留2位小数
保留2位小数 。
。
您最近一年使用:0次
2020-11-14更新
|
144次组卷
|
2卷引用:宁夏石嘴山市平罗中学2021-2022学年高三上学期期中考试化学试题
名校
解题方法
8 . 金属及其化合物在生产中用途广泛。从含铜丰富的自然资源黄铜矿(CuFeS2)中冶炼铜的工艺流程如图:
已知:CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓
(1)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为___ 。
(2)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为___ 。
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是___ 。(填离子符号)
(4)过滤3所得滤液中可以循环使用的物质有___ 和___ 。为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为___ 。
(5)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,发生的反应为6CuFeS2+13O2 3Cu2S+2Fe3O4+9O2,Cu2S+O2
3Cu2S+2Fe3O4+9O2,Cu2S+O2 2Cu+SO2。此工艺与前一工艺相比主要缺点有
2Cu+SO2。此工艺与前一工艺相比主要缺点有____ (任答一点)。

已知:CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓
(1)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为
(2)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是
(4)过滤3所得滤液中可以循环使用的物质有
(5)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,发生的反应为6CuFeS2+13O2
 3Cu2S+2Fe3O4+9O2,Cu2S+O2
3Cu2S+2Fe3O4+9O2,Cu2S+O2 2Cu+SO2。此工艺与前一工艺相比主要缺点有
2Cu+SO2。此工艺与前一工艺相比主要缺点有
您最近一年使用:0次
名校
9 . 明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如图:

回答下列问题:
(1)明矾净水的原理是_______ (用离子方程式表示)。
(2)操作Ⅰ是_____ ,操作Ⅱ是蒸发浓缩、_____ 、过滤、____ 、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是______ (只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是______ ,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO 转化为Mn2+):
转化为Mn2+):_________ 。
(5)已知:在pH=3、加热条件下,MnO 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:
可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________ ,滤渣2含有的物质是_______ 。

回答下列问题:
(1)明矾净水的原理是
(2)操作Ⅰ是
(3)检验滤液A中是否存在Fe2+的试剂是
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是
 转化为Mn2+):
转化为Mn2+):(5)已知:在pH=3、加热条件下,MnO
 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:
可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:
您最近一年使用:0次
2020-08-18更新
|
186次组卷
|
4卷引用:宁夏青铜峡市高级中学2021届高三12月月考理综化学试题
宁夏青铜峡市高级中学2021届高三12月月考理综化学试题黑龙江省哈尔滨师范大学青冈实验中学校2020届高三10月月考化学试题河南省洛阳市第一高级中学2021届高三9月月考化学试题(已下线)专题09 金属矿物的开发和利用(限时精练)-2022年高三毕业班化学常考点归纳与变式演练
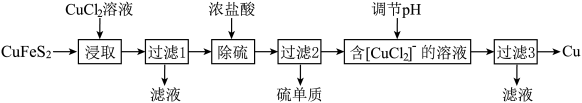
10 . 用海底锰结核(主要成分为MnO2,含少量MgO、Fe2O3、Al2O3、SiO2)为原料,制备金属锰、镁的一种工艺流程路线如下:
已知:①几种难溶物的溶度积(25℃)如下表所示:
②溶液中某离子浓度≤1.0×10-6mol·L-1时,认为该离子沉淀完全。
完成下列问题:
(1)“锰结核粉末”中MnO2与SO2反应的离子方程式为_____ 。
(2)“滤液1”中c(Mn2+)为0.18mol·L-1,则“调节pH”的范围为_______ ,“滤渣2”的成分为______ 。
(3)“Ⅲ”处“萃取剂”萃取的成分是___ ;“Ⅳ”处用“盐酸反萃”的作用是____ 。
(4)MgCl2·6H2O制取无水MgCl2时,需要在干燥的HCl气流中加热分解。HCl的作用为__________ 。
(5)该工艺流程中除电解余液可循环利用外,还能循环利用的试剂为____ 。
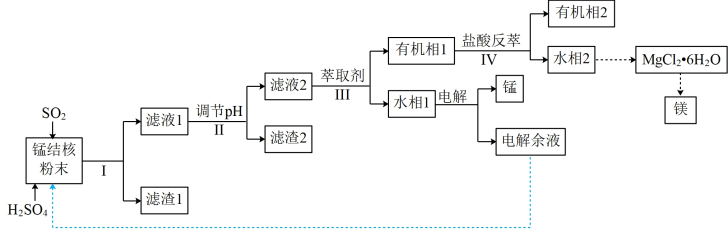
(6)一种海生假单孢菌(采自太平洋深海处),在无氧条件下以醋酸为电子供体还原MnO2生成Mn2+的机理如图所示。写出反应②③的总反应的离子方程式____________ 。

已知:①几种难溶物的溶度积(25℃)如下表所示:
| 化学式 | Mg(OH)2 | Mn(OH)2 | Al(OH)3 | Fe(OH)3 |
| Ksp | 1.8×10-11 | 1.8×10-13 | 1.0×10-33 | 4.0×10-38 |
②溶液中某离子浓度≤1.0×10-6mol·L-1时,认为该离子沉淀完全。
完成下列问题:
(1)“锰结核粉末”中MnO2与SO2反应的离子方程式为
(2)“滤液1”中c(Mn2+)为0.18mol·L-1,则“调节pH”的范围为
(3)“Ⅲ”处“萃取剂”萃取的成分是
(4)MgCl2·6H2O制取无水MgCl2时,需要在干燥的HCl气流中加热分解。HCl的作用为
(5)该工艺流程中除电解余液可循环利用外,还能循环利用的试剂为
(6)一种海生假单孢菌(采自太平洋深海处),在无氧条件下以醋酸为电子供体还原MnO2生成Mn2+的机理如图所示。写出反应②③的总反应的离子方程式

您最近一年使用:0次
2020-07-20更新
|
567次组卷
|
6卷引用:宁夏石嘴山市第三中学2021届高三上学期期末考试理综化学试题
宁夏石嘴山市第三中学2021届高三上学期期末考试理综化学试题河南省郑州市2020届高三第三次质量预测理科综合化学试题(已下线)2021年高考化学押题预测卷(山东卷)(01)(含考试版、答题卡、参考答案、全解全析)陕西省西安中学2021届高三第七次模拟考试化学试题甘肃省武威第六中学 2022~2023学年高三上学期第二次阶段性考试化学试题广东省开平市忠源纪念中学2022届高三考前热身考试化学试题



