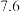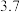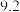解题方法
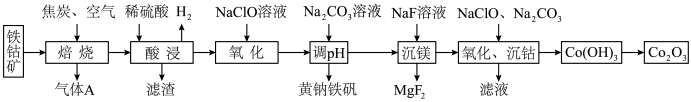
1 . 以主要成分为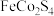 的铁钴矿(杂质为
的铁钴矿(杂质为 、
、 )为原料制取
)为原料制取 和黄钠铁矾
和黄钠铁矾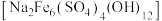 的工艺流程如下图所示(已知还原性:
的工艺流程如下图所示(已知还原性: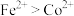 ):
): 、
、 元素完全转化为单质。
元素完全转化为单质。
回答下列问题:
(1)黄钠铁矾中铁元素的化合价为_______ 价,检验气体 中是否含有
中是否含有 的方法可以为
的方法可以为_______ 。
(2)第一次“氧化”中消耗的氧化剂与还原剂物质的量之比为_______ ,“调 ”时反应的离子方程式为
”时反应的离子方程式为_______ 。
(3)“氧化、沉钴”过程中加入的 和
和 物质的量之比为
物质的量之比为 ,相应总反应的离子方程式为
,相应总反应的离子方程式为_______ , 转化为
转化为 的基本方法是
的基本方法是_______ 。
(4)基态 的价层电子的轨道表示式为
的价层电子的轨道表示式为_______ ,铁可形成多种氧化物,其中一种铁的氧化物的晶胞结构及该晶胞中的Ⅰ、Ⅱ两种结构如下图所示: 的是
的是_______ (填“ ”或“
”或“ ”),若晶体密度为
”),若晶体密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
_______  (用含
(用含 、
、 的式子表示)。
的式子表示)。
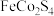 的铁钴矿(杂质为
的铁钴矿(杂质为 、
、 )为原料制取
)为原料制取 和黄钠铁矾
和黄钠铁矾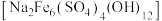 的工艺流程如下图所示(已知还原性:
的工艺流程如下图所示(已知还原性: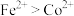 ):
):
 、
、 元素完全转化为单质。
元素完全转化为单质。回答下列问题:
(1)黄钠铁矾中铁元素的化合价为
 中是否含有
中是否含有 的方法可以为
的方法可以为(2)第一次“氧化”中消耗的氧化剂与还原剂物质的量之比为
 ”时反应的离子方程式为
”时反应的离子方程式为(3)“氧化、沉钴”过程中加入的
 和
和 物质的量之比为
物质的量之比为 ,相应总反应的离子方程式为
,相应总反应的离子方程式为 转化为
转化为 的基本方法是
的基本方法是(4)基态
 的价层电子的轨道表示式为
的价层电子的轨道表示式为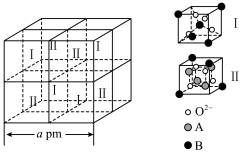
 的是
的是 ”或“
”或“ ”),若晶体密度为
”),若晶体密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
 (用含
(用含 、
、 的式子表示)。
的式子表示)。
您最近一年使用:0次
解题方法
2 . SnO2是锡的重要氧化物,现以锡锑渣(主要含塑料及SnO2、Sb4O6、PbO2)为原料,提纯SnO2的工艺流程图如下:
②Na2SnO3可溶于水,难溶于乙醇。
请回答下列问题:
(1)“焙烧”的主要目的是_______ 。
(2)“沉铅”时同时生成S沉淀的化学方程式_______ 。
(3)“还原”时Na3SbO4发生的离子方程式为_______ 。
(4)在不同溶剂中Na2SnO3的溶解度随温度变化如图。_______ 。
②由Na2SnO3溶液可获得Na2SnO3晶体,具体操作方法为_______ 、用_______ 洗涤、干燥。
(5)下列冶炼方法与本工艺流程中加入焦炭冶炼锡的方法相似的是_______。
(6)将10kg锡锑渣进行碱浸,“还原”时消耗0. 13kg锡粒,假设其余各步损失不计,干燥后称量锡酸钠质量为4. 0kg,滴定测得锡酸钠中锡的质量分数为53. 5%。锡锑渣中锡元素的质量分数为_______ 。

②Na2SnO3可溶于水,难溶于乙醇。
请回答下列问题:
(1)“焙烧”的主要目的是
(2)“沉铅”时同时生成S沉淀的化学方程式
(3)“还原”时Na3SbO4发生的离子方程式为
(4)在不同溶剂中Na2SnO3的溶解度随温度变化如图。
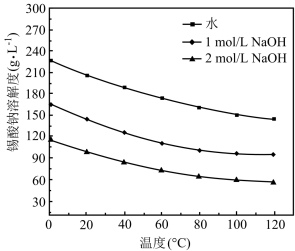
②由Na2SnO3溶液可获得Na2SnO3晶体,具体操作方法为
(5)下列冶炼方法与本工艺流程中加入焦炭冶炼锡的方法相似的是_______。
| A.工业制粗硅 | B.电解熔融氯化钠制钠 |
| C.氧化汞分解制汞 | D.工业炼铁 |
(6)将10kg锡锑渣进行碱浸,“还原”时消耗0. 13kg锡粒,假设其余各步损失不计,干燥后称量锡酸钠质量为4. 0kg,滴定测得锡酸钠中锡的质量分数为53. 5%。锡锑渣中锡元素的质量分数为
您最近一年使用:0次
解题方法
3 . 亚氯酸的 ,常温常压下二氧化氯
,常温常压下二氧化氯 是一种黄绿色气体,它具有漂白性,消毒能力较强,可替代传统的液氯作为饮用水消毒杀菌剂。实验室用以下方式制备
是一种黄绿色气体,它具有漂白性,消毒能力较强,可替代传统的液氯作为饮用水消毒杀菌剂。实验室用以下方式制备 :
:____________ 。
② 在水溶液中很快水解成
在水溶液中很快水解成 和另一种化合物,该化合物名称为:
和另一种化合物,该化合物名称为:______ 。上述流程中在 酸性溶液条件下加入
酸性溶液条件下加入 反应的离子方程式为:
反应的离子方程式为:____________ 。
(2)纯 易分解爆炸,故常与
易分解爆炸,故常与 的烧碱溶液反应生成
的烧碱溶液反应生成 保存,需要时再通过溶于酸溶液反应获得
保存,需要时再通过溶于酸溶液反应获得 ,该反应刚开始十分缓慢,稍后一段时间产生气体急剧加快。下列说法正确的是______。
,该反应刚开始十分缓慢,稍后一段时间产生气体急剧加快。下列说法正确的是______。
(3)设计实验验证溶液 中的金属阳离子与氯离子
中的金属阳离子与氯离子____________ 。
 ,常温常压下二氧化氯
,常温常压下二氧化氯 是一种黄绿色气体,它具有漂白性,消毒能力较强,可替代传统的液氯作为饮用水消毒杀菌剂。实验室用以下方式制备
是一种黄绿色气体,它具有漂白性,消毒能力较强,可替代传统的液氯作为饮用水消毒杀菌剂。实验室用以下方式制备 :
: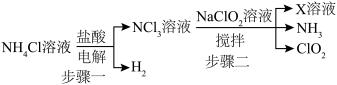
②
 在水溶液中很快水解成
在水溶液中很快水解成 和另一种化合物,该化合物名称为:
和另一种化合物,该化合物名称为: 酸性溶液条件下加入
酸性溶液条件下加入 反应的离子方程式为:
反应的离子方程式为:(2)纯
 易分解爆炸,故常与
易分解爆炸,故常与 的烧碱溶液反应生成
的烧碱溶液反应生成 保存,需要时再通过溶于酸溶液反应获得
保存,需要时再通过溶于酸溶液反应获得 ,该反应刚开始十分缓慢,稍后一段时间产生气体急剧加快。下列说法正确的是______。
,该反应刚开始十分缓慢,稍后一段时间产生气体急剧加快。下列说法正确的是______。| A.亚氯酸钠有强氧化性,在溶液中水解显酸性 |
B. 和 和 在碱性溶液中反应时, 在碱性溶液中反应时, 表现还原性 表现还原性 |
C.将 溶液进行加热浓缩,蒸发结晶,过滤洗涤,得到 溶液进行加热浓缩,蒸发结晶,过滤洗涤,得到 |
D.两份相同 溶液分别与等 溶液分别与等 的盐酸和硫酸反应,与盐酸反应可能快 的盐酸和硫酸反应,与盐酸反应可能快 |
(3)设计实验验证溶液
 中的金属阳离子与氯离子
中的金属阳离子与氯离子
您最近一年使用:0次
解题方法
4 . 某工厂用废旧钴基合金制备 (主要成分为
(主要成分为 ,还含有
,还含有 、
、 、
、 、
、 、
、 等),工艺流程如下:
等),工艺流程如下: 、
、 不能氧化
不能氧化 ,部分金属氢氧化物沉淀时
,部分金属氢氧化物沉淀时 如下表
如下表
②室温下, ,
,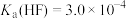
回答下列问题:
(1)“碱浸”时反应的离子方程式为____________ 。
(2)“酸浸”所得“浸渣”的成分为______ 。
(3)“除铁”时需要控制反应温度不能高于 的原因是
的原因是______ 。
(4)“沉镁”时反应的离子方程式为____________ 。若“沉镁”后的溶液中 ,则此时溶液的
,则此时溶液的 为
为______ 。
(5)“氧化”时反应的离子方程式为____________ 。
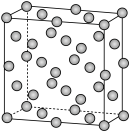
(6)某钴单质催化剂( )的晶胞如图所示,其中8个
)的晶胞如图所示,其中8个 原子位于顶点,8个
原子位于顶点,8个 原子位于棱上,4个
原子位于棱上,4个 原子位于晶胞内部,其余位于面上。已知晶胞底边长分别为
原子位于晶胞内部,其余位于面上。已知晶胞底边长分别为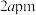 和
和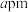 ,设
,设 为阿伏加德罗常数的值,则该晶体密度为
为阿伏加德罗常数的值,则该晶体密度为______  。
。
 (主要成分为
(主要成分为 ,还含有
,还含有 、
、 、
、 、
、 、
、 等),工艺流程如下:
等),工艺流程如下: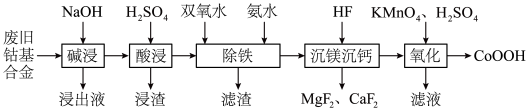
 、
、 不能氧化
不能氧化 ,部分金属氢氧化物沉淀时
,部分金属氢氧化物沉淀时 如下表
如下表沉淀物 |
|
|
|
|
开始沉淀 |
|
|
|
|
完全沉淀 |
|
|
|
|
 ,
,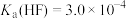
回答下列问题:
(1)“碱浸”时反应的离子方程式为
(2)“酸浸”所得“浸渣”的成分为
(3)“除铁”时需要控制反应温度不能高于
 的原因是
的原因是(4)“沉镁”时反应的离子方程式为
 ,则此时溶液的
,则此时溶液的 为
为(5)“氧化”时反应的离子方程式为
(6)某钴单质催化剂(
 )的晶胞如图所示,其中8个
)的晶胞如图所示,其中8个 原子位于顶点,8个
原子位于顶点,8个 原子位于棱上,4个
原子位于棱上,4个 原子位于晶胞内部,其余位于面上。已知晶胞底边长分别为
原子位于晶胞内部,其余位于面上。已知晶胞底边长分别为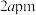 和
和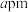 ,设
,设 为阿伏加德罗常数的值,则该晶体密度为
为阿伏加德罗常数的值,则该晶体密度为 。
。
您最近一年使用:0次
解题方法
5 . 过氧化钙 是一种白色或淡黄色的结晶状粉末,不溶于乙醇,易溶于酸,遇湿空气或水会长时间持续放出氧气,常在鱼类养殖、作物栽培、污水处理时作供氧剂。某实验学习小组按以下流程制备过氧化钙:
是一种白色或淡黄色的结晶状粉末,不溶于乙醇,易溶于酸,遇湿空气或水会长时间持续放出氧气,常在鱼类养殖、作物栽培、污水处理时作供氧剂。某实验学习小组按以下流程制备过氧化钙:______ 气体,需要除去该气体的原因是______ 。
(2)下列说法正确的是_________。
(3)步骤②中生成 的反应为
的反应为____________ 。
(4)用下图的装置对产品 质量分数进行测定(夹持装置省略)
质量分数进行测定(夹持装置省略)_________________ (保留三位有效数字),则此实验也可以通过测量____________________ 来计算产品的质量分数。
 是一种白色或淡黄色的结晶状粉末,不溶于乙醇,易溶于酸,遇湿空气或水会长时间持续放出氧气,常在鱼类养殖、作物栽培、污水处理时作供氧剂。某实验学习小组按以下流程制备过氧化钙:
是一种白色或淡黄色的结晶状粉末,不溶于乙醇,易溶于酸,遇湿空气或水会长时间持续放出氧气,常在鱼类养殖、作物栽培、污水处理时作供氧剂。某实验学习小组按以下流程制备过氧化钙: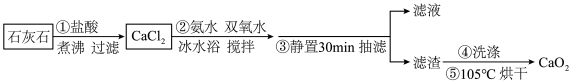
(2)下列说法正确的是_________。
| A.步骤①反应时盐酸过量,可保证较大的钙离子浓度 |
| B.步骤③静置的时间越长,则得到产品颗粒就越细小 |
| C.步骤③抽滤时,可用耐酸的玻璃砂芯漏斗进行过滤 |
| D.步骤⑤操作将滤渣用滤纸包裹后置于坩埚中再烘干 |
(3)步骤②中生成
 的反应为
的反应为(4)用下图的装置对产品
 质量分数进行测定(夹持装置省略)
质量分数进行测定(夹持装置省略)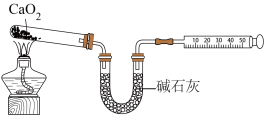
您最近一年使用:0次
6 . 某电镀厂的酸性废液中含 、
、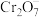 、
、 、
、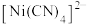 等离子,须处理后排放。
等离子,须处理后排放。
(1)除 、
、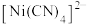 。向废液中加入熟石灰调节
。向废液中加入熟石灰调节 ,再加入
,再加入 溶液,可将
溶液,可将 氧化为
氧化为 和
和 ,其离子方程式为
,其离子方程式为___________ 。加入 可以促进
可以促进 元素转化为
元素转化为 沉淀除去,原因是
沉淀除去,原因是___________ 。
(2)沉淀法回收 (Ⅵ)。已知:
(Ⅵ)。已知: 和
和 微溶于水,
微溶于水,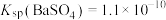 ,
,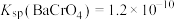 。
。
①向除去 和
和 元素的废液中加入一定量的
元素的废液中加入一定量的 ,可将
,可将 (Ⅵ)转化为
(Ⅵ)转化为 沉淀。相同时间内,
沉淀。相同时间内, 元素沉淀率与溶液初始
元素沉淀率与溶液初始 的关系如图所示。与
的关系如图所示。与 相比,初始
相比,初始 时
时 (Ⅵ)去除率较高的原因是
(Ⅵ)去除率较高的原因是___________ 。 沉淀中混有
沉淀中混有 等杂质,可加入足量硫酸充分反应后过滤,实现
等杂质,可加入足量硫酸充分反应后过滤,实现 (Ⅵ)的分离回收,反应的离子方程式为
(Ⅵ)的分离回收,反应的离子方程式为___________ 。
(3)电解法除 (VI)的一种装置如图所示。利用阳极生成的
(VI)的一种装置如图所示。利用阳极生成的 ,还原
,还原 (VI)生成
(VI)生成 ,最终转化为
,最终转化为 和
和 沉淀除去。
沉淀除去。 的钝化膜,电解效率降低。将电源正负极反接一段时间,钝化膜消失。钝化膜消失的原因为
的钝化膜,电解效率降低。将电源正负极反接一段时间,钝化膜消失。钝化膜消失的原因为___________ 。
②电解时,若维持电流强度为5A,电流效率为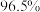 ,除去废水中
,除去废水中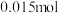 的
的 ,至少需要电解
,至少需要电解___________ 小时(写出计算过程)。
(已知:电流效率( )
)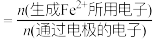 ;
; 。)
。)
 、
、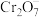 、
、 、
、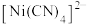 等离子,须处理后排放。
等离子,须处理后排放。(1)除
 、
、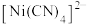 。向废液中加入熟石灰调节
。向废液中加入熟石灰调节 ,再加入
,再加入 溶液,可将
溶液,可将 氧化为
氧化为 和
和 ,其离子方程式为
,其离子方程式为 可以促进
可以促进 元素转化为
元素转化为 沉淀除去,原因是
沉淀除去,原因是(2)沉淀法回收
 (Ⅵ)。已知:
(Ⅵ)。已知: 和
和 微溶于水,
微溶于水,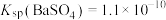 ,
,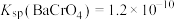 。
。①向除去
 和
和 元素的废液中加入一定量的
元素的废液中加入一定量的 ,可将
,可将 (Ⅵ)转化为
(Ⅵ)转化为 沉淀。相同时间内,
沉淀。相同时间内, 元素沉淀率与溶液初始
元素沉淀率与溶液初始 的关系如图所示。与
的关系如图所示。与 相比,初始
相比,初始 时
时 (Ⅵ)去除率较高的原因是
(Ⅵ)去除率较高的原因是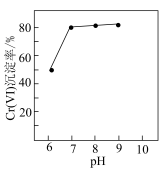
 沉淀中混有
沉淀中混有 等杂质,可加入足量硫酸充分反应后过滤,实现
等杂质,可加入足量硫酸充分反应后过滤,实现 (Ⅵ)的分离回收,反应的离子方程式为
(Ⅵ)的分离回收,反应的离子方程式为(3)电解法除
 (VI)的一种装置如图所示。利用阳极生成的
(VI)的一种装置如图所示。利用阳极生成的 ,还原
,还原 (VI)生成
(VI)生成 ,最终转化为
,最终转化为 和
和 沉淀除去。
沉淀除去。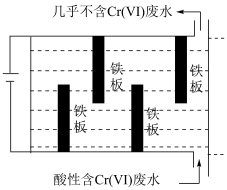
 的钝化膜,电解效率降低。将电源正负极反接一段时间,钝化膜消失。钝化膜消失的原因为
的钝化膜,电解效率降低。将电源正负极反接一段时间,钝化膜消失。钝化膜消失的原因为②电解时,若维持电流强度为5A,电流效率为
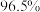 ,除去废水中
,除去废水中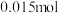 的
的 ,至少需要电解
,至少需要电解(已知:电流效率(
 )
)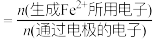 ;
; 。)
。)
您最近一年使用:0次
名校
解题方法
7 . 固态化合物M的组成为CuSi2O5,以M为原料实现如下转化:
(1)①固体D的成分为_______ ,溶液E中含氮微粒有_______ 。
②写出反应Ⅱ的化学反应方程式_______ 。
③溶液F加热可得纳米 ,过程中pH会明显下降,原因是
,过程中pH会明显下降,原因是_______ 。
(2)下列说法正确的是_______。
(3)已知 能溶于较浓强碱溶液,蓝色溶液C中可能存在铝元素,请设计实验方案进行检验
能溶于较浓强碱溶液,蓝色溶液C中可能存在铝元素,请设计实验方案进行检验_______ 。
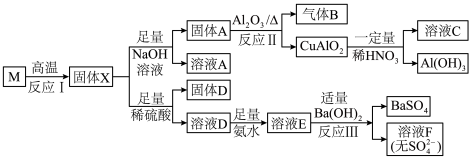
(1)①固体D的成分为
②写出反应Ⅱ的化学反应方程式
③溶液F加热可得纳米
 ,过程中pH会明显下降,原因是
,过程中pH会明显下降,原因是(2)下列说法正确的是_______。
| A.反应Ⅰ不能在陶瓷坩埚中进行 |
| B.固体X可溶于浓氨水 |
| C.溶液A经净化处理后可用于工业粘合剂 |
D.反应Ⅲ中发生的离子反应有: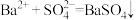 |
(3)已知
 能溶于较浓强碱溶液,蓝色溶液C中可能存在铝元素,请设计实验方案进行检验
能溶于较浓强碱溶液,蓝色溶液C中可能存在铝元素,请设计实验方案进行检验
您最近一年使用:0次
8 . 对氯甲苯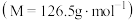 常作为染料、医药、有机合成的中间体,也可用作溶剂。其制取原理是:先用芳胺在一定条件下制成芳香重氮盐,然后在CuCl催化下,芳香重氮盐中的重氮基被氯原子取代生成芳香族氯化物。其原理如下:
常作为染料、医药、有机合成的中间体,也可用作溶剂。其制取原理是:先用芳胺在一定条件下制成芳香重氮盐,然后在CuCl催化下,芳香重氮盐中的重氮基被氯原子取代生成芳香族氯化物。其原理如下:
I.CuCl沉淀的制备
(1)将 、NaCl、
、NaCl、 、NaOH在水溶液中加热一段时间后,即可得到CuCl沉淀。
、NaOH在水溶液中加热一段时间后,即可得到CuCl沉淀。 俗称
俗称________ ,请写出该反应的离子方程式________ 。
Ⅱ.重氮盐溶液的制备 溶液过量可能带来的弊端是
溶液过量可能带来的弊端是________ ;可用尿素 将其除去,生成的气体无污染,请写出该反应的离子方程式
将其除去,生成的气体无污染,请写出该反应的离子方程式________ 。
Ⅲ.对氯甲苯的制备________ ;________ (填序号)。
①熄灭酒精灯 ②打开旋塞 ③停止通冷凝水
(4)CuCl催化机理分两步进行,请补充完整:________ 。
(5)对氯甲苯粗品经过精制后,得到1.50g产品,本实验的产率最接近于________(填标号)。
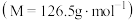 常作为染料、医药、有机合成的中间体,也可用作溶剂。其制取原理是:先用芳胺在一定条件下制成芳香重氮盐,然后在CuCl催化下,芳香重氮盐中的重氮基被氯原子取代生成芳香族氯化物。其原理如下:
常作为染料、医药、有机合成的中间体,也可用作溶剂。其制取原理是:先用芳胺在一定条件下制成芳香重氮盐,然后在CuCl催化下,芳香重氮盐中的重氮基被氯原子取代生成芳香族氯化物。其原理如下: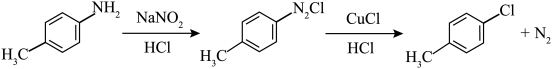
I.CuCl沉淀的制备
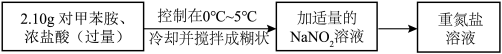
(1)将
 、NaCl、
、NaCl、 、NaOH在水溶液中加热一段时间后,即可得到CuCl沉淀。
、NaOH在水溶液中加热一段时间后,即可得到CuCl沉淀。 俗称
俗称Ⅱ.重氮盐溶液的制备
 溶液过量可能带来的弊端是
溶液过量可能带来的弊端是 将其除去,生成的气体无污染,请写出该反应的离子方程式
将其除去,生成的气体无污染,请写出该反应的离子方程式Ⅲ.对氯甲苯的制备
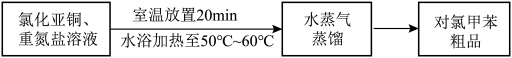
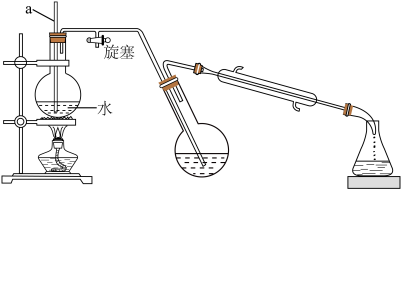
①熄灭酒精灯 ②打开旋塞 ③停止通冷凝水
(4)CuCl催化机理分两步进行,请补充完整:
①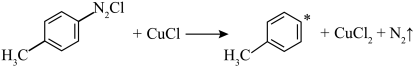
(5)对氯甲苯粗品经过精制后,得到1.50g产品,本实验的产率最接近于________(填标号)。
| A.55% | B.60% | C.65% | D.70% |
您最近一年使用:0次
解题方法
9 . 铬是最坚硬的金属,金刚石是自然界中最硬的物质。一种由铬铁矿(含 、MgO、
、MgO、 ,
, 等)为原料制备铬单质的流程如图所示。
等)为原料制备铬单质的流程如图所示。 ,
, 等。
等。
②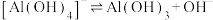
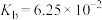 。
。
③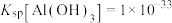
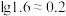 。
。
回答以下问题:
(1)焙烧时将矿料和NaOH进行研磨,目的是__________________ 。
(2)焙烧时生成 的化学方程式是
的化学方程式是__________________ 。
(3)已知0.1 mol/L 溶液中,铝形态的浓度(以
溶液中,铝形态的浓度(以 或
或 计)的对数(
计)的对数(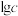 )随溶液pH变化的关系如图。
)随溶液pH变化的关系如图。______ 。(已知: 恰好在a~b的pH范围内完全沉淀)
恰好在a~b的pH范围内完全沉淀)
(4)工业上冶炼Cr的方法是______ 。基态Cr原子的价层电子排布图为____________ 。从原子结构及性质的角度分析金属Cr硬度很大的原因:________________________ 。
(5)晶体硅具有与金刚石相似的晶体结构(如图),已知Si原子半径为r pm,阿伏加德罗常数的值为 ,则晶体硅的密度为
,则晶体硅的密度为______ g/cm (列出计算表达式)。
(列出计算表达式)。____________ 。
 、MgO、
、MgO、 ,
, 等)为原料制备铬单质的流程如图所示。
等)为原料制备铬单质的流程如图所示。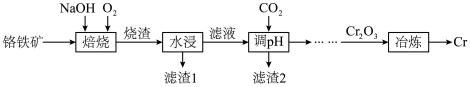
 ,
, 等。
等。②
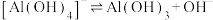
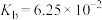 。
。③
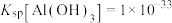
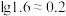 。
。回答以下问题:
(1)焙烧时将矿料和NaOH进行研磨,目的是
(2)焙烧时生成
 的化学方程式是
的化学方程式是(3)已知0.1 mol/L
 溶液中,铝形态的浓度(以
溶液中,铝形态的浓度(以 或
或 计)的对数(
计)的对数(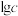 )随溶液pH变化的关系如图。
)随溶液pH变化的关系如图。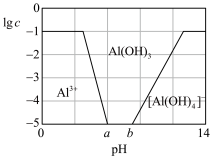
 恰好在a~b的pH范围内完全沉淀)
恰好在a~b的pH范围内完全沉淀)(4)工业上冶炼Cr的方法是
(5)晶体硅具有与金刚石相似的晶体结构(如图),已知Si原子半径为r pm,阿伏加德罗常数的值为
 ,则晶体硅的密度为
,则晶体硅的密度为 (列出计算表达式)。
(列出计算表达式)。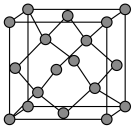
您最近一年使用:0次
2024-06-07更新
|
48次组卷
|
2卷引用:2024届新高考教学教研联盟高三下学期第一次联考化学试卷
解题方法
10 . 现有一种以 为载体的废旧催化剂,表面积碳且被有机物覆盖,含少量金属银。某实验室设计以下流程拟对废旧催化剂中的
为载体的废旧催化剂,表面积碳且被有机物覆盖,含少量金属银。某实验室设计以下流程拟对废旧催化剂中的 和Pt进行回收。
和Pt进行回收。 不溶于硝酸。请回答下列问题:
不溶于硝酸。请回答下列问题:
(1)步骤I中将废催化剂焙烧的目的是___________ 。
(2)操作Ⅳ的名称是___________ ;检验废渣洗净的方法是___________ 。
(3)步骤Ⅲ中氧化剂是 ,反应后Pt转化成
,反应后Pt转化成 ,每生成1mol
,每生成1mol ,需要消耗H+的量为
,需要消耗H+的量为___________ mol。该步骤中有氯气生成,其离子方程式为___________ 。
(4)步骤V中,在适当酸度下,树脂上发生: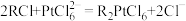 ,
, 吸附在树脂上得以富集,饱和后的树脂用碱液淋洗后得到含铂溶液,而要使树脂再生能重复使用,最好使用
吸附在树脂上得以富集,饱和后的树脂用碱液淋洗后得到含铂溶液,而要使树脂再生能重复使用,最好使用___________ (填化学式)淋洗。
(5)步骤Ⅵ中生成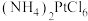 沉淀,将该沉淀在
沉淀,将该沉淀在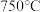 下煅烧生成铂和三种气体,其中一种气体是空气中的主要成份之一。请写出该反应的化学反应方程式
下煅烧生成铂和三种气体,其中一种气体是空气中的主要成份之一。请写出该反应的化学反应方程式___________ 。
 为载体的废旧催化剂,表面积碳且被有机物覆盖,含少量金属银。某实验室设计以下流程拟对废旧催化剂中的
为载体的废旧催化剂,表面积碳且被有机物覆盖,含少量金属银。某实验室设计以下流程拟对废旧催化剂中的 和Pt进行回收。
和Pt进行回收。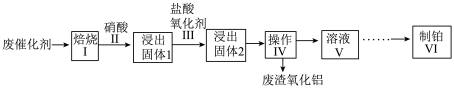
 不溶于硝酸。请回答下列问题:
不溶于硝酸。请回答下列问题:(1)步骤I中将废催化剂焙烧的目的是
(2)操作Ⅳ的名称是
(3)步骤Ⅲ中氧化剂是
 ,反应后Pt转化成
,反应后Pt转化成 ,每生成1mol
,每生成1mol ,需要消耗H+的量为
,需要消耗H+的量为(4)步骤V中,在适当酸度下,树脂上发生:
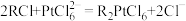 ,
, 吸附在树脂上得以富集,饱和后的树脂用碱液淋洗后得到含铂溶液,而要使树脂再生能重复使用,最好使用
吸附在树脂上得以富集,饱和后的树脂用碱液淋洗后得到含铂溶液,而要使树脂再生能重复使用,最好使用(5)步骤Ⅵ中生成
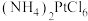 沉淀,将该沉淀在
沉淀,将该沉淀在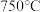 下煅烧生成铂和三种气体,其中一种气体是空气中的主要成份之一。请写出该反应的化学反应方程式
下煅烧生成铂和三种气体,其中一种气体是空气中的主要成份之一。请写出该反应的化学反应方程式
您最近一年使用:0次