解题方法
1 . 以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的工艺流程如下:
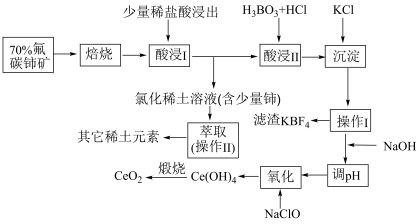
已知:①铈的常见化合价为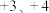 。四价铈不易进入溶液,而三价铈易进入溶液;
。四价铈不易进入溶液,而三价铈易进入溶液;
②酸浸Ⅱ中发生反应: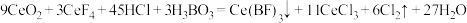
(1)焙烧后铈元素转化成 和
和 ,焙烧氟碳铈矿的目的是
,焙烧氟碳铈矿的目的是___________ 。
(2)在“酸浸I”中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。少量铈由 进入稀土溶液时发生反应的离子方程式为
进入稀土溶液时发生反应的离子方程式为___________ 。
(3)“酸浸Ⅱ”使用到硼酸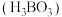 ,已知硼酸与足量
,已知硼酸与足量 反应的产物是
反应的产物是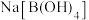 ,则硼酸在水溶液中的电离方程式为
,则硼酸在水溶液中的电离方程式为___________ 。
(4)向 中加入
中加入 溶液的目的是
溶液的目的是___________ 。
(5) 时,向
时,向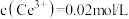 的溶液中加入氢氧化钠来调节溶液的
的溶液中加入氢氧化钠来调节溶液的 ,若反应后溶液
,若反应后溶液 ,此时
,此时 是否沉淀完全?
是否沉淀完全?___________ (答“是”或“否”),判断的理由是___________ 。
(要求列式计算,已知: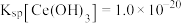 ,
,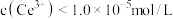 视为沉淀完全)。
视为沉淀完全)。
(6) 晶体属立方
晶体属立方 型晶体,结构如图所示。
型晶体,结构如图所示。
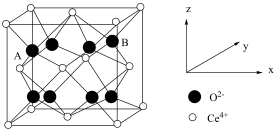
①已知晶胞参数为 ,阿佛加德罗常数的值为
,阿佛加德罗常数的值为 ,
, 相对分子质量为
相对分子质量为 ,该晶体密度为
,该晶体密度为___________  (列出化简的计算式)。
(列出化简的计算式)。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中的原子位置,称为原子分数坐标。如A离子的坐标为 ,则B离子的坐标为
,则B离子的坐标为___________ 。

已知:①铈的常见化合价为
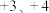 。四价铈不易进入溶液,而三价铈易进入溶液;
。四价铈不易进入溶液,而三价铈易进入溶液;②酸浸Ⅱ中发生反应:
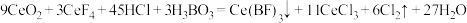
(1)焙烧后铈元素转化成
 和
和 ,焙烧氟碳铈矿的目的是
,焙烧氟碳铈矿的目的是(2)在“酸浸I”中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。少量铈由
 进入稀土溶液时发生反应的离子方程式为
进入稀土溶液时发生反应的离子方程式为(3)“酸浸Ⅱ”使用到硼酸
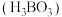 ,已知硼酸与足量
,已知硼酸与足量 反应的产物是
反应的产物是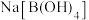 ,则硼酸在水溶液中的电离方程式为
,则硼酸在水溶液中的电离方程式为(4)向
 中加入
中加入 溶液的目的是
溶液的目的是(5)
 时,向
时,向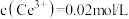 的溶液中加入氢氧化钠来调节溶液的
的溶液中加入氢氧化钠来调节溶液的 ,若反应后溶液
,若反应后溶液 ,此时
,此时 是否沉淀完全?
是否沉淀完全?(要求列式计算,已知:
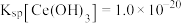 ,
,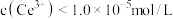 视为沉淀完全)。
视为沉淀完全)。(6)
 晶体属立方
晶体属立方 型晶体,结构如图所示。
型晶体,结构如图所示。
①已知晶胞参数为
 ,阿佛加德罗常数的值为
,阿佛加德罗常数的值为 ,
, 相对分子质量为
相对分子质量为 ,该晶体密度为
,该晶体密度为 (列出化简的计算式)。
(列出化简的计算式)。②以晶胞参数为单位长度建立的坐标系可以表示晶胞中的原子位置,称为原子分数坐标。如A离子的坐标为
 ,则B离子的坐标为
,则B离子的坐标为
您最近一年使用:0次
名校
解题方法
2 . 含氯消毒剂可有效灭活新冠病毒,为阻断疫情做出了巨大贡献。
(1)人类最初用新制氯水漂白、杀菌、消毒。氯水使用起来不方便,效果也不理想的原因是_______ 。
(2)常用的含氯漂白剂中二氧化氯( )被联合国世界卫生组织(WHO)列为AⅠ级安全消毒剂,是一种易溶于水、难溶于有机溶剂的气体,易与碱液反应生成盐和水。其性质非常不稳定,温度过高或水溶液中
)被联合国世界卫生组织(WHO)列为AⅠ级安全消毒剂,是一种易溶于水、难溶于有机溶剂的气体,易与碱液反应生成盐和水。其性质非常不稳定,温度过高或水溶液中 的质量分数高于30%等均有可能引起爆炸,若用空气、二氧化碳、氮气等惰性气体稀释时,爆炸性则降低。实验室可用干燥的氯气与固体亚氯酸钠制备二氧化氯,装置如下图所示。
的质量分数高于30%等均有可能引起爆炸,若用空气、二氧化碳、氮气等惰性气体稀释时,爆炸性则降低。实验室可用干燥的氯气与固体亚氯酸钠制备二氧化氯,装置如下图所示。
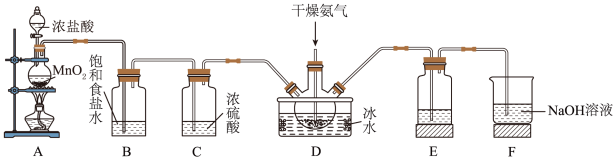
①装置A中用来存放、添加浓盐酸的仪器名称是_______ ;写出A中发生反应的化学方程式并用单线桥法标出电子转移的方向和数目:_______ 。
②装置C的作用为_______ 。
③装置D中从实验开始到结束都要持续通入干燥氮气,其可能的原因是_______ ;写出D中发生反应的化学方程式:_______ 。
④装置E将产生的二氧化氯气体进行溶解、吸收、保存,吸收液最好使用_______ (填字母序号)。
a.80℃的温水 b.冰水 c.四氯化碳 d.NaOH溶液
(1)人类最初用新制氯水漂白、杀菌、消毒。氯水使用起来不方便,效果也不理想的原因是
(2)常用的含氯漂白剂中二氧化氯(
 )被联合国世界卫生组织(WHO)列为AⅠ级安全消毒剂,是一种易溶于水、难溶于有机溶剂的气体,易与碱液反应生成盐和水。其性质非常不稳定,温度过高或水溶液中
)被联合国世界卫生组织(WHO)列为AⅠ级安全消毒剂,是一种易溶于水、难溶于有机溶剂的气体,易与碱液反应生成盐和水。其性质非常不稳定,温度过高或水溶液中 的质量分数高于30%等均有可能引起爆炸,若用空气、二氧化碳、氮气等惰性气体稀释时,爆炸性则降低。实验室可用干燥的氯气与固体亚氯酸钠制备二氧化氯,装置如下图所示。
的质量分数高于30%等均有可能引起爆炸,若用空气、二氧化碳、氮气等惰性气体稀释时,爆炸性则降低。实验室可用干燥的氯气与固体亚氯酸钠制备二氧化氯,装置如下图所示。
①装置A中用来存放、添加浓盐酸的仪器名称是
②装置C的作用为
③装置D中从实验开始到结束都要持续通入干燥氮气,其可能的原因是
④装置E将产生的二氧化氯气体进行溶解、吸收、保存,吸收液最好使用
a.80℃的温水 b.冰水 c.四氯化碳 d.NaOH溶液
您最近一年使用:0次
解题方法
3 . 硝酸生产的尾气中NO和 等氮氧化物以及酸性废水中
等氮氧化物以及酸性废水中 均须处理达标后再排放。
均须处理达标后再排放。
Ⅰ.硝酸生产的尾气中NO和 的处理。
的处理。
(1)硝酸尾气可用NaOH溶液吸收,主要反应为
 ;
;
①吸收后的溶液经浓缩、结晶、过滤,得到 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是___________ (填化学式);
②吸收后排放的尾气中含量较高的氮氧化物是___________ (填化学式)。
(2)用NaClO溶液也能除去尾气中NO。其他条件相同,NO去除为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
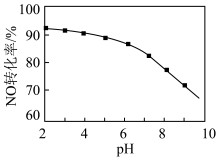
NaClO溶液的初始pH越大,NO转化率越低。其原因是___________ 。
(3)利用 也能够还原氮氧化物(
也能够还原氮氧化物( )实现氮污染的治理。将硝酸尾气与
)实现氮污染的治理。将硝酸尾气与 的混合气体通入
的混合气体通入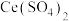 与
与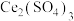 的混合溶液中实现无害化处理,其转化过程如图所示。
的混合溶液中实现无害化处理,其转化过程如图所示。
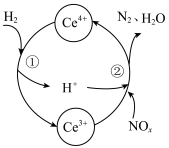
①x=1时, 参与的离子方程式为
参与的离子方程式为___________ 。
②若该过程中,每转移3.6mol电子消耗1mol氮氧化物( ),则x为
),则x为___________ 。
Ⅱ.酸性废水中 的处理
的处理
(4)在45℃、惰性气体氛围中金属或合金可以将溶液废水中的 还原为
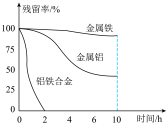
还原为 ,从而实现脱氨。量取三份50mL含
,从而实现脱氨。量取三份50mL含 的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中
的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中 的残留率(残留率=
的残留率(残留率=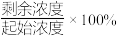 )与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是___________ 。
(5)还可以利用原电池原理处理酸性废水中 ,废水中的
,废水中的 在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
在水处理剂表面的变化如图所示,该电池正极上的电极反应式为___________ 。

 等氮氧化物以及酸性废水中
等氮氧化物以及酸性废水中 均须处理达标后再排放。
均须处理达标后再排放。Ⅰ.硝酸生产的尾气中NO和
 的处理。
的处理。(1)硝酸尾气可用NaOH溶液吸收,主要反应为
 ;
;
①吸收后的溶液经浓缩、结晶、过滤,得到
 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是②吸收后排放的尾气中含量较高的氮氧化物是
(2)用NaClO溶液也能除去尾气中NO。其他条件相同,NO去除为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
NaClO溶液的初始pH越大,NO转化率越低。其原因是
(3)利用
 也能够还原氮氧化物(
也能够还原氮氧化物( )实现氮污染的治理。将硝酸尾气与
)实现氮污染的治理。将硝酸尾气与 的混合气体通入
的混合气体通入 与
与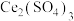 的混合溶液中实现无害化处理,其转化过程如图所示。
的混合溶液中实现无害化处理,其转化过程如图所示。
①x=1时,
 参与的离子方程式为
参与的离子方程式为②若该过程中,每转移3.6mol电子消耗1mol氮氧化物(
 ),则x为
),则x为Ⅱ.酸性废水中
 的处理
的处理(4)在45℃、惰性气体氛围中金属或合金可以将溶液废水中的
 还原为
还原为 ,从而实现脱氨。量取三份50mL含
,从而实现脱氨。量取三份50mL含 的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中
的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中 的残留率(残留率=
的残留率(残留率=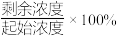 )与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
(5)还可以利用原电池原理处理酸性废水中
 ,废水中的
,废水中的 在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
您最近一年使用:0次
名校
解题方法
4 . 过氧化氢(H2O2)是常用的绿色氧化剂。某化学兴趣小组查阅了H2O2的相关信息,并针对它的某些性质进行了探究,具体如下:H2O2可以通过H2和O2在某催化剂表面直接反应合成,具体原理如下图所示:

(1)采用同位素示踪法研究催化剂中H+的作用:将H2用D2(2H2)代替再进行实验。催化剂中氢离子参与反应的证据是生成的产物中有H2O2或_______ 粒子(填化学式)。
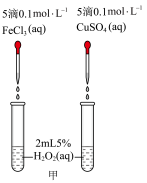
II.H2O2不稳定,在Fe3+、Cu2+等粒子的催化下会很快分解并放出热量。为了比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如下实验。
(2)定性分析:通过观察甲装置两支试管中_______ 的现象,得出关于FeCl3和CuSO4催化效果的结论。某同学认为此方案还需要进一步控制变量,提出可将试剂CuSO4更换为_______ (填化学式)。
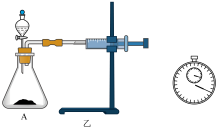
(3)定量测定:用乙装置进行定量实验。实验时组装好装置乙,关闭分液漏斗的活塞,将注射器活塞向外拉出一段距离后松开,观察活塞是否回到原来的位置。该操作的实验目的是_______ 。若反应30s后注射器中收集到气体的体积为VmL(标准状况),则锥形瓶A中实际产生气体的体积_______ VmL(填“>”、“<”或“=”)。
III.H2O2既有氧化性,又有还原性。
(4)H2O2可以氧化废水中的CN—,Cu2+可催化该反应。已知H2O2与CN—反应会生成参与大气循环的无毒气体。氰化氢(HCN)是一种易挥发的弱酸,有剧毒,对环境危害很大。
①H2O2与CN-的反应不能在酸性溶液中进行,原因是_______ ,反应生成气体的化学式为_______ 。
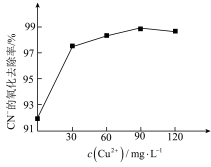
②一定条件下,测得CN-的氧化去除率随溶液中c(Cu2+)的变化如下图所示。c(Cu2+)过多时,CN-的氧化去除率有所下降,原因是_______ 。
(5)取少量84消毒液(有效成分为NaClO)于试管中,滴加H2O2溶液,产生大量无色气体。写出发生反应的化学方程式_______ 。

(1)采用同位素示踪法研究催化剂中H+的作用:将H2用D2(2H2)代替再进行实验。催化剂中氢离子参与反应的证据是生成的产物中有H2O2或
II.H2O2不稳定,在Fe3+、Cu2+等粒子的催化下会很快分解并放出热量。为了比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如下实验。
(2)定性分析:通过观察甲装置两支试管中

(3)定量测定:用乙装置进行定量实验。实验时组装好装置乙,关闭分液漏斗的活塞,将注射器活塞向外拉出一段距离后松开,观察活塞是否回到原来的位置。该操作的实验目的是

III.H2O2既有氧化性,又有还原性。
(4)H2O2可以氧化废水中的CN—,Cu2+可催化该反应。已知H2O2与CN—反应会生成参与大气循环的无毒气体。氰化氢(HCN)是一种易挥发的弱酸,有剧毒,对环境危害很大。
①H2O2与CN-的反应不能在酸性溶液中进行,原因是
②一定条件下,测得CN-的氧化去除率随溶液中c(Cu2+)的变化如下图所示。c(Cu2+)过多时,CN-的氧化去除率有所下降,原因是

(5)取少量84消毒液(有效成分为NaClO)于试管中,滴加H2O2溶液,产生大量无色气体。写出发生反应的化学方程式
您最近一年使用:0次
名校
解题方法
5 . 为了实现碳达峰、碳中和目标,建立清洁低碳的能源体系,如何处置和利用废旧电池,已成为当前行业亟需解决的问题。一种废旧磷酸铁锂电池正极材料(主要成分为LiFePO4,另含有少量Al)回收利用的工艺流程如图所示。
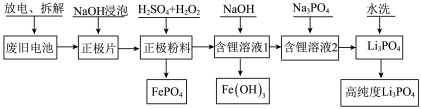
回答下列问题:
(1)拆解废旧磷酸铁锂电池会产生粉尘、废气等,采用_____ (填“封闭式全自动化拆解设备”或“开放式人工手动”)拆解,能避免环境污染并提高拆解效率.拆解后的正极片用NaOH溶液浸泡,目的是_____ 。
(2)正极粉料中加入硫酸酸化的双氧水,其中双氧水的作用是_____ 。生成FePO4的化学方程式为_____ 。
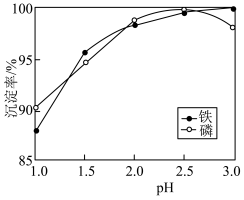
(3)溶液的pH对铁和磷的沉淀率的影响如图所示。沉淀铁和磷时,应选择溶液的pH为2.5。当pH>2.5时,铁、磷沉淀率发生不同变化的原因是_____ 。
(4)已知:Ksp(FePO4)=1.0×10-15,Ksp[Fe(OH)3]=2.8×10-39。向“含锂溶液1”[其中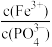 =1]中加入NaOH固体,进行深度除铁。深度除铁后溶液的pH=4.5,则此时溶液中
=1]中加入NaOH固体,进行深度除铁。深度除铁后溶液的pH=4.5,则此时溶液中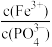 =
=_____ 。
(5)向“含锂溶液2”中加入Na3PO4溶液,得到Li3PO4沉淀。所加的Na3PO4溶液可通过向流程中的_____ (填化学式)中加入NaOH溶液制得。
(6)检验水洗Li3PO4已洗涤干净的操作方法是_____ 。

回答下列问题:
(1)拆解废旧磷酸铁锂电池会产生粉尘、废气等,采用
(2)正极粉料中加入硫酸酸化的双氧水,其中双氧水的作用是
(3)溶液的pH对铁和磷的沉淀率的影响如图所示。沉淀铁和磷时,应选择溶液的pH为2.5。当pH>2.5时,铁、磷沉淀率发生不同变化的原因是

(4)已知:Ksp(FePO4)=1.0×10-15,Ksp[Fe(OH)3]=2.8×10-39。向“含锂溶液1”[其中
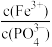 =1]中加入NaOH固体,进行深度除铁。深度除铁后溶液的pH=4.5,则此时溶液中
=1]中加入NaOH固体,进行深度除铁。深度除铁后溶液的pH=4.5,则此时溶液中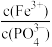 =
=(5)向“含锂溶液2”中加入Na3PO4溶液,得到Li3PO4沉淀。所加的Na3PO4溶液可通过向流程中的
(6)检验水洗Li3PO4已洗涤干净的操作方法是
您最近一年使用:0次
2023-05-15更新
|
579次组卷
|
2卷引用:河北省部分示范性高中2023届高三三模化学试题
6 . 锂离子电池正极材料有钴酸锂(LiCoO2)、铝箔和不溶性杂质。现欲利用以下工艺流程回收正极材料中的某些金属资源。
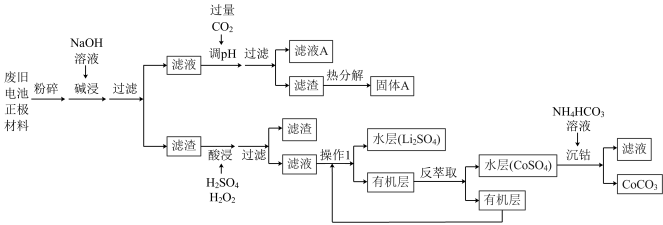
(1)“粉碎”的目的是_____ 。操作1的名称为_____ 。
(2)“碱浸”发生反应的离子方程式为_____ 。
(3)“酸浸”发生反应的化学方程式为_____ 。
(4)“沉钴”反应的离子方程式为_____ 。
(5)滤液A中能回收利用的主要物质是_____ 。若某锂离子电池正极材料中铝箔的质量分数为5.4%,则100kg该正极材料理论上最多能获得固体A_____ kg。

(1)“粉碎”的目的是
(2)“碱浸”发生反应的离子方程式为
(3)“酸浸”发生反应的化学方程式为
(4)“沉钴”反应的离子方程式为
(5)滤液A中能回收利用的主要物质是
您最近一年使用:0次
名校
解题方法
7 . 某小组同学设计如表所示实验探究 溶液与
溶液与 粉发生的氧化还原反应。
粉发生的氧化还原反应。
(1) 与
与 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为__________ 。
(2)查阅资料可知, 为白色粉末,难溶于水,溶于浓盐酸可生成黄色氯亚铜酸
为白色粉末,难溶于水,溶于浓盐酸可生成黄色氯亚铜酸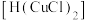 溶液。该实验小组对实验中得到的白色沉淀进行了如下探究,并提出猜想。
溶液。该实验小组对实验中得到的白色沉淀进行了如下探究,并提出猜想。
①甲同学认为白色沉淀的生成与铜粉的量有关。在实验②的基础上,该同学设计了如下方案:__________ ,若现象为__________ ,则证明甲同学猜想正确。
②乙同学认为白色沉淀的生成与 有关,可在实验①的基础上设计实验方案验证此猜想,若猜想正确,则实验方案及现象为
有关,可在实验①的基础上设计实验方案验证此猜想,若猜想正确,则实验方案及现象为__________ 。
③丙同学认为白色沉淀为 ,请设计实验验证该同学的猜想正确:
,请设计实验验证该同学的猜想正确:__________ 。写出生成白色沉淀的化学方程式:__________ 。
(3)该小组同学为进一步验证猜想的合理性,设计了如图所示的电化学装置进行实验。
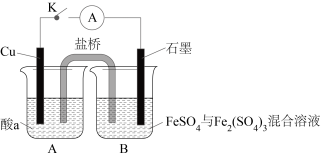
①若烧杯A中生成白色固体,则酸a为__________ (填名称),铜电极的电极反应式为__________ 。
②若酸a为浓盐酸,则烧杯A中未见白色固体生成,铜电极的电极反应式为__________ 。
 溶液与
溶液与 粉发生的氧化还原反应。
粉发生的氧化还原反应。实验编号 | 实验操作 | 实验现象 |
① |  充分振荡,加入2mL蒸馏水 充分振荡,加入2mL蒸馏水 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
② |  充分振荡,加入2mL蒸馏水 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 |
 与
与 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为(2)查阅资料可知,
 为白色粉末,难溶于水,溶于浓盐酸可生成黄色氯亚铜酸
为白色粉末,难溶于水,溶于浓盐酸可生成黄色氯亚铜酸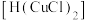 溶液。该实验小组对实验中得到的白色沉淀进行了如下探究,并提出猜想。
溶液。该实验小组对实验中得到的白色沉淀进行了如下探究,并提出猜想。①甲同学认为白色沉淀的生成与铜粉的量有关。在实验②的基础上,该同学设计了如下方案:
②乙同学认为白色沉淀的生成与
 有关,可在实验①的基础上设计实验方案验证此猜想,若猜想正确,则实验方案及现象为
有关,可在实验①的基础上设计实验方案验证此猜想,若猜想正确,则实验方案及现象为③丙同学认为白色沉淀为
 ,请设计实验验证该同学的猜想正确:
,请设计实验验证该同学的猜想正确:(3)该小组同学为进一步验证猜想的合理性,设计了如图所示的电化学装置进行实验。

①若烧杯A中生成白色固体,则酸a为
②若酸a为浓盐酸,则烧杯A中未见白色固体生成,铜电极的电极反应式为
您最近一年使用:0次
8 . 结晶水合物X由六种元素组成,某学习小组按如下流程进行实验:
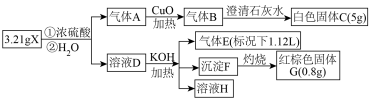
已知:
①第一步反应中元素价态没有发生变化;
②气体E能使湿润的红色石蕊试纸变蓝色;
③溶液D中含有三种正盐,其中一种即为溶液H中的唯一溶质,另一种盐M在高温灼烧时可得到相同物质的量的三种产物:红棕色G和两种组成元素相同的氧化物。
(1)X的组成中,非金属元素有___________ ,X的化学式___________ 。
(2)盐M高温分解生成三种氧化物的化学方程式___________ 。
(3)沉淀F和次氯酸钠、浓氢氧化钠反应可以制备一种能净水的钠盐,请写出该反应的离子方程式___________ 。
(4)溶液D在空气中敞口放置一段时间后,请设计实验检验溶液D中可能存在的金属阳离子:___________ 。

已知:
①第一步反应中元素价态没有发生变化;
②气体E能使湿润的红色石蕊试纸变蓝色;
③溶液D中含有三种正盐,其中一种即为溶液H中的唯一溶质,另一种盐M在高温灼烧时可得到相同物质的量的三种产物:红棕色G和两种组成元素相同的氧化物。
(1)X的组成中,非金属元素有
(2)盐M高温分解生成三种氧化物的化学方程式
(3)沉淀F和次氯酸钠、浓氢氧化钠反应可以制备一种能净水的钠盐,请写出该反应的离子方程式
(4)溶液D在空气中敞口放置一段时间后,请设计实验检验溶液D中可能存在的金属阳离子:
您最近一年使用:0次
解题方法
9 . 利用水钴矿(主要成分为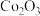 、
、 、FeO、
、FeO、 、
、 )制备二次电池添加剂
)制备二次电池添加剂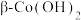 的流程如下。
的流程如下。
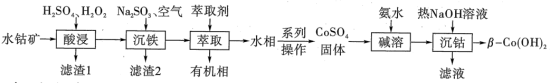
已知:i.沉淀过快无法形成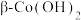 ,
, 在碱性溶液中易被
在碱性溶液中易被 氧化。
氧化。
ii.25℃时,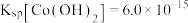 ,
, 的
的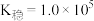 。
。
(1)“酸浸”中 与
与 、
、 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)“沉铁”中 被
被 与空气混合产生的
与空气混合产生的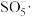 自由基氧化,
自由基氧化,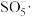 被还原为
被还原为___________ 。
(3)“萃取”可分离Co、Mn元素。下列物质可作萃取剂的是___________ 。(填标号)
A. B.
B.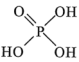 C.
C.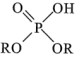
(4) 过程中:
过程中:
①“沉钴”中, 的离子方程式为
的离子方程式为___________ ,该反应的
___________ 。
②制备 ,先加氨水再加NaOH溶液的理由是
,先加氨水再加NaOH溶液的理由是___________ 。
③“沉钴”中使用热NaOH溶液的目的是___________ 。
(5) 晶胞如图。
晶胞如图。
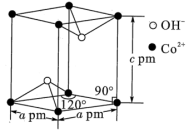
① 处于
处于 形成的
形成的___________ 空隙中。
②晶胞密度为___________  (列出表达式即可)。
(列出表达式即可)。
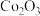 、
、 、FeO、
、FeO、 、
、 )制备二次电池添加剂
)制备二次电池添加剂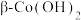 的流程如下。
的流程如下。
已知:i.沉淀过快无法形成
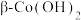 ,
, 在碱性溶液中易被
在碱性溶液中易被 氧化。
氧化。ii.25℃时,
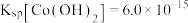 ,
, 的
的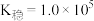 。
。(1)“酸浸”中
 与
与 、
、 发生反应的离子方程式为
发生反应的离子方程式为(2)“沉铁”中
 被
被 与空气混合产生的
与空气混合产生的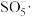 自由基氧化,
自由基氧化,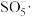 被还原为
被还原为(3)“萃取”可分离Co、Mn元素。下列物质可作萃取剂的是
A.
 B.
B. C.
C.
(4)
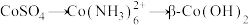 过程中:
过程中:①“沉钴”中,
 的离子方程式为
的离子方程式为
②制备
 ,先加氨水再加NaOH溶液的理由是
,先加氨水再加NaOH溶液的理由是③“沉钴”中使用热NaOH溶液的目的是
(5)
 晶胞如图。
晶胞如图。
①
 处于
处于 形成的
形成的②晶胞密度为
 (列出表达式即可)。
(列出表达式即可)。
您最近一年使用:0次
10 . 氢镍电池适合大电流放电,常用作动力电池,其负极材料M为Ni、石墨粉和少量La、Mg、MnO2,放电时电池反应为NiOOH+MH=Ni(OH)2+M。实验室对废旧氢镍电池进行综合处理,回收部分金属资源的工艺流程如图:
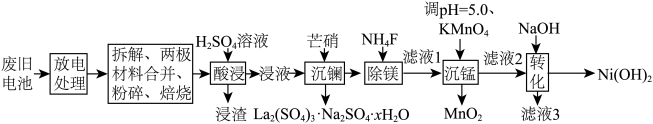
已知:Ni2+可形成[Ni(NH3)6]2+配离子;Ksp(MgF2)=5.2×10-11;H2SO4第一步完全电离,Ka(HSO )=1.1×10-2。回答下列问题:
)=1.1×10-2。回答下列问题:
(1)氢镍电池充电时,阴极反应式为______ ;“放电处理”的目的为______ 。
(2)“酸浸”所得浸渣中几乎不含MnO2的原因为______ 。
(3)“沉镧”工序中,溶液的pH与沉镧率的变化关系如图所示。pH<2.0时,沉镧率降低的原因为______ 。

(4)“除镁”所得滤液1中c(F-)=1.0×10-2mol•L-1,则c(Mg2+)=_____ ;该工序不能使用玻璃仪器的原因为______ 。
(5)“沉锰”反应的离子方程式为______ 。
(6)“转化”所用试剂不宜选用氨水的原因为______ ;滤液3中可提取出的循环利用的物质为______ (填化学式)。

已知:Ni2+可形成[Ni(NH3)6]2+配离子;Ksp(MgF2)=5.2×10-11;H2SO4第一步完全电离,Ka(HSO
 )=1.1×10-2。回答下列问题:
)=1.1×10-2。回答下列问题:(1)氢镍电池充电时,阴极反应式为
(2)“酸浸”所得浸渣中几乎不含MnO2的原因为
(3)“沉镧”工序中,溶液的pH与沉镧率的变化关系如图所示。pH<2.0时,沉镧率降低的原因为

(4)“除镁”所得滤液1中c(F-)=1.0×10-2mol•L-1,则c(Mg2+)=
(5)“沉锰”反应的离子方程式为
(6)“转化”所用试剂不宜选用氨水的原因为
您最近一年使用:0次



