解题方法
1 . 铬是最坚硬的金属,金刚石是自然界中最硬的物质。一种由铬铁矿(含 、MgO、
、MgO、 ,
, 等)为原料制备铬单质的流程如图所示。
等)为原料制备铬单质的流程如图所示。 ,
, 等。
等。
②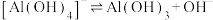
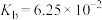 。
。
③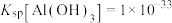
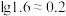 。
。
回答以下问题:
(1)焙烧时将矿料和NaOH进行研磨,目的是__________________ 。
(2)焙烧时生成 的化学方程式是
的化学方程式是__________________ 。
(3)已知0.1 mol/L 溶液中,铝形态的浓度(以
溶液中,铝形态的浓度(以 或
或 计)的对数(
计)的对数(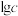 )随溶液pH变化的关系如图。
)随溶液pH变化的关系如图。______ 。(已知: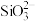 恰好在a~b的pH范围内完全沉淀)
恰好在a~b的pH范围内完全沉淀)
(4)工业上冶炼Cr的方法是______ 。基态Cr原子的价层电子排布图为____________ 。从原子结构及性质的角度分析金属Cr硬度很大的原因:________________________ 。
(5)晶体硅具有与金刚石相似的晶体结构(如图),已知Si原子半径为r pm,阿伏加德罗常数的值为 ,则晶体硅的密度为
,则晶体硅的密度为______ g/cm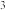 (列出计算表达式)。
(列出计算表达式)。____________ 。
 、MgO、
、MgO、 ,
, 等)为原料制备铬单质的流程如图所示。
等)为原料制备铬单质的流程如图所示。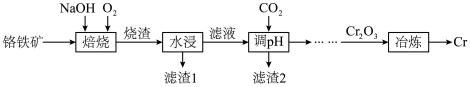
 ,
, 等。
等。②
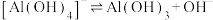
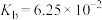 。
。③
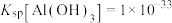
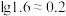 。
。回答以下问题:
(1)焙烧时将矿料和NaOH进行研磨,目的是
(2)焙烧时生成
 的化学方程式是
的化学方程式是(3)已知0.1 mol/L
 溶液中,铝形态的浓度(以
溶液中,铝形态的浓度(以 或
或 计)的对数(
计)的对数(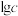 )随溶液pH变化的关系如图。
)随溶液pH变化的关系如图。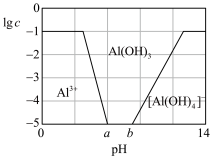
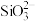 恰好在a~b的pH范围内完全沉淀)
恰好在a~b的pH范围内完全沉淀)(4)工业上冶炼Cr的方法是
(5)晶体硅具有与金刚石相似的晶体结构(如图),已知Si原子半径为r pm,阿伏加德罗常数的值为
 ,则晶体硅的密度为
,则晶体硅的密度为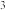 (列出计算表达式)。
(列出计算表达式)。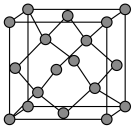
您最近一年使用:0次
2024-06-07更新
|
48次组卷
|
2卷引用:2024届新高考教学教研联盟高三下学期第一次联考化学试卷
解题方法
2 . 现有一种以 为载体的废旧催化剂,表面积碳且被有机物覆盖,含少量金属银。某实验室设计以下流程拟对废旧催化剂中的
为载体的废旧催化剂,表面积碳且被有机物覆盖,含少量金属银。某实验室设计以下流程拟对废旧催化剂中的 和Pt进行回收。
和Pt进行回收。 不溶于硝酸。请回答下列问题:
不溶于硝酸。请回答下列问题:
(1)步骤I中将废催化剂焙烧的目的是___________ 。
(2)操作Ⅳ的名称是___________ ;检验废渣洗净的方法是___________ 。
(3)步骤Ⅲ中氧化剂是 ,反应后Pt转化成
,反应后Pt转化成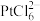 ,每生成1mol
,每生成1mol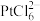 ,需要消耗H+的量为
,需要消耗H+的量为___________ mol。该步骤中有氯气生成,其离子方程式为___________ 。
(4)步骤V中,在适当酸度下,树脂上发生: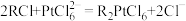 ,
,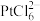 吸附在树脂上得以富集,饱和后的树脂用碱液淋洗后得到含铂溶液,而要使树脂再生能重复使用,最好使用
吸附在树脂上得以富集,饱和后的树脂用碱液淋洗后得到含铂溶液,而要使树脂再生能重复使用,最好使用___________ (填化学式)淋洗。
(5)步骤Ⅵ中生成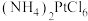 沉淀,将该沉淀在
沉淀,将该沉淀在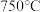 下煅烧生成铂和三种气体,其中一种气体是空气中的主要成份之一。请写出该反应的化学反应方程式
下煅烧生成铂和三种气体,其中一种气体是空气中的主要成份之一。请写出该反应的化学反应方程式___________ 。
 为载体的废旧催化剂,表面积碳且被有机物覆盖,含少量金属银。某实验室设计以下流程拟对废旧催化剂中的
为载体的废旧催化剂,表面积碳且被有机物覆盖,含少量金属银。某实验室设计以下流程拟对废旧催化剂中的 和Pt进行回收。
和Pt进行回收。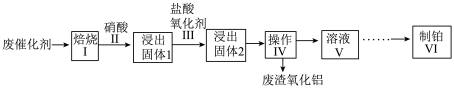
 不溶于硝酸。请回答下列问题:
不溶于硝酸。请回答下列问题:(1)步骤I中将废催化剂焙烧的目的是
(2)操作Ⅳ的名称是
(3)步骤Ⅲ中氧化剂是
 ,反应后Pt转化成
,反应后Pt转化成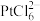 ,每生成1mol
,每生成1mol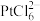 ,需要消耗H+的量为
,需要消耗H+的量为(4)步骤V中,在适当酸度下,树脂上发生:
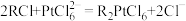 ,
,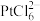 吸附在树脂上得以富集,饱和后的树脂用碱液淋洗后得到含铂溶液,而要使树脂再生能重复使用,最好使用
吸附在树脂上得以富集,饱和后的树脂用碱液淋洗后得到含铂溶液,而要使树脂再生能重复使用,最好使用(5)步骤Ⅵ中生成
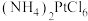 沉淀,将该沉淀在
沉淀,将该沉淀在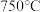 下煅烧生成铂和三种气体,其中一种气体是空气中的主要成份之一。请写出该反应的化学反应方程式
下煅烧生成铂和三种气体,其中一种气体是空气中的主要成份之一。请写出该反应的化学反应方程式
您最近一年使用:0次
3 . 喹啉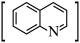 广泛用于医药、染料、农药和化学助剂等领域。在无水体系中利用Skraup反应制备喹啉的反应原理如下:
广泛用于医药、染料、农药和化学助剂等领域。在无水体系中利用Skraup反应制备喹啉的反应原理如下:
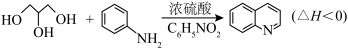
| 物质 | 分子式 | 相对分子质量 | 熔点(℃) | 沸点(℃° |
| 甘油 |  | 92 | 17.8 | 290 |
| 苯胺 | 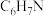 | 93 | -6.2 | 184 |
| 硝基苯 | 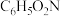 | 123 | 6 | 210 |
| 喹啉 | 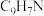 | 129 | -15.6 | 238.1 |
ⅱ.硫酸亚铁作反应的缓和剂。
实验步骤:
①预热:在250 mL三颈烧瓶中,加入2.0 g
 晶体和19 g无水甘油,控制温度在180℃左右,加热5 min。
晶体和19 g无水甘油,控制温度在180℃左右,加热5 min。②加料:待自然降温至100℃左右,依次加入4.65 g苯胺,4 g硝基苯和9 mL浓硫酸。
③制备:先用小火加热装置A,当反应液微沸时先立即移去加热装置,保持微沸继续反应,后小火回流2 h。
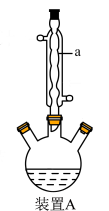
⑤蒸出:将溶液转移至圆底烧瓶,滴加40%NaOH溶液至强碱性,再用水蒸气蒸出。
⑥提纯:将粗品经分离、提纯、干燥后得到产品4.3g。
请回答下列问题:
(1)仪器a的名称是
(2)步骤③中,移去加热装置后若反应液继续沸腾,可采取的方法是
(3)用离子方程式表示步骤④中淀粉-KI试纸变蓝的原因:
(4)已知
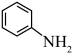 与
与 在酸性条件下反应生成重氮盐,加热煮沸时水解产生
在酸性条件下反应生成重氮盐,加热煮沸时水解产生 和苯酚。
和苯酚。步骤⑤中加入40%NaOH溶液的作用有:①
(5)检验步骤⑤中苯酚是否除尽的实验操作是
(6)计算该实验中喹啉的产率:
您最近一年使用:0次
2024-06-07更新
|
64次组卷
|
2卷引用:2024届新高考教学教研联盟高三下学期第一次联考化学试卷
解题方法
4 . 碲广泛用于半导体器件、合金、化工原料及铸铁、橡胶、玻璃等工业。工业上利用电解铜的阳极泥(主要成分为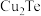 、
、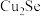 ,还含有Ag、Au、Si等元素)提取碲,其工艺流程如图甲所示。
,还含有Ag、Au、Si等元素)提取碲,其工艺流程如图甲所示。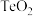 是一种两性氧化物,微溶于水,易溶于强酸和强碱。
是一种两性氧化物,微溶于水,易溶于强酸和强碱。
② 为酸性氧化物,溶于水生成亚硒酸。常温下,亚硒酸的电离平衡常数为
为酸性氧化物,溶于水生成亚硒酸。常温下,亚硒酸的电离平衡常数为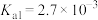 ,
,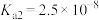 。
。
回答下列问题:
(1)“氧化焙烧”时,为了加快反应速率,可采取的措施为_______ (写一种即可);流程中多次用到过滤操作,实验室进行过滤时需要用到的玻璃仪器有烧杯、_______ 。
(2)“氧化焙烧”后碲元素转化为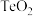 ,写出
,写出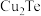 反应的化学方程式:
反应的化学方程式:_______ 。
(3)“水浸”后,“滤液”中溶质的主要成分为_______ (填化学式)。
(4)“酸化”后,碲以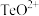 形式存在,则“还原”过程中反应的离子方程式为
形式存在,则“还原”过程中反应的离子方程式为_______ 。
(5)室温下,用水吸收二氧化硒,得到溶液的pH=2,此时溶液中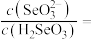
_______ 。
(6)近年,碲化镉太阳能发电玻璃在我国发展迅猛,被誉为“墙壁上的油田”,碲化镉立方晶胞结构如图乙所示。碲化镉的化学式为_______ ,Cd原子周围等距离且最近的Te原子为_______ 个,测得碲化镉晶体的密度为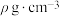 ,设
,设 为阿伏加德罗常数的值,则晶胞边长为
为阿伏加德罗常数的值,则晶胞边长为_______ pm。
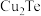 、
、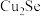 ,还含有Ag、Au、Si等元素)提取碲,其工艺流程如图甲所示。
,还含有Ag、Au、Si等元素)提取碲,其工艺流程如图甲所示。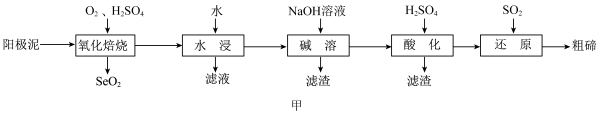
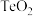 是一种两性氧化物,微溶于水,易溶于强酸和强碱。
是一种两性氧化物,微溶于水,易溶于强酸和强碱。②
 为酸性氧化物,溶于水生成亚硒酸。常温下,亚硒酸的电离平衡常数为
为酸性氧化物,溶于水生成亚硒酸。常温下,亚硒酸的电离平衡常数为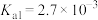 ,
,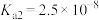 。
。回答下列问题:
(1)“氧化焙烧”时,为了加快反应速率,可采取的措施为
(2)“氧化焙烧”后碲元素转化为
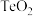 ,写出
,写出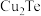 反应的化学方程式:
反应的化学方程式:(3)“水浸”后,“滤液”中溶质的主要成分为
(4)“酸化”后,碲以
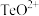 形式存在,则“还原”过程中反应的离子方程式为
形式存在,则“还原”过程中反应的离子方程式为(5)室温下,用水吸收二氧化硒,得到溶液的pH=2,此时溶液中
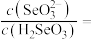
(6)近年,碲化镉太阳能发电玻璃在我国发展迅猛,被誉为“墙壁上的油田”,碲化镉立方晶胞结构如图乙所示。碲化镉的化学式为
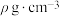 ,设
,设 为阿伏加德罗常数的值,则晶胞边长为
为阿伏加德罗常数的值,则晶胞边长为
您最近一年使用:0次
2024-06-07更新
|
51次组卷
|
3卷引用:2024届河南省重点高中高三下学期4月联考模拟预测理综试题-高中化学
名校
解题方法
5 . 氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)三氟化氮(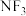 )气体是一种新型电子材料。其中N元素的化合价为
)气体是一种新型电子材料。其中N元素的化合价为______ ,它在潮湿的空气中与水蒸气能发生反应生成HF、NO和HNO。反应过程中,被氧化与被还原的元素的质量之比为______ 。
(2)联氨( )是一种常用的强还原剂。可用以下方法制得(装置如右图):NaClO碱性溶液与尿素[化学式为
)是一种常用的强还原剂。可用以下方法制得(装置如右图):NaClO碱性溶液与尿素[化学式为 ,沸点196.6℃]水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。滴液漏斗内的试剂是
,沸点196.6℃]水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。滴液漏斗内的试剂是______ ;制备联氨的离子方程式为______ 。 与澄清石灰水混合,溶液体积为2L,半分钟后的
与澄清石灰水混合,溶液体积为2L,半分钟后的 的物质的量减少了0.2mol,
的物质的量减少了0.2mol,
______ 。
(4)已知: 分子中的键能为a kJ/mol;
分子中的键能为a kJ/mol; 分子中
分子中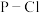 键能为b kJ/mol;1mol
键能为b kJ/mol;1mol 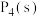 转化为气态P原子吸收能量c kJ。写出
转化为气态P原子吸收能量c kJ。写出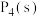 与
与 反应生成
反应生成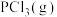 的热化学方程式:
的热化学方程式:______ 。
(1)三氟化氮(
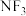 )气体是一种新型电子材料。其中N元素的化合价为
)气体是一种新型电子材料。其中N元素的化合价为(2)联氨(
 )是一种常用的强还原剂。可用以下方法制得(装置如右图):NaClO碱性溶液与尿素[化学式为
)是一种常用的强还原剂。可用以下方法制得(装置如右图):NaClO碱性溶液与尿素[化学式为 ,沸点196.6℃]水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。滴液漏斗内的试剂是
,沸点196.6℃]水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。滴液漏斗内的试剂是
 与澄清石灰水混合,溶液体积为2L,半分钟后的
与澄清石灰水混合,溶液体积为2L,半分钟后的 的物质的量减少了0.2mol,
的物质的量减少了0.2mol,
(4)已知:
 分子中的键能为a kJ/mol;
分子中的键能为a kJ/mol; 分子中
分子中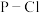 键能为b kJ/mol;1mol
键能为b kJ/mol;1mol 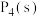 转化为气态P原子吸收能量c kJ。写出
转化为气态P原子吸收能量c kJ。写出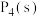 与
与 反应生成
反应生成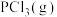 的热化学方程式:
的热化学方程式:
您最近一年使用:0次
名校
6 . 结晶水合物A是一种中药的主要成分,具有养血安神,平肝镇惊,解毒消肿的功效。某实验小组取9.6gA按如下流程进行相关实验。 0.1
0.1
 溶液时恰好反应;溶液E呈红色。
溶液时恰好反应;溶液E呈红色。
请回答下列问题:
(1)B的名称为_______ ,A的化学式为_______ 。
(2)请写出向溶液C中加入 溶液时发生的反应的离子方程式
溶液时发生的反应的离子方程式_______ 。
(3)已知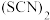 是拟卤素,性质与卤素相似。向E中滴加硫酸铜溶液,E中红色褪去并产生
是拟卤素,性质与卤素相似。向E中滴加硫酸铜溶液,E中红色褪去并产生 白色沉淀,请写出该过程的化学方程式:
白色沉淀,请写出该过程的化学方程式:_______ 。
(4)向E中通入 ,一段时间后也可观察到红色褪去。甲同学认为是
,一段时间后也可观察到红色褪去。甲同学认为是 被氧化,乙同学认为是
被氧化,乙同学认为是 被氧化。请设计能说明上述两种假设是否正确的实验流程及对应的现象与结论:
被氧化。请设计能说明上述两种假设是否正确的实验流程及对应的现象与结论:_______ 。

 0.1
0.1
 溶液时恰好反应;溶液E呈红色。
溶液时恰好反应;溶液E呈红色。请回答下列问题:
(1)B的名称为
(2)请写出向溶液C中加入
 溶液时发生的反应的离子方程式
溶液时发生的反应的离子方程式(3)已知
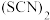 是拟卤素,性质与卤素相似。向E中滴加硫酸铜溶液,E中红色褪去并产生
是拟卤素,性质与卤素相似。向E中滴加硫酸铜溶液,E中红色褪去并产生 白色沉淀,请写出该过程的化学方程式:
白色沉淀,请写出该过程的化学方程式:(4)向E中通入
 ,一段时间后也可观察到红色褪去。甲同学认为是
,一段时间后也可观察到红色褪去。甲同学认为是 被氧化,乙同学认为是
被氧化,乙同学认为是 被氧化。请设计能说明上述两种假设是否正确的实验流程及对应的现象与结论:
被氧化。请设计能说明上述两种假设是否正确的实验流程及对应的现象与结论:
您最近一年使用:0次
名校
解题方法
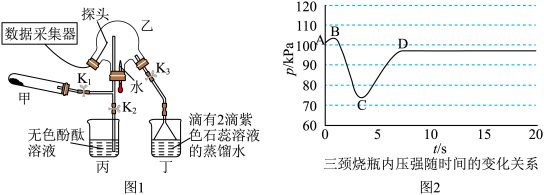
7 . 某化学兴趣小组利用图1装置(加热和夹持装置已省略)制备氨气并进行喷泉实验.
i.氨气的制备:打开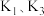 ,关闭
,关闭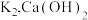 和
和 固体在甲处试管内反应生成
固体在甲处试管内反应生成 .
.
ⅱ.氨气的喷泉实验:当丁中溶液变蓝后,停止制备 ,关闭
,关闭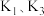 ,打开
,打开 ,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
请回答下列问题:___________________ ;丁处倒置漏斗的作用是______________ ;氨水中含有的分子有 、
、______________ .
(2)C→D过程中,三颈烧瓶中的现象为_____________ ; 能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为
能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为_____________ .
(3)该兴趣小组利用如图3所示装置进行另外一种喷泉实验.__________________________ .
②烧杯中发生反应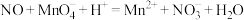 (未配平),该反应的氧化剂为
(未配平),该反应的氧化剂为__________ (填化学式),氧化产物和还原产物的物质的量之比为__________ (填最简整数比).
i.氨气的制备:打开
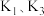 ,关闭
,关闭 和
和 固体在甲处试管内反应生成
固体在甲处试管内反应生成 .
.ⅱ.氨气的喷泉实验:当丁中溶液变蓝后,停止制备
 ,关闭
,关闭 ,打开
,打开 ,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.请回答下列问题:
 、
、(2)C→D过程中,三颈烧瓶中的现象为
 能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为
能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为(3)该兴趣小组利用如图3所示装置进行另外一种喷泉实验.
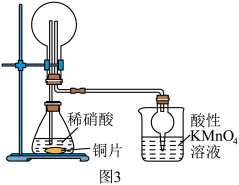
②烧杯中发生反应
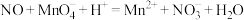 (未配平),该反应的氧化剂为
(未配平),该反应的氧化剂为
您最近一年使用:0次
2024-06-06更新
|
107次组卷
|
3卷引用:甘肃省白银市2023-2024学年高一下学期期中考试化学试题
8 . 化学小组实验探究 与
与 悬浊液的反应。
悬浊液的反应。
资料:i. (无色),
(无色), 易被氧气氧化为
易被氧气氧化为 。
。
ii. 很不稳定,易转化为
很不稳定,易转化为 。
。
iii. 在酸性溶液中易转化为
在酸性溶液中易转化为 、
、 。
。
实验一:I.向 溶液中加入浓
溶液中加入浓 溶液,制得
溶液,制得 悬浊液,测得
悬浊液,测得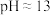 。
。
Ⅱ.向 悬浊液中通入
悬浊液中通入 产生大量白色沉淀A,测得
产生大量白色沉淀A,测得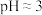 。
。
(1)产生 的离子方程式是
的离子方程式是___________ 。
(2)推测白色沉淀A中可能含有 、
、 、
、 、
、 、
、 。为检验白色沉淀成分,进行实验二:
。为检验白色沉淀成分,进行实验二:
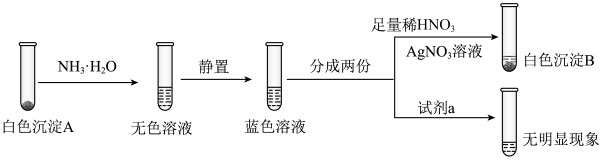
实验二:将实验一中所得的白色沉淀A过滤、洗涤,并进行如下实验。 、
、 ,试剂a为
,试剂a为___________ 。
②根据上述实验推测白色沉淀A为 ,推测依据是
,推测依据是___________ 。
③产生白色沉淀A的离子方程式是___________ 。
④实验二中无色溶液变为蓝色溶液的离子方程式为___________ 。
(3)为排除实验一溶液中 的影响,小组同学进行了实验三
的影响,小组同学进行了实验三
实验三:
I.向 溶液中加入浓
溶液中加入浓 溶液,过滤,洗涤沉淀,取洗涤液,___________(填操作和现象)。将洗净的
溶液,过滤,洗涤沉淀,取洗涤液,___________(填操作和现象)。将洗净的 固体加水得悬浊液,测得
固体加水得悬浊液,测得 。
。
Ⅱ.向悬浊液中通入SO2至过量,观察到局部先产生少量浅黄色沉淀,而后转化为紫红色固体,溶液变为绿色[含 ],测得溶液
],测得溶液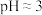 。
。
Ⅲ.向 溶液中通入
溶液中通入 至过量,无明显现象。
至过量,无明显现象。
①补全步骤I中的操作和现象___________ 。
②经确认浅黄色沉淀为 ,紫红色固体为
,紫红色固体为 。
。 与
与 悬浊液发生了氧化还原反应。结合化学用语解释产生
悬浊液发生了氧化还原反应。结合化学用语解释产生 的原因
的原因___________ 。
③解释实验三中步骤Ⅲ与步骤Ⅱ现象不同的原因___________ 。
(4)综合上述实验, 与二价铜反应的产物与
与二价铜反应的产物与___________ 等因素有关(答出两点即可)。
 与
与 悬浊液的反应。
悬浊液的反应。资料:i.
 (无色),
(无色), 易被氧气氧化为
易被氧气氧化为 。
。ii.
 很不稳定,易转化为
很不稳定,易转化为 。
。iii.
 在酸性溶液中易转化为
在酸性溶液中易转化为 、
、 。
。实验一:I.向
 溶液中加入浓
溶液中加入浓 溶液,制得
溶液,制得 悬浊液,测得
悬浊液,测得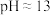 。
。Ⅱ.向
 悬浊液中通入
悬浊液中通入 产生大量白色沉淀A,测得
产生大量白色沉淀A,测得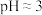 。
。(1)产生
 的离子方程式是
的离子方程式是(2)推测白色沉淀A中可能含有
 、
、 、
、 、
、 、
、 。为检验白色沉淀成分,进行实验二:
。为检验白色沉淀成分,进行实验二:实验二:将实验一中所得的白色沉淀A过滤、洗涤,并进行如下实验。
 、
、 ,试剂a为
,试剂a为②根据上述实验推测白色沉淀A为
 ,推测依据是
,推测依据是③产生白色沉淀A的离子方程式是
④实验二中无色溶液变为蓝色溶液的离子方程式为
(3)为排除实验一溶液中
 的影响,小组同学进行了实验三
的影响,小组同学进行了实验三实验三:
I.向
 溶液中加入浓
溶液中加入浓 溶液,过滤,洗涤沉淀,取洗涤液,___________(填操作和现象)。将洗净的
溶液,过滤,洗涤沉淀,取洗涤液,___________(填操作和现象)。将洗净的 固体加水得悬浊液,测得
固体加水得悬浊液,测得 。
。Ⅱ.向悬浊液中通入SO2至过量,观察到局部先产生少量浅黄色沉淀,而后转化为紫红色固体,溶液变为绿色[含
 ],测得溶液
],测得溶液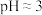 。
。Ⅲ.向
 溶液中通入
溶液中通入 至过量,无明显现象。
至过量,无明显现象。①补全步骤I中的操作和现象
②经确认浅黄色沉淀为
 ,紫红色固体为
,紫红色固体为 。
。 与
与 悬浊液发生了氧化还原反应。结合化学用语解释产生
悬浊液发生了氧化还原反应。结合化学用语解释产生 的原因
的原因③解释实验三中步骤Ⅲ与步骤Ⅱ现象不同的原因
(4)综合上述实验,
 与二价铜反应的产物与
与二价铜反应的产物与
您最近一年使用:0次
2024-06-06更新
|
62次组卷
|
2卷引用:北京市海淀区第一零一中学2023-2024学年高三下学期三模化学试题
名校
解题方法
9 . 选择性还原技术(SCR)可以有效脱除烟气中的氮氧化物( )。
)。
已知:ⅰ. 在164℃以上时可加速分解成
在164℃以上时可加速分解成 ;
;
ⅱ.当NO与 的物质的量相同时,会发生快速反应:
的物质的量相同时,会发生快速反应:
(1)钒基催化剂(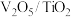 )可用于
)可用于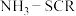 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应机理如图所示。
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应机理如图所示。___________ 。
②若烟气中含有硫的氧化物,则会降低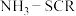 的反应速率,可能的原因是
的反应速率,可能的原因是___________ 。
(2)臭氧对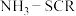 反应具有一定的辅助作用:
反应具有一定的辅助作用: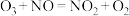 。在不同温度下,经相同时间后测得不同
。在不同温度下,经相同时间后测得不同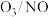 投料比时NO的脱除率如图所示。
投料比时NO的脱除率如图所示。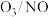 投料比为0.5时,NO脱除率较高的原因是
投料比为0.5时,NO脱除率较高的原因是___________ 。
②350℃后,NO脱除率均有不同程度下降,可能的原因是___________ (答出两点)。
(3)以电化学结合 氧化法除去烟气中的
氧化法除去烟气中的 和
和 ,装置如图所示。
,装置如图所示。 ,则经过质子交换膜的
,则经过质子交换膜的 为
为___________ mol。
②从资源利用角度说明结合电解法与 氧化法的优点
氧化法的优点___________ 。
 )。
)。已知:ⅰ.
 在164℃以上时可加速分解成
在164℃以上时可加速分解成 ;
;ⅱ.当NO与
 的物质的量相同时,会发生快速反应:
的物质的量相同时,会发生快速反应:
(1)钒基催化剂(
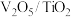 )可用于
)可用于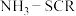 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应机理如图所示。
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应机理如图所示。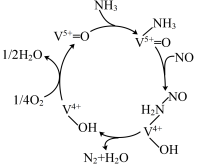
②若烟气中含有硫的氧化物,则会降低
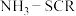 的反应速率,可能的原因是
的反应速率,可能的原因是(2)臭氧对
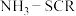 反应具有一定的辅助作用:
反应具有一定的辅助作用: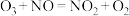 。在不同温度下,经相同时间后测得不同
。在不同温度下,经相同时间后测得不同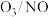 投料比时NO的脱除率如图所示。
投料比时NO的脱除率如图所示。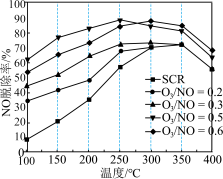
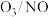 投料比为0.5时,NO脱除率较高的原因是
投料比为0.5时,NO脱除率较高的原因是②350℃后,NO脱除率均有不同程度下降,可能的原因是
(3)以电化学结合
 氧化法除去烟气中的
氧化法除去烟气中的 和
和 ,装置如图所示。
,装置如图所示。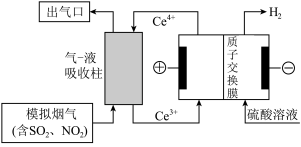
 ,则经过质子交换膜的
,则经过质子交换膜的 为
为②从资源利用角度说明结合电解法与
 氧化法的优点
氧化法的优点
您最近一年使用:0次
10 . 某科研小组模拟在实验室条件下,用硫铁矿制备硫酸并测定其浓度,其实验过程如图所示。
(1)硫铁矿主要成分为_____ (写化学式);“操作1”和“操作2”_____ (填“相同”或“不同”)。
(2)“浸取”过程中,主要发生的反应的离子方程式为_____ 。
(3)“氧化”过程所需的氯气,可用漂白液和浓盐酸反应制取,该制取氯气的反应中氧化剂和还原剂的物质的量之比为_____ 。
(4)量取上述制备的硫酸溶液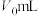 ,煮沸一段时间,冷却后,加水稀释到250mL,量取25mL配制的硫酸溶液于锥形瓶,滴几滴
,煮沸一段时间,冷却后,加水稀释到250mL,量取25mL配制的硫酸溶液于锥形瓶,滴几滴_____ 溶液,用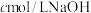 溶液滴定到终点,消耗
溶液滴定到终点,消耗 溶液
溶液 。该硫酸溶液的浓度为
。该硫酸溶液的浓度为_____  ,经过3次平行实验,发现测得的结果高于实际浓度,其原因可能是
,经过3次平行实验,发现测得的结果高于实际浓度,其原因可能是_____ (操作都正确)。

(1)硫铁矿主要成分为
(2)“浸取”过程中,主要发生的反应的离子方程式为
(3)“氧化”过程所需的氯气,可用漂白液和浓盐酸反应制取,该制取氯气的反应中氧化剂和还原剂的物质的量之比为
(4)量取上述制备的硫酸溶液
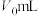 ,煮沸一段时间,冷却后,加水稀释到250mL,量取25mL配制的硫酸溶液于锥形瓶,滴几滴
,煮沸一段时间,冷却后,加水稀释到250mL,量取25mL配制的硫酸溶液于锥形瓶,滴几滴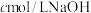 溶液滴定到终点,消耗
溶液滴定到终点,消耗 溶液
溶液 。该硫酸溶液的浓度为
。该硫酸溶液的浓度为 ,经过3次平行实验,发现测得的结果高于实际浓度,其原因可能是
,经过3次平行实验,发现测得的结果高于实际浓度,其原因可能是
您最近一年使用:0次
2024-06-06更新
|
25次组卷
|
2卷引用:2024届安徽省名校教研联盟高三下学期3月月考化学试卷



