解题方法
1 . 我国著名传染病学专家李兰娟院士表示:乙醚、75%的乙醇、含氯的消毒剂可以有效地灭活2019新型冠状病毒(2019-nCoV)。其中二氧化氯(ClO₂)是国际上公认的安全绿色消毒剂。常用于自来水的消毒,其沸点为11 ℃,可溶于水,浓度较高时易发生爆炸。某学习小组在实验室通过反应:30NaClO3+20H2SO4(浓)+7CH3OH =30ClO2↑+6HCOOH+10Na3H(SO4)2+CO2↑+23H2O,制备ClO2,并将其转化为便于贮存的NaClO2 固体。实验装置如下图所示。请回答下列问题:
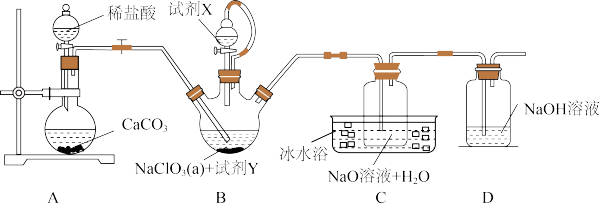
(1)试剂Y的名称为_______ ;盛放CaCO3的仪器名称为_______ 。
(2)反应结束后需再通入一定量的CO2,其目的是:_______ 。实际实验过程中需持续通入一定量的CO2,其目的是:_______ 。
(3)装置C中生成NaClO2的离子方程式为:_______ 。
(4)设计实验证明NaClO2溶液具有氧化性:_______ 。(可供选择的试剂:稀HNO3、稀H2SO4、BaCl2溶液、FeCl2溶液、KSCN溶液)。
(5)某同学欲测定经ClO2消毒过的自来水中ClO2残留量,他进行了如下实验:
Ⅰ在锥形瓶中加入足量的碘化钾,用50 mL蒸馏水溶解后,再加入3 mL稀硫酸;
Ⅱ再向该锥形瓶中加入20.00 mL自来水;
Ⅲ用0. 0001 mol·L-1 Na2S2O3溶液滴定测定锥形瓶中生成I2的量。(已知:I2+2S2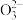 = 2
= 2 + S4
+ S4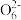 ),共用去20.00 mL Na2S2O3溶液。
),共用去20.00 mL Na2S2O3溶液。
计算可得自来水水样中ClO2的含量为_______ mg/L(精确到0.01)。

(1)试剂Y的名称为
(2)反应结束后需再通入一定量的CO2,其目的是:
(3)装置C中生成NaClO2的离子方程式为:
(4)设计实验证明NaClO2溶液具有氧化性:
(5)某同学欲测定经ClO2消毒过的自来水中ClO2残留量,他进行了如下实验:
Ⅰ在锥形瓶中加入足量的碘化钾,用50 mL蒸馏水溶解后,再加入3 mL稀硫酸;
Ⅱ再向该锥形瓶中加入20.00 mL自来水;
Ⅲ用0. 0001 mol·L-1 Na2S2O3溶液滴定测定锥形瓶中生成I2的量。(已知:I2+2S2
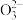 = 2
= 2 + S4
+ S4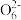 ),共用去20.00 mL Na2S2O3溶液。
),共用去20.00 mL Na2S2O3溶液。计算可得自来水水样中ClO2的含量为
您最近一年使用:0次
2 . “84消毒液”的主要成分是 ,某兴趣小组探究“84消毒液”的性质,设计了以下实验。
,某兴趣小组探究“84消毒液”的性质,设计了以下实验。

下列有关说法错误的是
 ,某兴趣小组探究“84消毒液”的性质,设计了以下实验。
,某兴趣小组探究“84消毒液”的性质,设计了以下实验。
下列有关说法错误的是
| A.试管甲中溶液变蓝,短时间内无明显现象,说明“84消毒液”是碱溶液 |
B.试管乙中溶液先变蓝,通入 后,快速褪色,说明 后,快速褪色,说明 溶液能与酸反应 溶液能与酸反应 |
C.对比试管乙的实验,将 换成稀硫酸,也可达到快速褪色的效果 换成稀硫酸,也可达到快速褪色的效果 |
D.试管丙中溶液变蓝,说明 具有氧化性 具有氧化性 |
您最近一年使用:0次
3 . 用下图所示实验(部分装置)收集氯气并验证氯气的性质:
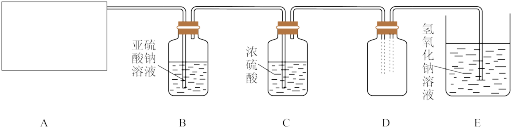
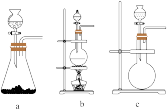
(1)A为Cl2的发生装置。实验室通常制取氯气的化学方程式为_______ ,且与之对应的A装置是_______ (从下面a、b、c序号中选择回答)。
(2)利用D中的广口瓶收集氯气,试在装置图中完善D装置(将虚线表示的一根或两根导管改为实线,也可都不改)_______ (用文字回答)
(3)写出装置E中反应的离子方程式_______
(4)利用D中收集的氯气进行铁与氯气的反应实验:用坩埚钳夹持一束细铁丝,_______ ,然后伸入盛有氯气的集气瓶中。
(5)通入氯气一段时间后,洗气瓶B溶液中有一部分SO 氧化成SO
氧化成SO ,反应的离子方程式为
,反应的离子方程式为_______ 。设计实验检验洗气瓶B溶液中最终有Cl- 和SO 存在,将选择的试剂的序号填写在下表空格中
存在,将选择的试剂的序号填写在下表空格中
①稀盐酸 ②稀硝酸(有强氧化性) ③BaCl2溶液 Ba(NO3)2溶液 ⑤AgNO3溶液 ⑥澄清石灰水
若上述实验需要100mL、2mol/L的盐酸溶液,配制时应用量筒量取36.5%、密度1.19g/mL的浓盐酸_______ mL。

(1)A为Cl2的发生装置。实验室通常制取氯气的化学方程式为

(2)利用D中的广口瓶收集氯气,试在装置图中完善D装置(将虚线表示的一根或两根导管改为实线,也可都不改)
(3)写出装置E中反应的离子方程式
(4)利用D中收集的氯气进行铁与氯气的反应实验:用坩埚钳夹持一束细铁丝,
(5)通入氯气一段时间后,洗气瓶B溶液中有一部分SO
 氧化成SO
氧化成SO ,反应的离子方程式为
,反应的离子方程式为 存在,将选择的试剂的序号填写在下表空格中
存在,将选择的试剂的序号填写在下表空格中①稀盐酸 ②稀硝酸(有强氧化性) ③BaCl2溶液 Ba(NO3)2溶液 ⑤AgNO3溶液 ⑥澄清石灰水
| 实 验 步 骤 | 预 期 现 象 和 结 论 |
| 步骤1:取适量洗气瓶B中溶液于试管Ⅰ中,滴加 | 若产生的白色沉淀,则洗气瓶B溶液中存在SO 。 。 |
| 步骤2:另取适量洗气瓶B中溶液于试管Ⅱ中,滴加过量Ba(NO3)2溶液振荡,静置。 | 产生白色沉淀。 |
| 步骤3:取步骤2后试管Ⅱ中的上层清液于试管Ⅲ中,滴加 | 若产生白色沉淀,则洗气瓶B溶液中存在Cl- |
您最近一年使用:0次
名校
解题方法
4 . 如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略),回答下列问题:

已知: 、
、 、
、 在苯中的溶解度大于在水中的溶解度。
在苯中的溶解度大于在水中的溶解度。 溶解在苯中为紫红色。
溶解在苯中为紫红色。
(1)用二氧化锰和浓盐酸制备氯气的离子方程式为_______ ,装置B中饱和食盐水的作用是_______ ,同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象_______ 。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处最好依次放入_______ (填序号,不能重复使用)。
①干燥的有色布条 ②湿润的有色布条 ③碱石灰 ④无水氯化钙 ⑤浓硫酸
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性,反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是E中溶液分为两层,上层(苯层)为紫红色,下层为无色,该现象_______ (填“能”或“不能”)说明溴单质的氧化性强于碘。
(4)装置F中用足量的NaOH溶液吸收余氯气,反应的离子方程式为_______ 。
(5)如果将过量二氧化锰与20mL 的浓盐酸混合加热,充分反应后生成的氯气
的浓盐酸混合加热,充分反应后生成的氯气_______ 0.06mol(填“大于”、“小于”或“等于”)。
(6)用下列方法制取氯气:
①
②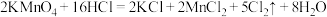
③
若要制得相同质量的氯气,上述三种方法中所转移的电子数目之比是_______ 。

已知:
 、
、 、
、 在苯中的溶解度大于在水中的溶解度。
在苯中的溶解度大于在水中的溶解度。 溶解在苯中为紫红色。
溶解在苯中为紫红色。(1)用二氧化锰和浓盐酸制备氯气的离子方程式为
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处最好依次放入
①干燥的有色布条 ②湿润的有色布条 ③碱石灰 ④无水氯化钙 ⑤浓硫酸
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性,反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是E中溶液分为两层,上层(苯层)为紫红色,下层为无色,该现象
(4)装置F中用足量的NaOH溶液吸收余氯气,反应的离子方程式为
(5)如果将过量二氧化锰与20mL
 的浓盐酸混合加热,充分反应后生成的氯气
的浓盐酸混合加热,充分反应后生成的氯气(6)用下列方法制取氯气:
①

②
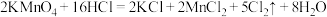
③

若要制得相同质量的氯气,上述三种方法中所转移的电子数目之比是
您最近一年使用:0次
5 . 一位同学设计了一套用浓盐酸和高锰酸钾固体制取少量氯气并能比较氯气与碘单质氧化性强弱的微型装置,如图所示。
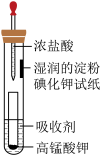
(1)下列溶液中,能吸收氯气的是______。
(2)能说明氯气的氧化性强于碘单质的实验现象是__________ 。
(3)请用原子结构的知识解释氯气的氧化性强于碘单质的原因:__________ 。

(1)下列溶液中,能吸收氯气的是______。
| A.饱和食盐水 | B.饱和Na2SO3溶液 |
| C.饱和NaOH溶液 | D.浓硫酸 |
(3)请用原子结构的知识解释氯气的氧化性强于碘单质的原因:
您最近一年使用:0次
2022-11-26更新
|
518次组卷
|
2卷引用:2019版鲁科化学必修第二册第1章本章自我评价课后习题
6 . 某校化学兴趣小组为验证 的性质,设计如图所示装置进行实验。装置III中夹持装置已略去,其中a为干燥的红色纸条,b为湿润的红色纸条。
的性质,设计如图所示装置进行实验。装置III中夹持装置已略去,其中a为干燥的红色纸条,b为湿润的红色纸条。
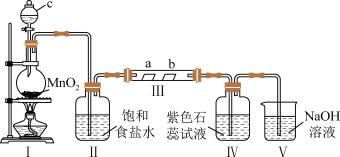
(1)装置I中仪器c的名称是_______ ,实验室用 和浓盐酸制备
和浓盐酸制备 的化学方程式为
的化学方程式为_______ 。
(2)装置II的作用是_______ 。
(3)若实验中产生的 足量,装置IV中的实验现象
足量,装置IV中的实验现象_______ 。
(4)写出装置V中反应的离子方程式_______ 。
(5)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象,为了达到这一实验目的,你认为还需在图中装置II与III之间添加图中的_______ 装置(填序号)。
① ②
② ③
③ ④
④
(6)可用 和
和 制备的漂粉精
制备的漂粉精
①漂白精的有效成分是_______ 。
②漂粉精常用于游泳池的消毒,起消毒作用的是HClO。漂粉精在水中释放HClO的途径主要是: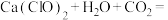 ______+______(把反应补充完整)。
______+______(把反应补充完整)。_______
③池水的酸碱性对漂粉精的消毒效果影响明显。
a.若池水碱性过强,杀毒作用会_______ (填“增强”或“减弱”)。
b.若池水酸性过强,会刺激眼睛和皮肤。有时加入 、
、 以降低酸性,起到降低酸性作用的离子分别是
以降低酸性,起到降低酸性作用的离子分别是_______ (填离子符号)。
④某届奥运会期间,发生了室外游泳池水变绿的事件,成为当时的一大新闻。有关负责人说,池水变绿是藻类生长造成的。该游泳池每隔一段时间就要投放含氯消毒剂,当再次投放时,误投了过氧化氢( )消毒剂。消毒剂为什么不起作用了?请分析原因:
)消毒剂。消毒剂为什么不起作用了?请分析原因:_______ 。
 的性质,设计如图所示装置进行实验。装置III中夹持装置已略去,其中a为干燥的红色纸条,b为湿润的红色纸条。
的性质,设计如图所示装置进行实验。装置III中夹持装置已略去,其中a为干燥的红色纸条,b为湿润的红色纸条。
(1)装置I中仪器c的名称是
 和浓盐酸制备
和浓盐酸制备 的化学方程式为
的化学方程式为(2)装置II的作用是
(3)若实验中产生的
 足量,装置IV中的实验现象
足量,装置IV中的实验现象(4)写出装置V中反应的离子方程式
(5)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象,为了达到这一实验目的,你认为还需在图中装置II与III之间添加图中的
①
 ②
② ③
③ ④
④
(6)可用
 和
和 制备的漂粉精
制备的漂粉精①漂白精的有效成分是
②漂粉精常用于游泳池的消毒,起消毒作用的是HClO。漂粉精在水中释放HClO的途径主要是:
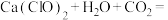 ______+______(把反应补充完整)。
______+______(把反应补充完整)。③池水的酸碱性对漂粉精的消毒效果影响明显。
a.若池水碱性过强,杀毒作用会
b.若池水酸性过强,会刺激眼睛和皮肤。有时加入
 、
、 以降低酸性,起到降低酸性作用的离子分别是
以降低酸性,起到降低酸性作用的离子分别是④某届奥运会期间,发生了室外游泳池水变绿的事件,成为当时的一大新闻。有关负责人说,池水变绿是藻类生长造成的。该游泳池每隔一段时间就要投放含氯消毒剂,当再次投放时,误投了过氧化氢(
 )消毒剂。消毒剂为什么不起作用了?请分析原因:
)消毒剂。消毒剂为什么不起作用了?请分析原因:
您最近一年使用:0次
2010·北京东城·一模
名校
7 . 氯气是一种重要的化工原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是_________ 。
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
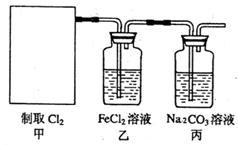
①在该实验中,甲部分的装置是_______ (填字母);
②乙装置中FeCl2溶液与Cl2反应的离子方程式是_______ 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是_________ ;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、清毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是_____________ ;
④该实验存在明显的缺陷,改进的方法是______________ 。
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1mol·L-1Na2S2O3溶液:2Na2S2O3+I2=Na2S4O6+2NaI,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为____________ 。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4
 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
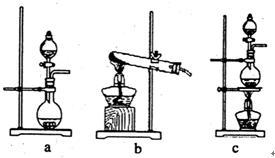
①在该实验中,甲部分的装置是

②乙装置中FeCl2溶液与Cl2反应的离子方程式是
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、清毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是
④该实验存在明显的缺陷,改进的方法是
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1mol·L-1Na2S2O3溶液:2Na2S2O3+I2=Na2S4O6+2NaI,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为
您最近一年使用:0次
8 . 如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,该反应的化学方程式为____ ;装置B中饱和食盐水的作用是_____ 。
(2)为了验证氯气是否具有漂白性。装置C中I、II、III依次放入_____ 可达到实验目的(填序号)。
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。
当向装置D中缓缓通入少量氯气时,发生反应的离子方程式为___________ ;然后打开活塞,将装置D中少量溶液放入装置E中,发生反应的化学方程式为___________ 。
(4)装置F中用足量的NaOH溶液吸收多余氯气,写出相应的离子方程式:___________ 。

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,该反应的化学方程式为
(2)为了验证氯气是否具有漂白性。装置C中I、II、III依次放入
| 序号 | a | b | c | d |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
当向装置D中缓缓通入少量氯气时,发生反应的离子方程式为
(4)装置F中用足量的NaOH溶液吸收多余氯气,写出相应的离子方程式:
您最近一年使用:0次
9 . 如图是实验室制氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。

(1)制备氯气选用的药品为二氧化锰和浓盐酸,则相关的化学反应方程式为:_______ ,在该反应中,还原产物是_______ 。
(2)装置B中饱和食盐水的作用是_______ 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ应依次放入_______ 。(填字母)
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为橙黄色,打开D装置中活塞,将D中少量溶液加入装置E中,振荡。观察到的现象是_______ 。经认真考虑,有同学提出该实验方案仍有不足,请说明其中原因_______ 。
(5)装置F中用足量NaOH溶液吸收剩余的氯气,试写出相应的离子方程式:_______ 。

(1)制备氯气选用的药品为二氧化锰和浓盐酸,则相关的化学反应方程式为:
(2)装置B中饱和食盐水的作用是
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ应依次放入
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
| Ⅱ | 碱石灰 | 无水CaCl2 | 浓硫酸 | 无水CaCl2 |
| Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
(5)装置F中用足量NaOH溶液吸收剩余的氯气,试写出相应的离子方程式:
您最近一年使用:0次
20-21高一上·全国·课时练习
解题方法
10 . 一同学设计如下装置来制取氯气并进行一些实验:

(1)现有湿有色布条和干有色布条,用图1检验次氯酸的漂白性,则可以将干有色布条放入______ 中,将湿有色布条放入_______ 中;在a中应盛有_____________ ;b所起的作用是______________ ;e所起的作用是_________ 。
(2)当上述实验装置中的c、d、e改为图2所示的情况来检验Cl2的氧化性,其中c中盛有NaBr溶液,d中盛有KI—淀粉溶液,缓缓通入Cl2,d中看到的现象是_____________ 。

(1)现有湿有色布条和干有色布条,用图1检验次氯酸的漂白性,则可以将干有色布条放入
(2)当上述实验装置中的c、d、e改为图2所示的情况来检验Cl2的氧化性,其中c中盛有NaBr溶液,d中盛有KI—淀粉溶液,缓缓通入Cl2,d中看到的现象是
您最近一年使用:0次



