1 . 工业上将 Cl 2 通入冷的 NaOH 溶液中制得漂白液 (主要成分是 NaClO ),室温下将Cl 2缓缓通入 NaOH 溶液中,得到 ClO -、 ClO 3 -的物质的量与
反应时间的关系如图所示,下列有关说法正确的是
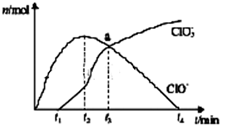
反应时间的关系如图所示,下列有关说法正确的是

| A.HClO 具有强氧化性,而 NaClO 没有氧化性 |
| B.向漂白液中加入足量浓盐酸可增强漂白效果 |
| C.无法求出 a 点时的溶液中, c ( Na+ )和 c (Cl- )的比值 |
| D.t 2到 t 4 , n ( ClO - )下降的原因可能是: 3ClO - ="=" 2Cl-+ClO 3- |
您最近半年使用:0次
名校
2 . 氯酸钾是一种强氧化剂,在不同条件下KClO3将KI氧化为I2或KIO3。某实验小组在实验室中对KClO3和KI的反应进行了探究。回答下列问题:
实验一 制取氯酸钾

(1)A中反应的化学方程式为_______ 。实验开始时,首先进行的实验步骤是________ 。
(2)A和B装置之间缺少除去氯气中氯化氢的装置,是否会对实验结果产生不利影响,其理由是__ (填“是”或“否”,若选择“是”请说明理由,若选择“否”则不需说明理由)
实验二 氯酸钾与碘化钾反应的研究
(3)该小组研究条件对反应产物的影响,系列a实验的记录表如下(实验在室温下进行):
①系列a实验的实验目的是__ .②设计1号试管实验的作用是__ .
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为______ .
实验一 制取氯酸钾

(1)A中反应的化学方程式为
(2)A和B装置之间缺少除去氯气中氯化氢的装置,是否会对实验结果产生不利影响,其理由是
实验二 氯酸钾与碘化钾反应的研究
(3)该小组研究条件对反应产物的影响,系列a实验的记录表如下(实验在室温下进行):
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol•L﹣1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L﹣1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
| 实验现象 |
①系列a实验的实验目的是
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为
您最近半年使用:0次
14-15高一上·山东潍坊·期中
名校
解题方法
3 . 氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究Cl2 的漂白性。
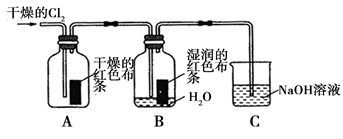
①通入Cl2 后,观察到的现象是_______ 根据现象可得出的结论是_____ 。
②集气瓶B发生反应的离子方程式是_____ 。
③C装置的作用是___________ ,若有2.24L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子为_______ mol。
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。
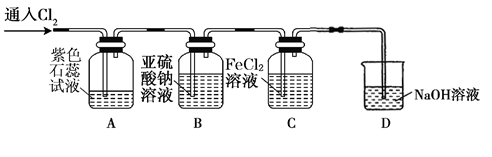
①实验开始后,观察装置A 中的现象是_____ 。
②装置C中发生反应的离子方程式是______ 。
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2 时装置B中发生 反应的离子方程式是__________ 。
(1)兴趣小组同学按下图装置进行实验,探究Cl2 的漂白性。

①通入Cl2 后,观察到的现象是
②集气瓶B发生反应的离子方程式是
③C装置的作用是
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。

①实验开始后,观察装置A 中的现象是
②装置C中发生反应的离子方程式是
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2 时装置B中发生 反应的离子方程式是
您最近半年使用:0次
2016-12-09更新
|
718次组卷
|
4卷引用:2014-2015学年山东省潍坊三县市高一上学期联考化学试卷
(已下线)2014-2015学年山东省潍坊三县市高一上学期联考化学试卷2015-2016学年青海省平安县第一高中高一入学化学试卷辽宁省六校协作体2017-2018学年高一下学期开学考试化学试题四川省广安友谊中学2018-2019学年高一上学期期末模拟化学试题
4 . 某小组同学利用一定浓度的HCl溶液和 制备
制备 ,并探究其相关的性质。
,并探究其相关的性质。
【探究一】制备氯气
(1)写出装置A中发生反应的化学方程式______ 。
(2)A装置中仪器a的名称是______ ;装置B作用是______ 。
(3)装置D用于收集 ,气体应从集气瓶
,气体应从集气瓶______ (选“c”或“d”)口进入。

【探究二】利用氯气和相应的碱溶液反应制取NaClO和 ,并探究氯水的性质。
,并探究氯水的性质。
制备装置如图1所示(部分加持仪器略去),其中③中试管加有紫色石蕊试液。
【信息提示】氯气与碱反应,温度较高时生成 ,温度较低时生成
,温度较低时生成 。
。
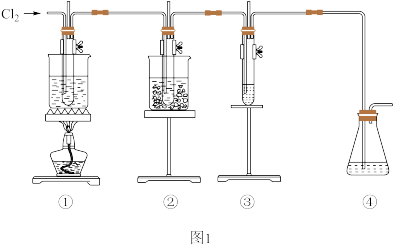
(4)①试管中的溶液是______ 。
(5)写出②中发生反应的化学方程式______ 。
(6)实验中可观察到③的试管中现象是______ 。
(7)验证氯水中HClO光照分解的产物。如图2所示将新制氯水置于三颈瓶内,pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中,用强光照射氯水,进行实验并采集数据,获得变化曲线如图3所示。
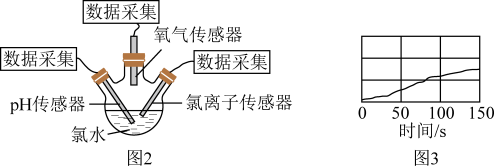
若能够证明氯水中HClO在光照下发生了分解反应,则图3中纵坐标可以表示的物理量是______ (填字母)。(注:酸性溶液中, 越大,pH越小,溶液酸性越强。)
越大,pH越小,溶液酸性越强。)
a.氧气的体积分数;b.氢离子的浓度;c.氯离子的浓度;d.氯水的pH;e.溶液的颜色
 制备
制备 ,并探究其相关的性质。
,并探究其相关的性质。【探究一】制备氯气

(1)写出装置A中发生反应的化学方程式
(2)A装置中仪器a的名称是
(3)装置D用于收集
 ,气体应从集气瓶
,气体应从集气瓶
【探究二】利用氯气和相应的碱溶液反应制取NaClO和
 ,并探究氯水的性质。
,并探究氯水的性质。制备装置如图1所示(部分加持仪器略去),其中③中试管加有紫色石蕊试液。
【信息提示】氯气与碱反应,温度较高时生成
 ,温度较低时生成
,温度较低时生成 。
。
(4)①试管中的溶液是
(5)写出②中发生反应的化学方程式
(6)实验中可观察到③的试管中现象是
(7)验证氯水中HClO光照分解的产物。如图2所示将新制氯水置于三颈瓶内,pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中,用强光照射氯水,进行实验并采集数据,获得变化曲线如图3所示。

若能够证明氯水中HClO在光照下发生了分解反应,则图3中纵坐标可以表示的物理量是
 越大,pH越小,溶液酸性越强。)
越大,pH越小,溶液酸性越强。)a.氧气的体积分数;b.氢离子的浓度;c.氯离子的浓度;d.氯水的pH;e.溶液的颜色
您最近半年使用:0次
5 . 某小组同学在实验室制备、收集氯气,并进行氯水中相关物质的性质探究,回答下列问题。
(1)制备 。装置Ⅰ中发生如下反应:
。装置Ⅰ中发生如下反应: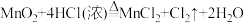 。盛放浓盐酸的仪器名称是
。盛放浓盐酸的仪器名称是_______ 。
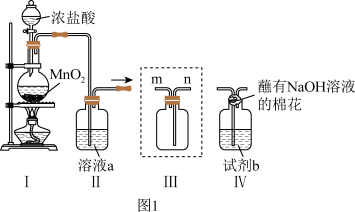
(2)装置Ⅱ中溶液a为饱和食盐水,作用为_______ 。
(3)收集 。装置Ⅲ中气体应该从集气瓶的
。装置Ⅲ中气体应该从集气瓶的_______ (选“m”或“n”)口进入。
(4)氯水相关物质的性质探究。
①若装置Ⅳ中试剂b为 ,制得氯水。氯水呈黄绿色是由于其中含有
,制得氯水。氯水呈黄绿色是由于其中含有_______ ; 与
与 反应的化学方程式为
反应的化学方程式为_______ 。
②若装置Ⅳ中试剂b为 ,可制得
,可制得 的
的 溶液(
溶液( 可溶于
可溶于 ,且不与
,且不与 反应)。取稀盐酸、新制氯水、
反应)。取稀盐酸、新制氯水、 的
的 溶液,分别滴在三张红色纸条上,可观察到
溶液,分别滴在三张红色纸条上,可观察到_______ 现象,证明氯水中HClO具有漂白性作用。
③若要模拟工业制备漂白粉,装置Ⅳ中试剂b为_______ ,制备漂白粉的化学方程式为_______ 。
④验证氯水中HClO光照分解的产物。将装置Ⅳ广口瓶中的氯水转移至三颈瓶内,将pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中(如图2),用强光照射氯水,进行实验并采集数据,获得相关变化曲线。

若能够证明氯水中HClO在光照下发生了分解反应,则图3中纵坐标可以表示的物理量是_______ (填字母)。(注:酸性溶液中, 越大,pH越小,溶液酸性越强)。据此数据,可分析得到HClO在光照下发生的化学反应方程式为
越大,pH越小,溶液酸性越强)。据此数据,可分析得到HClO在光照下发生的化学反应方程式为_______ 。
a.氯水的pH b.氢离子的浓度 c.氯离子的浓度 d.氧气的体积分数 e.溶液的颜色
(1)制备
 。装置Ⅰ中发生如下反应:
。装置Ⅰ中发生如下反应: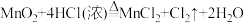 。盛放浓盐酸的仪器名称是
。盛放浓盐酸的仪器名称是
(2)装置Ⅱ中溶液a为饱和食盐水,作用为
(3)收集
 。装置Ⅲ中气体应该从集气瓶的
。装置Ⅲ中气体应该从集气瓶的(4)氯水相关物质的性质探究。
①若装置Ⅳ中试剂b为
 ,制得氯水。氯水呈黄绿色是由于其中含有
,制得氯水。氯水呈黄绿色是由于其中含有 与
与 反应的化学方程式为
反应的化学方程式为②若装置Ⅳ中试剂b为
 ,可制得
,可制得 的
的 溶液(
溶液( 可溶于
可溶于 ,且不与
,且不与 反应)。取稀盐酸、新制氯水、
反应)。取稀盐酸、新制氯水、 的
的 溶液,分别滴在三张红色纸条上,可观察到
溶液,分别滴在三张红色纸条上,可观察到③若要模拟工业制备漂白粉,装置Ⅳ中试剂b为
④验证氯水中HClO光照分解的产物。将装置Ⅳ广口瓶中的氯水转移至三颈瓶内,将pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中(如图2),用强光照射氯水,进行实验并采集数据,获得相关变化曲线。

若能够证明氯水中HClO在光照下发生了分解反应,则图3中纵坐标可以表示的物理量是
 越大,pH越小,溶液酸性越强)。据此数据,可分析得到HClO在光照下发生的化学反应方程式为
越大,pH越小,溶液酸性越强)。据此数据,可分析得到HClO在光照下发生的化学反应方程式为a.氯水的pH b.氢离子的浓度 c.氯离子的浓度 d.氧气的体积分数 e.溶液的颜色
您最近半年使用:0次
2022-10-08更新
|
321次组卷
|
2卷引用:福建省龙岩第一中学2022-2023学年高一上学期第一次月考化学试题
解题方法
6 . 高铁酸盐是优良的多功能水处理剂。 为紫色固体,可溶于水,微溶于KOH浓溶液,难溶于有机物;在
为紫色固体,可溶于水,微溶于KOH浓溶液,难溶于有机物;在 的强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出
的强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出 。某实验小组制备高铁酸钾
。某实验小组制备高铁酸钾 的装置如图所示。
的装置如图所示。
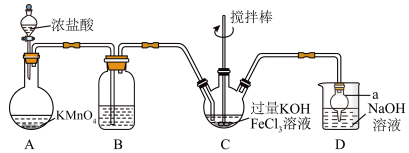
回答下列问题:
(1)仪器a的名称为_______ 。
(2)装置A中发生反应的离子方程式为_______ 。
(3)装置B中盛放的试剂为饱和氯化钠溶液,主要作用是除去挥发出来的氯化氢气体,还有一个作用是_______ 。
(4)装置C中生成 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为_______ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
(5)装置D中尾气处理时,除了生成 、
、 外,还有可能生成
外,还有可能生成_______ (填化学式)。
(6)往装有一定量的 晶体的试管中滴入稀硫酸,振荡。
晶体的试管中滴入稀硫酸,振荡。
①写出其发生反应的离子方程式:_______ 。
②检验生成气体为氧气的方法是_______ 。
 为紫色固体,可溶于水,微溶于KOH浓溶液,难溶于有机物;在
为紫色固体,可溶于水,微溶于KOH浓溶液,难溶于有机物;在 的强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出
的强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出 。某实验小组制备高铁酸钾
。某实验小组制备高铁酸钾 的装置如图所示。
的装置如图所示。
回答下列问题:
(1)仪器a的名称为
(2)装置A中发生反应的离子方程式为
(3)装置B中盛放的试剂为饱和氯化钠溶液,主要作用是除去挥发出来的氯化氢气体,还有一个作用是
(4)装置C中生成
 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为(5)装置D中尾气处理时,除了生成
 、
、 外,还有可能生成
外,还有可能生成(6)往装有一定量的
 晶体的试管中滴入稀硫酸,振荡。
晶体的试管中滴入稀硫酸,振荡。①写出其发生反应的离子方程式:
②检验生成气体为氧气的方法是
您最近半年使用:0次
2022-05-01更新
|
225次组卷
|
3卷引用:云南省名校联盟2021-2022学年高二下学期期中考试化学(B1)试题
解题方法
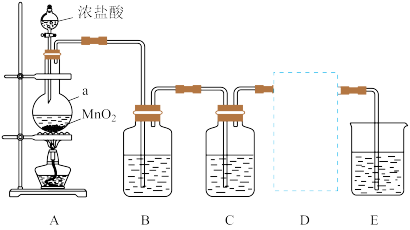
7 . 在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:
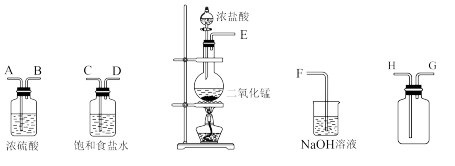
(1)连接上述仪器的正确顺序是(填各接口处的字母):E接___________ ,___________ 接___________ ,___________ 接___________ ,___________ 接___________ 。
(2)写出二氧化锰跟浓盐酸反应的化学方程式,并用双线桥表示电子转移的方向和数目___________ 。
(3)写出氢氧化钠溶液中反应的离子方程式___________ 。
(4)可用氯气制消毒液,某“84”消毒液的说明书有以下信息(如表所示):
①消毒液不能与洁厕灵(主要成分是盐酸)混用,是因为___________ (用离子方程式表示)。
②酸性硫酸亚铁溶液与“84”消毒液混合时反应的离子方程式是___________ 。
(5)氯氧化法处理含CN-的废水过程:首先用液氯在KOH溶液中将KCN氧化成KOCN(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质,请写出KCN被氧化成KOCN的化学方程式___________ 。

(1)连接上述仪器的正确顺序是(填各接口处的字母):E接
(2)写出二氧化锰跟浓盐酸反应的化学方程式,并用双线桥表示电子转移的方向和数目
(3)写出氢氧化钠溶液中反应的离子方程式
(4)可用氯气制消毒液,某“84”消毒液的说明书有以下信息(如表所示):
| 药品名称 | 84消毒液 |
| 主要成分 | NaClO,有效氯含量50.0~60.0g/L |
| 注意事项 | 不可与其他洗涤剂或消毒液混合使用,密封保存 |
| 用法用量 | 稀释后浸泡或洗刷:白色衣物,浴缸等1:200水溶液,餐饮具,瓜果等1:100水溶液 |
②酸性硫酸亚铁溶液与“84”消毒液混合时反应的离子方程式是
(5)氯氧化法处理含CN-的废水过程:首先用液氯在KOH溶液中将KCN氧化成KOCN(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质,请写出KCN被氧化成KOCN的化学方程式
您最近半年使用:0次
8 . 用滴管把新制的氯水逐滴加到含有酚酞的氢氧化钠溶液中,当加到最后一滴时,溶液的红色突然消失.对产生实验现象的原因有两种推测:①是氯水中的次氯酸的漂白性使它由红色变成无色;②是氯水的酸性(H+)使它由红色变成无色.假设其中一种是正确的。
请你设计一个实验,由实验现象对以上的推测作出判断.
(1)要使用的实验用品:____________________ ;
(2)要进行的实验操作:_____________________ ;
(3)实验现象和结论:_______________________ 。
请你设计一个实验,由实验现象对以上的推测作出判断.
(1)要使用的实验用品:
(2)要进行的实验操作:
(3)实验现象和结论:
您最近半年使用:0次
2016-12-09更新
|
641次组卷
|
4卷引用:2012年人教版高中化学必修一4.2 富集在海水中的元素-氯练习卷
(已下线)2012年人教版高中化学必修一4.2 富集在海水中的元素-氯练习卷(已下线)【走进新高考】(人教版必修一)4.2.1富集在海水中的元素——氯 (氯气) 同步练习01人教版高中化学必修1第四章《非金属及其化合物》测试卷4人教版高中化学必修1第四章《非金属及其化合物》测试卷3
名校
解题方法
9 . 按要求回答下列问题:
(1)加入双氧水能提高软锰矿(主要成分是MnO2)的浸出率,锰转化成Mn2+。写出酸性条件下双氧水提高软锰矿浸出率的离子方程式:_______ 。
(2)电镀污泥中的Cr2O3与加入的Na2CO3在空气中焙烧,Cr2O3被氧化为Na2CrO4,还有CO2逸出,写出该反应的化学方程式:_______ 。
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是:_______ 。
(4)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O也可制H2,其物质转化如图1所示。

①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为:_______ 。
②CuFe2O4可用电化学方法得到,其原理如图2所示,则阳极的电极反应式为:_______ 。
(1)加入双氧水能提高软锰矿(主要成分是MnO2)的浸出率,锰转化成Mn2+。写出酸性条件下双氧水提高软锰矿浸出率的离子方程式:
(2)电镀污泥中的Cr2O3与加入的Na2CO3在空气中焙烧,Cr2O3被氧化为Na2CrO4,还有CO2逸出,写出该反应的化学方程式:
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是:
(4)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O也可制H2,其物质转化如图1所示。

①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为:
②CuFe2O4可用电化学方法得到,其原理如图2所示,则阳极的电极反应式为:
您最近半年使用:0次
解题方法
10 . (1)加入双氧水能提高软锰矿(主要成分是MnO2)的浸出率,锰转化成Mn2+。写出酸性条件下双氧水提高软锰矿浸出率的离子方程式:_________ 。
(2)碘与氢氧化钠反应的生成物中含有IO3-,写出反应过程的离子方程式:___ 。
(3) 电镀污泥中的Cr2O3与加入的Na2CO3在空气中焙烧,Cr2O3被氧化为Na2CrO4,还有CO2逸出,写出该反应的化学方程式:_____________ 。
(4)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是_______ 。
(5) 用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O也可制H2,其物质转化如图1所示。
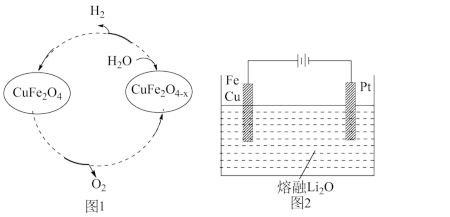
①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为_________ 。
②CuFe2O4可用电化学方法得到,其原理如图2所示,则阳极的电极反应式为_________ 。
(2)碘与氢氧化钠反应的生成物中含有IO3-,写出反应过程的离子方程式:
(3) 电镀污泥中的Cr2O3与加入的Na2CO3在空气中焙烧,Cr2O3被氧化为Na2CrO4,还有CO2逸出,写出该反应的化学方程式:
(4)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是
(5) 用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O也可制H2,其物质转化如图1所示。

①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为
②CuFe2O4可用电化学方法得到,其原理如图2所示,则阳极的电极反应式为
您最近半年使用:0次



