2021高三·全国·专题练习
1 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为_______________________________ 。
(2)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为____________ mol;产生“气泡”的化学方程式为__________________ 。
(3)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是_____________________ (用离子方程式表示)。工业上是将氯气通入30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1 000 kg该溶液需消耗氯气的质量为________ kg(保留整数)。
(1)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
(2)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为
(3)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次
名校
2 . 常温下将Cl2缓慢通入水中至饱和,然后改向其中滴加浓NaOH溶液至恰好完全反应。上述整个实验过程中溶液的pH变化曲线如图所示(不考虑次氯酸的分解以及溶液体积的变化)。
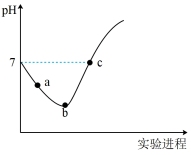
①请对图中pH的整个变化趋势作出解释(用离子方程式表示)________ 。
②写出b点对应溶液中的电荷守恒式___________ 。并且比较c(HClO) :a点___________ b点;c(Cl–):b点___________ c点(填>、<或=)
③Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为___________ 。
④ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1mol ClO2消耗NaClO2的量为______ mol; 产生“气泡”的化学方程式为____ 。
⑤“84消毒液“的有效成分为NaClO,不可与酸性清洁剂混用的原因是___________ (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为 ___________ kg(保留整数)。

①请对图中pH的整个变化趋势作出解释(用离子方程式表示)
②写出b点对应溶液中的电荷守恒式
③Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
④ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1mol ClO2消耗NaClO2的量为
⑤“84消毒液“的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次
2021-01-03更新
|
186次组卷
|
3卷引用:上海市七宝中学2021届高三上学期期中考试化学试题
解题方法
3 . 氯及其化合物在生产生活中有重要的作用。已知某品牌的84消毒液和洁厕灵的部分标签如图所示:
回答下列问题:
(1)工业上通常将氯气通入氢氧化钠溶液中制备84消毒液,请写出该反应的离子方程式___________ 。
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。
①巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是 与
与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:
促进藻类快速生长。该反应说明氧化性:
___________  (填“>”或“<”)。当有0.1
(填“>”或“<”)。当有0.1
 生成时,反应中转移电子为
生成时,反应中转移电子为___________  。
。
②王女士在清洁马桶时,在倒入上述洁厕灵后将上述84消毒液也倒入其中,随后突然晕倒,原因是该过程产生了有毒的氯气,该过程发生反应的离子方程式为___________ 。
| ××牌洁厕灵 规格:1L 有效成分:盐酸,表面活性剂,香精 | ××牌84消毒液 规格:500  有效成分:  (“有效氯”含量:5.5%~6.5%) |
回答下列问题:
(1)工业上通常将氯气通入氢氧化钠溶液中制备84消毒液,请写出该反应的离子方程式
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。
①巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是
 与
与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:
促进藻类快速生长。该反应说明氧化性:
 (填“>”或“<”)。当有0.1
(填“>”或“<”)。当有0.1
 生成时,反应中转移电子为
生成时,反应中转移电子为 。
。②王女士在清洁马桶时,在倒入上述洁厕灵后将上述84消毒液也倒入其中,随后突然晕倒,原因是该过程产生了有毒的氯气,该过程发生反应的离子方程式为
您最近一年使用:0次
4 . 碱式次氯酸镁[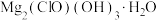 ]微溶于水,是一种有开发价值的无机抗菌剂。请回答:
]微溶于水,是一种有开发价值的无机抗菌剂。请回答:
(1)工业上利用 、NaOH、
、NaOH、 为原料合成碱式次氯酸镁,写出发生反应的化学方程式
为原料合成碱式次氯酸镁,写出发生反应的化学方程式_______ 。
(2)碱式次氯酸镁也可通过电解法制备,在无隔膜状况下以铁为阴极、 为阳极电解氯化镁溶液制得。采取无隔膜工艺的目的是
为阳极电解氯化镁溶液制得。采取无隔膜工艺的目的是_______ ,阴极电极反应方程式为_______ 。
(3)碱式次氯酸镁经醋酸酸化后杀菌功能增强,原因是_______ (用离子方程式表示)。
(4)碱式次氯酸镁( )的品质可通过其中的有效氯含量来衡量,测定有效氯的方法是:称取一定质量的样品,加入适量乙酸和KI溶液溶解,再用
)的品质可通过其中的有效氯含量来衡量,测定有效氯的方法是:称取一定质量的样品,加入适量乙酸和KI溶液溶解,再用 标准溶液测定生成的
标准溶液测定生成的 ,将碘单质折算为
,将碘单质折算为 ,有效氯含量
,有效氯含量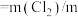 (样品)。则产品的理论有效氯含量为
(样品)。则产品的理论有效氯含量为_______ 。
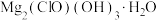 ]微溶于水,是一种有开发价值的无机抗菌剂。请回答:
]微溶于水,是一种有开发价值的无机抗菌剂。请回答:(1)工业上利用
 、NaOH、
、NaOH、 为原料合成碱式次氯酸镁,写出发生反应的化学方程式
为原料合成碱式次氯酸镁,写出发生反应的化学方程式(2)碱式次氯酸镁也可通过电解法制备,在无隔膜状况下以铁为阴极、
 为阳极电解氯化镁溶液制得。采取无隔膜工艺的目的是
为阳极电解氯化镁溶液制得。采取无隔膜工艺的目的是(3)碱式次氯酸镁经醋酸酸化后杀菌功能增强,原因是
(4)碱式次氯酸镁(
 )的品质可通过其中的有效氯含量来衡量,测定有效氯的方法是:称取一定质量的样品,加入适量乙酸和KI溶液溶解,再用
)的品质可通过其中的有效氯含量来衡量,测定有效氯的方法是:称取一定质量的样品,加入适量乙酸和KI溶液溶解,再用 标准溶液测定生成的
标准溶液测定生成的 ,将碘单质折算为
,将碘单质折算为 ,有效氯含量
,有效氯含量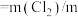 (样品)。则产品的理论有效氯含量为
(样品)。则产品的理论有效氯含量为
您最近一年使用:0次
解题方法
5 . 疫情防控期间的消毒工作含氯消毒剂功不可没,研究消毒剂的性质意义重大。回答下列问题:
(1)2016年巴西奥运会游泳池变绿是因为84消毒液与过氧化氢消毒剂混用,写出该反应的化学方程式_______ ,转移电子数为3NA时,理论上生成标况下气体体积是________ 。
(2) 、HClO和
、HClO和 三种微粒的物质的量分数随pH变化的关系如图所示。
三种微粒的物质的量分数随pH变化的关系如图所示。
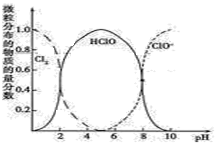
回答问题:
①使用84消毒液时为增强消毒效果常调节 ,原因是
,原因是___________ 。
②通常购买的84消毒液pH在12左右,此时主要成分是___________ (化学式),为增强消毒效果可向其中滴加___________ (填字母序号)。
A.可口可乐 B.稀 C.食醋 D.浓盐酸
C.食醋 D.浓盐酸
(3)实验室将 通入质量分数40%的NaOH溶液中来制备84消毒液。当NaOH消耗一半时转移电子数为NA,计算此时所得溶液中NaClO的质量分数为
通入质量分数40%的NaOH溶液中来制备84消毒液。当NaOH消耗一半时转移电子数为NA,计算此时所得溶液中NaClO的质量分数为___________ %。
(1)2016年巴西奥运会游泳池变绿是因为84消毒液与过氧化氢消毒剂混用,写出该反应的化学方程式
(2)
 、HClO和
、HClO和 三种微粒的物质的量分数随pH变化的关系如图所示。
三种微粒的物质的量分数随pH变化的关系如图所示。
回答问题:
①使用84消毒液时为增强消毒效果常调节
 ,原因是
,原因是②通常购买的84消毒液pH在12左右,此时主要成分是
A.可口可乐 B.稀
 C.食醋 D.浓盐酸
C.食醋 D.浓盐酸(3)实验室将
 通入质量分数40%的NaOH溶液中来制备84消毒液。当NaOH消耗一半时转移电子数为NA,计算此时所得溶液中NaClO的质量分数为
通入质量分数40%的NaOH溶液中来制备84消毒液。当NaOH消耗一半时转移电子数为NA,计算此时所得溶液中NaClO的质量分数为
您最近一年使用:0次
6 . 游泳池水中的氯气含量应该控制在0.5~1.0 mg·L-1之间。
(1)写出氯气溶于水的化学方程式:___________ 。溶于水后的哪种物质可杀菌消毒:___________ (写化学式)。
(2)如图显示一星期中每天19时游泳池水中的氯气含量,哪几天19时使用游泳池不安全?___________ 。
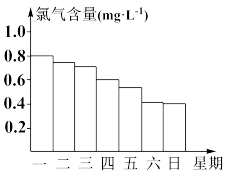
(3)你认为哪几天的天气炎热、阳光强烈?___________ ,说出一种理由___________ 。
(4)若把一片紫色的花瓣放入氯水中,可观察到的现象是___________ (花瓣所含色素性质与石蕊相似)。
(5)小型游泳池通常使用次氯酸钠溶液而非氯气给池水消毒,用化学方程式说明工业上如何生产次氯酸钠:___________ 。
(1)写出氯气溶于水的化学方程式:
(2)如图显示一星期中每天19时游泳池水中的氯气含量,哪几天19时使用游泳池不安全?

(3)你认为哪几天的天气炎热、阳光强烈?
(4)若把一片紫色的花瓣放入氯水中,可观察到的现象是
(5)小型游泳池通常使用次氯酸钠溶液而非氯气给池水消毒,用化学方程式说明工业上如何生产次氯酸钠:
您最近一年使用:0次
2021-10-26更新
|
67次组卷
|
2卷引用:福建省永安市第三中学高中校2021-2022学年高一上学期10月月考化学试题
名校
7 . “84消毒液”是一种以NaClO为有效成分的高效消毒剂,在新冠肺炎防治中被广泛用于宾馆、旅游、医院、家庭等的卫生消毒。
Ⅰ.如表为“84”消毒液说明书,请回答下列问题。
(1)常温下用烧碱溶液吸收Cl2制备“84”消毒液。写出该反应的离子方程式___ ,若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当混合液中Cl-和ClO 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为___ ,从氧化还原角度分析Cl2表现了___ 性。
(2)家庭用“84”消毒液用法强调,做家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是___ (用离子方程式表达)。(已知:酸性:H2CO3>HClO>HCO ),家庭消毒马桶时,不可在用洁厕灵(主要成分是盐酸)清洗马桶后,立刻使用“84”消毒液消毒,否则会产生黄绿色的有毒气体,其反应的离子方程式是
),家庭消毒马桶时,不可在用洁厕灵(主要成分是盐酸)清洗马桶后,立刻使用“84”消毒液消毒,否则会产生黄绿色的有毒气体,其反应的离子方程式是___ 。
Ⅱ.某“84消毒液”瓶体部分标签如图1所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
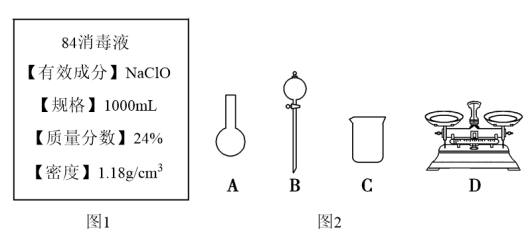
(3)此“84消毒液”的物质的量浓度约为___ mol·L-1。(计算结果保留一位小数)
(4)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL该消毒液。
①如图2所示的仪器中配制溶液需要使用的是___ 。(填仪器序号),还缺少的玻璃仪器是___ 。
②请计算该同学配制此溶液需用托盘天平称量NaClO固体的质量为___ g。
(5)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是___ (填字号)。
Ⅰ.如表为“84”消毒液说明书,请回答下列问题。
 说明书 | 药品名称 | 84消毒液 |
| 主要成分 | NaClO,有效氯含量50.00g/L~60.00g/L | |
| 注意事项 | 不可与其他洗涤剂或消毒液混合使用 | |
| 用法用量 | 稀释后浸泡或洗刷白色衣物,浴缸等1:200水溶液餐饮具,瓜果等1:100水溶液 |
(1)常温下用烧碱溶液吸收Cl2制备“84”消毒液。写出该反应的离子方程式
 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为(2)家庭用“84”消毒液用法强调,做家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是
 ),家庭消毒马桶时,不可在用洁厕灵(主要成分是盐酸)清洗马桶后,立刻使用“84”消毒液消毒,否则会产生黄绿色的有毒气体,其反应的离子方程式是
),家庭消毒马桶时,不可在用洁厕灵(主要成分是盐酸)清洗马桶后,立刻使用“84”消毒液消毒,否则会产生黄绿色的有毒气体,其反应的离子方程式是Ⅱ.某“84消毒液”瓶体部分标签如图1所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(3)此“84消毒液”的物质的量浓度约为
(4)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL该消毒液。
①如图2所示的仪器中配制溶液需要使用的是
②请计算该同学配制此溶液需用托盘天平称量NaClO固体的质量为
(5)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是
| A.定容时俯视制度线 | B.转移前,容量瓶内有蒸馏水 |
| C.未冷至室温就转移定容 | D.定容时水多用胶头滴管吸出 |
您最近一年使用:0次
名校
解题方法
8 . 如图是元素周期表的一部分,主族元素A、B、C、D、E在元素周期表中的位置如图,A元素的单质在空气中含量最高(请用相应的元素符号或化学式作答)∶
(1)A简单离子结构示意图_______
(2)下列说法不正确的是_______
A.C的最高价氧化物能溶于B的氢化物水溶液
B.元素A、E的气态氢化物相遇会产生白烟
C.B元素形成的其中一种18电子分子,能与A元素形成的一种10电子分子发生氧化还原反应
D.原子得电子能力∶D>E>A
(3)C、D、B氢化物的稳定性大小为_______ ,A和D氢化物沸点的大小为_______ 。
(4)设计实验比较D与E的非金属性强(用离子方程式表示)_______ 。
(5)A2的结构式_____ ,CB4的电子式为____ ,CB4溶于NaOH溶液的化学方程式____ 。
(6)E单质通入足量Na2CO3溶液发生反应的化学方程式_______ 。
| A | B | ||
| C | D | E |
(1)A简单离子结构示意图
(2)下列说法不正确的是
A.C的最高价氧化物能溶于B的氢化物水溶液
B.元素A、E的气态氢化物相遇会产生白烟
C.B元素形成的其中一种18电子分子,能与A元素形成的一种10电子分子发生氧化还原反应
D.原子得电子能力∶D>E>A
(3)C、D、B氢化物的稳定性大小为
(4)设计实验比较D与E的非金属性强(用离子方程式表示)
(5)A2的结构式
(6)E单质通入足量Na2CO3溶液发生反应的化学方程式
您最近一年使用:0次
9 . 下表是海水晒盐时,在浓缩过程中析出的盐的种类和质量(每升海水析出的各种盐的质量,单位为克)。
试回答下列问题:
(1)海水中含量较高的是氯元素、钠元素和镁元素,但从表中数据可以看出,海水晒盐时先析出的是CaSO4,其原因可能是_______ 。
(2)综合成本等因素,通常海水晒盐时,在海水密度为1.21 g·mL-1~1.22 g·mL-1之间效益最佳,此时得到的粗盐中含有杂质,含有杂质的粗盐不能直接用作化工原料,需要进行精制。精制时,加入的试剂和进行的操作为①NaOH溶液、②BaCl2溶液、③Na2CO3液、④稀盐酸、⑤过滤,⑥蒸发结晶。则加入试剂和进行的操作的顺序为_______ (填标号)。
(3)经过精制的食盐在化工上有着广泛的用途。电解饱和食盐水可制得氯气和氢氧化钠,其反应的化学方程式为2NaCl+2H2O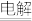 Cl2↑+H2↑+2NaOH,该反应中氧化产物与还原产物的物质的量之比为
Cl2↑+H2↑+2NaOH,该反应中氧化产物与还原产物的物质的量之比为_____ ,若将收集到的氯气通入石灰乳中,可制得漂白粉(主要成分为次氯酸钙),则工业上制漂白粉的化学方程式为_______ 。
(4)从海水中还可以提取镁、溴等。利用电解饱和食盐水得到的氯气作海水提取溴(在海水中主要以Br-形式存在)的氧化剂,则氯气作氧化剂得到溴单质反应的离子方程式为_____ 。
盐的种类 盐的质量(g) 海水的密度(g·mL-1) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
1.13 | 0.56 | _______ | _______ | _______ | _______ |
1.20 | 0.91 | _______ | _______ | _______ | _______ |
1.21 | 0.05 | 3.26 | 0.004 | 0.008 | _______ |
1.22 | 0.015 | 9.65 | 0.01 | 0.04 | _______ |
1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
1.31 | _______ | 1.40 | 0.54 | 0.03 | 0.05 |
(1)海水中含量较高的是氯元素、钠元素和镁元素,但从表中数据可以看出,海水晒盐时先析出的是CaSO4,其原因可能是
(2)综合成本等因素,通常海水晒盐时,在海水密度为1.21 g·mL-1~1.22 g·mL-1之间效益最佳,此时得到的粗盐中含有杂质,含有杂质的粗盐不能直接用作化工原料,需要进行精制。精制时,加入的试剂和进行的操作为①NaOH溶液、②BaCl2溶液、③Na2CO3液、④稀盐酸、⑤过滤,⑥蒸发结晶。则加入试剂和进行的操作的顺序为
(3)经过精制的食盐在化工上有着广泛的用途。电解饱和食盐水可制得氯气和氢氧化钠,其反应的化学方程式为2NaCl+2H2O
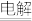 Cl2↑+H2↑+2NaOH,该反应中氧化产物与还原产物的物质的量之比为
Cl2↑+H2↑+2NaOH,该反应中氧化产物与还原产物的物质的量之比为(4)从海水中还可以提取镁、溴等。利用电解饱和食盐水得到的氯气作海水提取溴(在海水中主要以Br-形式存在)的氧化剂,则氯气作氧化剂得到溴单质反应的离子方程式为
您最近一年使用:0次
10 . FePO4 是制备锂离子电池的原料。向 FeSO4 溶液中先加入 H3PO4 溶液,再加入 NaOH、NaClO 的混合液可制取 FePO4。
(1)配平下列反应方程式:FeSO4+H3PO4+NaClO+NaOH→FePO4↓+Na2SO4+NaCl+H2O,____________________ 。
(2)NaOH、NaClO 的混合液可通过 Cl2 与 NaOH 溶液反应制取。若 NaOH、NaClO混合液中NaClO含量偏低,则制得的 FePO4 中含有的不溶性杂质主要是_______ 。
(3)现有 500 mL 1.2mol/LNaOH 溶液,若要制取反应所需的混合液,则需通入标准状况下 Cl2 的体积为__________ 。
(1)配平下列反应方程式:FeSO4+H3PO4+NaClO+NaOH→FePO4↓+Na2SO4+NaCl+H2O,
(2)NaOH、NaClO 的混合液可通过 Cl2 与 NaOH 溶液反应制取。若 NaOH、NaClO混合液中NaClO含量偏低,则制得的 FePO4 中含有的不溶性杂质主要是
(3)现有 500 mL 1.2mol/LNaOH 溶液,若要制取反应所需的混合液,则需通入标准状况下 Cl2 的体积为
您最近一年使用:0次



