1 . 下列离子的检验,所用试剂和现象均正确的是
| 试剂 | 现象 | ||
| A |  | 硝酸、硝酸银溶液 | 白色沉淀 |
| B |  | KSCN溶液 | 红色沉淀 |
| C |  | 稀盐酸 | 无色气泡 |
| D |  | 氯化钡溶液 | 白色沉淀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 下列离子检验操作、结论均合理的是
A.溶液中加入稀盐酸,产生使澄清石灰水变浑浊的气体,则原溶液中是CO 离子 离子 |
| B.某溶液中滴加过量的氨水产生白色沉淀,说明含Al3+ |
| C.某溶液中滴加氯水后再滴加KSCN溶液呈红色,说明原溶液含有Fe3+ |
| D.某无色溶液中滴加硝酸溶液无现象,再滴加硝酸银溶液产生白色沉淀,可以说明原溶液中含有Cl- |
您最近一年使用:0次
3 . 现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F、G,它们之间能发生如图反应。(图中有些反应的产物和反应条件没有标出)
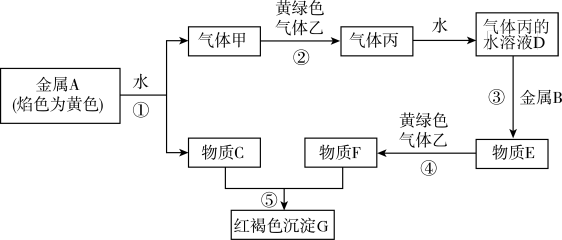
(1)用电子式表示丙的形成过程_____ 。
(2)写出金属B在一定条件下与水反应的化学方程式______ 。
(3)写出D的溶液与Al反应的化学方程式______ 。
(4)乙可与B在加热时反应,但液态乙可以用B材料制成的器具运输的原因为______ 。
(5)检验F溶液中阳离子的方法是_____ 。

(1)用电子式表示丙的形成过程
(2)写出金属B在一定条件下与水反应的化学方程式
(3)写出D的溶液与Al反应的化学方程式
(4)乙可与B在加热时反应,但液态乙可以用B材料制成的器具运输的原因为
(5)检验F溶液中阳离子的方法是
您最近一年使用:0次
2023-02-18更新
|
171次组卷
|
4卷引用:黑龙江省齐齐哈尔市2022-2023学年高一上学期期末考试化学试题
解题方法
4 . 部分氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如图处理,下列说法正确的是
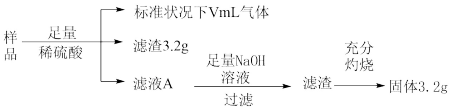
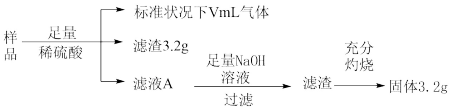
| A.滤液A中的阳离子为Fe2+、Cu2+、H+ | B.样品中Fe元素的质量为1.12g |
| C.V=448 | D.样品中CuO的质量为4.0g |
您最近一年使用:0次
2023-02-18更新
|
225次组卷
|
3卷引用:黑龙江省齐齐哈尔市2022-2023学年高一上学期期末考试化学试题
名校
5 . 向氧化铁、氧化铜、铁、铜的混合粉末中加入过量的稀盐酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是
A.只有 和 和 | B.一定有 、 、 ,可能有 ,可能有 |
C.一定有 ,可能有 ,可能有 | D.只有 |
您最近一年使用:0次
2023-02-09更新
|
598次组卷
|
5卷引用:黑龙江省牡丹江市第二高级中学2023-2024学年高三上学期第三次阶段性考试化学试题
黑龙江省牡丹江市第二高级中学2023-2024学年高三上学期第三次阶段性考试化学试题四川省成都市第七中学2022-2023学年高一上学期期末考试化学试题(已下线)第13讲 铁和铁的氧化物-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)河南省商丘市柘城县德盛高级中学2023-2024学年高一上学期11月月考化学试题江苏省盐城市阜宁县(部分校)2023-2024学年高一下学期期中(A卷)化学试题
名校
解题方法
6 . 硫酸亚铁铵晶体,又称摩尔盐,是分析化学中重要的基准物质,其化学式可表示为
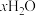 。为测定其结晶水含量并进一步探究其在惰性气体氛围中的热分解反应过程,现取一定质量的摩尔盐晶体做热重分析,绘制出如下的热重曲线。
。为测定其结晶水含量并进一步探究其在惰性气体氛围中的热分解反应过程,现取一定质量的摩尔盐晶体做热重分析,绘制出如下的热重曲线。
已知:①
②摩尔盐在580℃下完全分解,得到红棕色固体
则下列说法正确的是


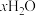 。为测定其结晶水含量并进一步探究其在惰性气体氛围中的热分解反应过程,现取一定质量的摩尔盐晶体做热重分析,绘制出如下的热重曲线。
。为测定其结晶水含量并进一步探究其在惰性气体氛围中的热分解反应过程,现取一定质量的摩尔盐晶体做热重分析,绘制出如下的热重曲线。已知:①

②摩尔盐在580℃下完全分解,得到红棕色固体
则下列说法正确的是

A.用 溶液检验摩尔盐中的金属阳离子 溶液检验摩尔盐中的金属阳离子 |
B. |
| C.用湿润的红色石蕊试纸检验205~420℃间分解产生的气体,试纸变蓝 |
D.0~580℃发生的化学方程式为: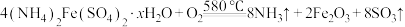 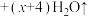 |
您最近一年使用:0次
2023-02-09更新
|
1165次组卷
|
3卷引用:黑龙江省大庆铁人中学2023-2024学年高一下学期开学考试化学试题
黑龙江省大庆铁人中学2023-2024学年高一下学期开学考试化学试题重庆市南开中学校2023届高三下学期第六次质量检测化学试题(已下线)专题卷08 无机物的性质与用途-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)
19-20高一·浙江·阶段练习
名校
解题方法
7 . 某同学用如下实验探究Fe2+、Fe3+的性质。请回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液,在FeCl3溶液中需加入少量铁屑,发生反应的化学方程式为_______ 。
(2)甲同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化,FeCl2溶液与氯水反应的化学方程式为_______ 。
(3)乙同学认为甲同学的实验不够严谨,该同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是_______ 。
(4)丁同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_______ 。
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液,在FeCl3溶液中需加入少量铁屑,发生反应的化学方程式为
(2)甲同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化,FeCl2溶液与氯水反应的化学方程式为
(3)乙同学认为甲同学的实验不够严谨,该同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是
(4)丁同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
2023-02-03更新
|
234次组卷
|
5卷引用:黑龙江省鸡西市第一中学2021-2022学年高一上学期期中考试化学试题
黑龙江省鸡西市第一中学2021-2022学年高一上学期期中考试化学试题(已下线)【浙江新东方】双师 (44).新疆巴音郭楞蒙古自治州第一中学等两校2022-2023学年高一上学期期末联考化学试题第2课时 铁盐和亚铁盐(已下线)【定心卷】3.1.2 铁的重要化合物随堂练习-人教版2023-2024学年必修第一册
2023高三·全国·专题练习
名校
8 . 用KSCN溶液和FeCl2溶液探究Fe2+的还原性时出现异常现象实验如下:
不正确的是
| ① | ② | ③ |
|
|
|
| 溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀 | 溶液变红且不褪色,有气体生成(经检验为O2),经检验有丁达尔效应 | 溶液变红且不褪色,滴加盐酸和BaCl2溶液,无白色沉淀,经检验无丁达尔效应 |
| A.对比①③,可判定酸性条件下H2O2可氧化SCN- |
B.实验 中发生的氧化还原反应有两种 中发生的氧化还原反应有两种 |
| C.②中红色溶液中含有Fe(OH)3胶体 |
| D.③中发生的氧化还原反应为:4Fe2++O2+4H+=4Fe3++2H2O |
您最近一年使用:0次
2023-01-30更新
|
162次组卷
|
3卷引用:黑龙江省齐齐哈尔市克东县第一中学2023-2024学年高一下学期开学考试化学试题
黑龙江省齐齐哈尔市克东县第一中学2023-2024学年高一下学期开学考试化学试题(已下线)专题08 元素及其化合物(测)-2023年高考化学二轮复习讲练测(新高考专用)河北省承德县第一中学等校2023-2024学年高二下学期开学联考化学试题
名校
解题方法
9 . 某溶液中含大量Fe2+、Mg2+、Fe3+、Na+、Cl-、SO 离子,其中加入足量的Na2O2固体后,再加入足量的盐酸溶解沉淀,最后溶液中的离子数目与反应前相比保持不变的是
离子,其中加入足量的Na2O2固体后,再加入足量的盐酸溶解沉淀,最后溶液中的离子数目与反应前相比保持不变的是
 离子,其中加入足量的Na2O2固体后,再加入足量的盐酸溶解沉淀,最后溶液中的离子数目与反应前相比保持不变的是
离子,其中加入足量的Na2O2固体后,再加入足量的盐酸溶解沉淀,最后溶液中的离子数目与反应前相比保持不变的是| A.Na+、Fe2+ | B.Mg2+、SO | C.Fe3+、SO | D.Mg2+、Cl- |
您最近一年使用:0次
2023-01-17更新
|
471次组卷
|
2卷引用:黑龙江省实验中学2023-2024学年高一下学期开学测试化学试题
名校
解题方法
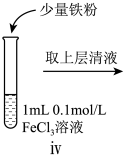
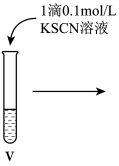
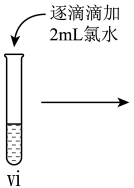
10 . 某小组同学分别探究FeCl2溶液、FeCl3溶液的性质。
I.探究FeCl2溶液的性质。
(1)预测FeCl2具有还原性,预测依据是_______ ,因此可以与酸性KMnO4溶液反应。
(2)进行如下实验操作:
①i中的现象是_______ 。
②i中反应的化学方程式是_______ 。
③iii中的现象是_______ 。
(3)某同学认为iii中现象并不能证明Fe2+具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象;②_______ 。
II.探究FeCl3溶液的性质。
小组同学进行如下实验操作并观察到对应现象:
(4)vi中滴加氯水过程中,氯水反应的离子方程式是_______ 。
III.小组同学探究vi中褪色原因,提出两种假设:a.铁离子被氧化,b.SCN-被氧化。
(5)分别向褪色后的溶液中滴加0.1 mol·L-1 FeCl3溶液和KSCN溶液各1滴,观察到_______ 现象,得出结论:假设b成立。
(6)进一步预测SCN-可能被转化为SO ,通过实验验证了该预测,写出实验操作及现象
,通过实验验证了该预测,写出实验操作及现象_______ 。
I.探究FeCl2溶液的性质。
(1)预测FeCl2具有还原性,预测依据是
(2)进行如下实验操作:
| 序号 | 操作 |
| i | 滴加NaOH溶液 | |
| ii | 加入少量锌粉 | |
| iii | 滴加酸性KMnO4溶液 |
②i中反应的化学方程式是
③iii中的现象是
(3)某同学认为iii中现象并不能证明Fe2+具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象;②
II.探究FeCl3溶液的性质。
小组同学进行如下实验操作并观察到对应现象:
| 操作 |
|
|
|
| 现象 | 溶液由棕黄色变为浅绿色 | 无明显现象 | 溶液变为红色,而后红色褪去 |
III.小组同学探究vi中褪色原因,提出两种假设:a.铁离子被氧化,b.SCN-被氧化。
(5)分别向褪色后的溶液中滴加0.1 mol·L-1 FeCl3溶液和KSCN溶液各1滴,观察到
(6)进一步预测SCN-可能被转化为SO
 ,通过实验验证了该预测,写出实验操作及现象
,通过实验验证了该预测,写出实验操作及现象
您最近一年使用:0次
2023-01-13更新
|
238次组卷
|
3卷引用:牡丹江市第一高级中学2023-2024学年高一上学期1月期末化学试题