1 . 下列有关说法正确的是

A.a.  ,b. ,b.  ,若a、b反应放热,则 ,若a、b反应放热,则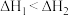 |
B.一定条件下,将0.5mol N2(g)和1.5mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为 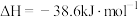 |
C. 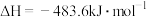 ,则H2的燃烧热 ,则H2的燃烧热 |
D.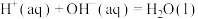  ,则1mol稀硫酸和足量氢氧化钡溶液反应放出的热量为114.6kJ ,则1mol稀硫酸和足量氢氧化钡溶液反应放出的热量为114.6kJ |
您最近一年使用:0次
名校
解题方法
2 . 下列热化学方程式中,ΔH能正确表示物质的燃烧热的是
A.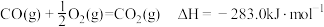 |
B.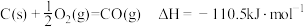 |
C.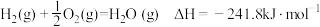 |
D. |
您最近一年使用:0次
2022-03-14更新
|
778次组卷
|
79卷引用:河南省鹤壁市淇滨高级中学2018-2019学年高二上学期第一次月考化学试题
河南省鹤壁市淇滨高级中学2018-2019学年高二上学期第一次月考化学试题(已下线)2010年河北省唐山一中高二上学期期中考试化学卷(已下线)2011-2012学年江西省兴国县将军中学高二上学期期中考试化学试卷(已下线)2011-2012天津南开中学高二第一学期期中考试理科化学试卷(已下线)2011-2012学年安徽省六安三中高二上学期期末考试化学A卷(已下线)2012-2013学年海南省农垦加来中学高二第一次月考化学试卷(已下线)2014陕西省西安中学高三上学期第三次质量检测化学试卷(已下线)2013-2014湖北省黄石市秋季高二化学期中统考试卷2015-2016学年山西太原五中高二上第一周考理科化学试卷2015-2016学年吉林省汪清县第六中学高二上学期9月月考化学试卷2015-2016学年安徽省郎溪中学高二上学期第一次月考化学试卷2015-2016学年吉林省汪清中学高二上学期第二次月考化学试卷2015-2016学年广西南宁市八中高二下学期期中段考化学试卷2016-2017学年吉林省汪清六中高二上学期期中化学试卷2016-2017学年陕西省宝鸡市岐山县高二上期中理化学卷2016-2017学年四川省乐山市高二上学期教学质检化学试卷2017届河北省八所重点中学高三下学期第一次联考化学试卷湖北省孝感市七校教学联盟2016-2017学年高二下学期期末考试化学试题甘肃省兰州第一中学2017-2018学年高二上学期第一次月考(9月)化学试题黑龙江省哈尔滨市第三中学2018届高三上学期第一次验收考试化学试题云南省德宏州芒市第一中学2017-2018学年高二上学期期中考试化学试题河北省邯郸市第二中学2017-2018学年高二上学期期中考试化学试题天津市红桥区2017-2018学年高二上学期期中考试化学试题广东省东莞市七校2017-2018学年高二上学期期中联考化学试题四川省乐山沫若中学2017-2018学年高二上学期第二次月考(12月)化学试题青海省西宁市第四高级中学2017-2018学年高二上学期期末考试化学试题河北省石家庄市鹿泉一中2017-2018学年高二3月月考化学试题【校级联考】江西省南昌市八一中学、洪都中学2018-2019学年高二上学期10月联考化学试题陕西省蓝田县焦岱中学2018-2019学年高二上学期第一次月考化学试题吉林省长春市九台区师范高级中学2018-2019学年高二上学期期中考试化学试题新疆维吾尔自治区昌吉市第九中学2018-2019学年高二上学期期末考试化学试题【全国百强校】青海省西宁市第四高级中学2018-2019学年高二上学期期末考试化学试题青海省海东市第二中学2018-2019学年高一下学期期中考试化学试题江苏省沭阳县2018-2019学年高二下学期期中调研测试化学试题河北省鹿泉第一中学2019-2020学年高二9月月考化学试题辽宁省凌源市联合校2019-2020学年高二上学期期中考试化学试题甘肃省永昌四中2019-2020学年高二上学期期中考试化学试题新疆维吾尔自治区昌吉玛纳斯县第一中学2018-2019学年高二上学期期中考试化学试题河北省临漳县第一中学2019-2020学年高二上学期期中考试化学试题甘肃省张掖市山丹县第一中学2017—2018学年高二上学期期末质量检测化学试题吉林省通化市梅河口市博文学校2019-2020学年高二上学期期末考试化学试题北京101中学2019-2020学年高二上学期期末考试化学试题广东省湛江市第二十一中学2019-2020学年高二上学期期中考试化学试题吉林省长春市第二十九中学2019-2020学年高一下学期期中考试化学试题(理)山西省新绛县第二中学2019-2020学年高二上学期第一次考试化学试题新疆生产建设兵团第四师第一中学2020-2021学年高二上学期期中考试化学试题湖南省湘潭市第一中学2020-2021学年高二下学期期中考试(水平测试)化学试卷重庆市万州纯阳中学2020-2021学年高二上学期期中考试化学试题辽宁省阜新市第二高级中学2020-2021学年高二上学期第二次月考化学试题新疆哈密市第八中学2019-2020学年高二上学期期中考试化学试题安徽省滁州市2020-2021学年高二上学期期末联考化学试题山西省沁县中学2020-2021学年高二上学期第一次月考化学试题辽宁省阜新市第二高级中学2020-2021学年高二上学期期末考试化学试题黑龙江省鹤岗市绥滨县第一中学2020-2021学年高二上学期期末考试化学试题广西南宁市2020-2021学年高二上学期期末考试(原理)化学试题广西南宁市2020-2021学年高二上学期期末考试化学试题河北省唐山市丰润区第二中学2020-2021学年高二上学期1月月考化学试题江西省靖安中学2020-2021学年高二上学期第二次月考化学试题云南省楚雄师范学院附属中学2020-2021学年高二上学期期中考试化学试题甘肃省庆阳市第六中学2021-2022学年高二上学期第一次月考化学(理)试题吉林省吉林市永吉县第四中学2021-2022学年高二上学期期中考试化学试题甘肃省兰州市第一中学2021-2022学年高二上学期期中考试化学(理科)试题福建省莆田第二十五中学2021-2022学年高二上学期期中考试化学试题黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期期中考试化学试题吉林省延边朝鲜族自治州汪清县汪清第四中学2021-2022学年高二上学期第二次阶段考试化学试题宁夏吴忠中学2021-2022学年高二上学期期末考试化学试题辽宁省营口市第二高级中学2021-2022学年高一下学期第一次月考化学试题安徽省六安中学2021-2022学年高二上学期期末考试化学试题湖南省涟源市第二中学2021-2022学年高二上学期期中考试化学试题北京市首都师范大学附属密云中学2022-2023学年高二上学期10月阶段性练习化学试题甘肃省临夏州临夏县中学2021-2022学年高二上学期期中考试化学(B卷)试题甘肃省临夏州临夏县中学2021-2022学年高二上学期期中考试化学(A卷)试题安徽省太和县第八中学2021-2022学年高二上学期第一次月考化学试题江西省南昌市知行中学2021-2022学年高二上学期期中化学试题广西南宁市第五十六中学2022-2023学年高二上学期月考化学试题(已下线)单项选择题黑龙江省齐齐哈尔市龙沙区2022-2023学年高二上学期12月期末考试化学试题天津市滨海新区田家炳中学2023-2024学年高二上学期期中考试化学试题青海省西宁北外附属新华联外国语高级中学2023-2024学年高二上学期期中考试化学试题
3 . 在下列各说法中,正确的是
| A.任何化学反应都有热效应,△H<0表示吸热反应,△H>0表示放热反应 |
| B.热化学方程式中的化学计量数只表示物质的量,可以用是分数表示,也可以用整数表示 |
| C.1molH2SO4与1mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D.1molH2与0.5mol O2反应放出的热就是H2的燃烧热 |
您最近一年使用:0次
2021-11-11更新
|
459次组卷
|
43卷引用:河南省鹤壁市淇滨高级中学2017-2018学年高二上学期第二次月考化学试题
河南省鹤壁市淇滨高级中学2017-2018学年高二上学期第二次月考化学试题(已下线)2013-2014黑龙江省哈六中学高一下学期期中考试化学试卷(已下线)2013-2014云南省玉溪一中高一下学期期末考试化学试卷2016-2017学年江苏省泰州中学高二上月考一化学试卷湖北省宜昌市七校教学协作体2016-2017学年高二下学期期末考试化学试题山西省朔州市第一中学2017-2018学年高二8月月考化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题A内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题B天津市杨柳青一中2017-2018第一学期高二第一次化学月考新疆昌吉市2017-2018学年高二上学期期末考试化学试题苏教版化学高中必修4模块综合检测题河南省周口市中英文学校2018-2019学年高二上学期第一次月考化学试题(已下线)2018年10月21日 《每日一题》人教选修4-每周一测【市级联考】内蒙古自治区鄂尔多斯市2018-2019学年高二上学期期中考试化学试题江苏省泰州市第二中学2017-2018学年高二上学期期中考试化学试题【市级联考】吉林省公主岭市2018-2019学年高二上学期期末考试化学试题2019年10月20日《每日一题》2019-2020学年高二化学人教选修4——每周一测湖南省衡阳市第一中学2019-2020学年高二上学期第一次月考化学试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(一)(已下线)【南昌新东方】江西省南昌市第三中学2019-2020学年度高二上学期期中化学试题甘肃省古浪县第二中学2019-2020学年高二上学期基础知识竞赛化学试题贵州省施秉县一中2019-2020学年高二上学期期末考试化学试题四川省南充市阆中中学2020届高三化学选择题专项训练(12)甘肃省白银市会宁县第二中学2017-2018学年高二上学期期中考试理科化学试题河南省安阳市林州市第一中学2019-2020学年高二下学期4月月考化学试题云南省玉龙纳西族自治县田家炳民族中学2019-2020学年高二下学期期中考试化学试题黑龙江省大庆市第十中学2020-2021学年高二上学期开学考试化学试题陕西省汉中市洋县中学2020-2021学年高二上学期第一次月考化学试题湖南省宁乡县第七中学2020-2021学年高二10月月考化学试题河北省衡水市第十四中学2020-2021学年高二上学期三调考试(校外)化学试题河南省驻马店市2020-2021学年高二上学期期终考试化学试题江苏省扬州中学2021-2022学年高二上学期10月阶段检测化学试题浙江省台州市“十校联盟”2021-2022学年高二上学期期中考试化学试题 云南省玉溪市第二中学2021-2022学年高二上学期期中考试化学试题云南省玉溪市江川区第二中学2021-2022学年高二上学期期中考试化学试题广东省珠海市第二中学2021-2022学年高二上学期期中考试化学试题黑龙江省哈尔滨市第一六二中学2021-2022学年高二上学期期末考试化学试题甘肃省秦安县第一中学2021-2022学年高二上学期期中考试化学试题江苏省连云港高级中学2022-2023高二上学期第一次阶段测试化学试题吉林江城中学2021-2022学年高二上学期期中考试化学试题江苏省南通市如东县2022-2023学年高二上学期10月月考化学试题(已下线)第01讲 反应热 焓变-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)广东省普宁二中实验学校2022-2023学年高二上学期第一次月考化学试题
名校
解题方法
4 . 煤的气化和天然气净化过程中会产生H2S,将其吸收与转化是环境保护和资源利用的有效措施。回答下列问题:
(1)利用足量纯碱溶液可吸收低浓度H2S,生成的含硫物质主要是___________ (填化学式。H2S的Ka1=1.3×10-7,Ka2=7.1×10-15;H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11)。
(2)电解氧化法处理H2S的原理是:在氧化反应器中,利用Fe3+氧化H2S;在电解反应器中实现Fe3+的再生,并副产氢气,总反应为H2S(g) S(s)+H2(g) △H1,相关物质的燃烧热数据如下表:
S(s)+H2(g) △H1,相关物质的燃烧热数据如下表:
则△H1=___________ kJ·mol-1。
(3)H2S高温裂解转化为H2和硫蒸气S2 反应方程式:2H2S(g) 2H2(g)+S2(g) 。维持体系压强为100 kPa,反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图所示。
2H2(g)+S2(g) 。维持体系压强为100 kPa,反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图所示。

①H2S高温裂解反应的△H___________ 0(填“>”或“<”)。曲线c代表的物质是___________ (填化学式)
②反应温度为1300℃时,H2S的平衡转化率为___________ ,反应的平衡常数Kp=___________ (计算结果保留1位小数)。
(1)利用足量纯碱溶液可吸收低浓度H2S,生成的含硫物质主要是
(2)电解氧化法处理H2S的原理是:在氧化反应器中,利用Fe3+氧化H2S;在电解反应器中实现Fe3+的再生,并副产氢气,总反应为H2S(g)
 S(s)+H2(g) △H1,相关物质的燃烧热数据如下表:
S(s)+H2(g) △H1,相关物质的燃烧热数据如下表:| 物质 | H2S(g) | S(s) | H2(g) |
| 燃烧热AH/(kJ·mol-1) | -562.0 | -296.8 | -258.8 |
(3)H2S高温裂解转化为H2和硫蒸气S2 反应方程式:2H2S(g)
 2H2(g)+S2(g) 。维持体系压强为100 kPa,反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图所示。
2H2(g)+S2(g) 。维持体系压强为100 kPa,反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图所示。
①H2S高温裂解反应的△H
②反应温度为1300℃时,H2S的平衡转化率为
您最近一年使用:0次
名校
解题方法
5 . 下列热化学方程式或离子方程式中,正确的是
A.由热化学方程式CH3OH(g)+ O2(g)=CO2(g)+2H2(g); O2(g)=CO2(g)+2H2(g); =-192.9 kJ·mol-1,可推知CH3OH(g)的燃烧热为192.9 kJ·mol-1 =-192.9 kJ·mol-1,可推知CH3OH(g)的燃烧热为192.9 kJ·mol-1 |
B.已知H2(g)的燃烧热为285.8 kJ·mol-1,则2H2O(l)=2H2(g)+O2(g); =+571.6 kJ·mol-1 =+571.6 kJ·mol-1 |
C.HCl(aq)和NaOH(aq)反应的中和热ΔH=-57.3 kJ·mol-1,则稀H2SO4(aq)和Ba(OH)2 (aq)反应生成2molH2O(l)的反应热 =2×(-57.3 kJ·mol-1) =2×(-57.3 kJ·mol-1) |
D.一定条件下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)⇌2NH3(g)  =-38.6 kJ·mol-1 =-38.6 kJ·mol-1 |
您最近一年使用:0次
2020-11-29更新
|
290次组卷
|
6卷引用:河南省鹤壁市高级中学2020-2021学年高二上学期尖子生联赛调研化学试题
名校
解题方法
6 . 下列有关热化学方程式及其叙述正确的是( )
| A.H2的燃烧热为285.8kJ/mol,则H2O电解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+285.8kJ/mol |
B.1molCH4完全燃烧生成CO2(g)和H2O(l)时放出890kJ的热量,其热化学方程式为 CH4(g)+O2(g)= CH4(g)+O2(g)= CO2(g)+H2O(l) ΔH=-445kJ/mol CO2(g)+H2O(l) ΔH=-445kJ/mol |
| C.已知2C(s)+O2(g)=2CO(g)ΔH=-221kJ/mol,则C的燃烧热为110.5kJ/mol |
| D.HF与NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol |
您最近一年使用:0次
2020-10-28更新
|
191次组卷
|
22卷引用:河南省鹤壁市淇县第一中学2018-2019学年高二(普通班)上学期第一次月考化学试题
河南省鹤壁市淇县第一中学2018-2019学年高二(普通班)上学期第一次月考化学试题(已下线)2011届湖南省十二校联考高三上学期第一次考试化学试卷2015-2016学年黑龙江大庆市铁人中学高一下期中化学试卷甘肃省兰州第一中学2017-2018学年高二上学期期中考试化学(理)试题江西省抚州市临川区第一中学2017-2018学年高二上学期期中考试化学试题【全国百强校】西藏自治区拉萨中学2018-2019学年高二第一次月考化学试题河南省安阳市第三十六中学2018-2019学年高二上学期第一次月考化学试题【全国百强校】海南省海南中学2017-2018学年高二(理)上学期期末考试化学试题【全国百强校】吉林省实验中学2019届高三上学期期中考试化学试题【全国百强校】内蒙古自治区乌兰察布市集宁一中(西校区)2020届高三上学期期中考试化学试题甘肃省兰州第一中学2019-2020学年高二上学期期中考试化学(理)试题辽宁省凌源市联合校2019-2020学年高二上学期期中考试化学试题甘肃省甘谷第一中学2019-2020学年高二上学期第二次月考化学试题宁夏海原县第一中学2019-2020学年高二上学期期末考试化学试题四川省成都市彭州市第一中学2019-2020学年高二上学期1月联考化学试题山西省朔州市怀仁县怀仁一中云东校区2020-2021学年高二上学期第二次月考化学试题河北省唐山市第十一中学2020-2021学年高二上学期第一次月考化学(理)试题宁夏回族自治区海原县第一中学2020-2021学年高二上学期第一次月考化学试题甘肃省庆阳市宁县第二中学2020-2021学年高二上学期期中考试化学试题(理科)云南省昭通市昭阳区第一中学2019-2020学年高一6月月考化学试题黑龙江省龙东地区四校2021-2022学年高三上学期第一次联考化学试题甘肃省民乐县第一中学2021-2022学年上学期高三第二次诊断(12月)考试化学试题
7 . 天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g)ΔH1,相关物质燃烧热数据如下表所示:
①ΔH1=_________ kJ·mol−1。
②提高该反应平衡转化率的方法有_________ 、__________ 。
③容器中通入等物质的量的乙烷和氢气,在等压下(P)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=_________ (用含p、α的式子表示即可,无需化简)。
(2)一定温度下,甲烷生成乙烷的反应如下:2CH4 C2H6+H2。反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数,其大小仅受温度影响。
C2H6+H2。反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数,其大小仅受温度影响。
①已知反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=_____ (用含r1、α的式子表示)。
②对于处于初期阶段的该反应,下列说法正确的是_______ 。
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
(1)乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g)ΔH1,相关物质燃烧热数据如下表所示:
物质 | C2H6(g) | C2H4(g) | H2(g) |
| 燃烧热ΔH/(kJ·mol−1) | -1560 | -1411 | -286 |
①ΔH1=
②提高该反应平衡转化率的方法有
③容器中通入等物质的量的乙烷和氢气,在等压下(P)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=
(2)一定温度下,甲烷生成乙烷的反应如下:2CH4
 C2H6+H2。反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数,其大小仅受温度影响。
C2H6+H2。反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数,其大小仅受温度影响。①已知反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=
②对于处于初期阶段的该反应,下列说法正确的是
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
您最近一年使用:0次
2020-08-31更新
|
66次组卷
|
2卷引用:河南省鹤壁市高级中学2020-2021学年高二上学期阶段性检测(二)化学试题
名校
解题方法
8 . 下列依据热化学方程式得出的结论正确的是
热化学方程式 | 结论 | |
A | 2H2(g)+O2(g)=2H2O(g) ΔH=483.6kJ/mol | 氢气的燃烧热 △H=﹣483.6kJ/mol |
B | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol | 含40.0gNaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ |
C | 2C(s)+2O2(g)=2CO2(g) ΔH=-akJ/mol 2C(s)+O2(g)=2CO(g) ΔH=-bkJ/mol | b>a |
D | C(石墨,s)=C(金刚石,s)ΔH=+1.5kJ/mol | 金刚石比石墨稳定 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
9 . 已知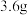 碳在
碳在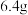 氧气中燃烧至反应物耗尽,共放出
氧气中燃烧至反应物耗尽,共放出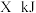 的热量.已知单质碳的燃烧热为
的热量.已知单质碳的燃烧热为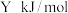 ,则
,则 与
与 反应生成
反应生成 的反应热
的反应热 为( )
为( )
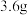 碳在
碳在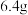 氧气中燃烧至反应物耗尽,共放出
氧气中燃烧至反应物耗尽,共放出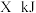 的热量.已知单质碳的燃烧热为
的热量.已知单质碳的燃烧热为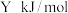 ,则
,则 与
与 反应生成
反应生成 的反应热
的反应热 为( )
为( )A. | B.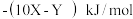 |
C.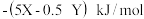 | D.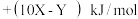 |
您最近一年使用:0次
2019-10-11更新
|
112次组卷
|
19卷引用:河南省鹤壁市淇县第一中学2018-2019学年高二(普通班)上学期第一次月考化学试题
河南省鹤壁市淇县第一中学2018-2019学年高二(普通班)上学期第一次月考化学试题(已下线)2013-2014黑龙江省鹤岗一中高一下学期期中考试化学试卷2014-2015学年江西省高安中学高一重点班下期末化学试卷2014-2015学年江西省高安中学高一下学期期末化学试卷2015-2016学年贵州省思南中学高二上二次月考化学试卷2015-2016学年辽宁省东北育才学校高一下期中化学试卷2016-2017学年湖南师大附中高二上期中理化学试卷黑龙江省鹤岗第一中学2016-2017学年高一下学期期中考试化学试卷黑龙江省肇东市第一中学2016-2017学年高一下学期期中考试化学试题四川省南充高级中学2017-2018学年高二上学期期中考试化学试题四川省遂宁市2017-2018学年高二上学期期末考试化学试题四川省什邡中学2017-2018学年高二春秋招班第三次月考化学试题宁夏石嘴山市第三中学2017-2018学年高二下学期第一次月考化学试题【全国百强校】黑龙江省哈尔滨师范大学附属中学2017-2018学年高一下学期期中考试化学(理)试题【全国百强校】甘肃省天水一中2018-2019学年高二下学期寒假作业检测化学试题(已下线)2019年9月1日《每日一题》人教选修4—— 每周一测宁夏育才中学2019-2020学年高二上学期第一次月考化学试题陕西省西安市第一中学2020-2021学年高二上学期期中考试化学试题陕西省西安市长安区第一中学2017-2018学年高二上学期第四次教学质量检测化学试题
名校
10 . 下列有关热化学方程式的叙述正确的是( )
| A.已知2H2(g)+O2(g)=2 H2O(g) △H= -483.6kJ·mol-1,则氢气的燃烧热△H= -241.8 kJ/mol |
| B.已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2 |
| C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) △H= -57.4kJ·mol-1 |
| D.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H= +566.0kJ/mol |
您最近一年使用:0次
2018-06-22更新
|
470次组卷
|
9卷引用:河南省鹤壁市高中2022-2023学年高二上学期10月居家测试化学试题
河南省鹤壁市高中2022-2023学年高二上学期10月居家测试化学试题【全国百强校】广东仲元中学2017-2018学年高二下学期期中考试(理)化学试题四川省武胜烈面中学2019-2020学年高二10月月考化学试题江西省南昌市八一中学、洪都中学、十七中三校2019-2020学年高二10月联考化学试题福建省泉州第十六中学2019-2020学年高二上学期期中考试化学(选考班)试题江西省抚州市南城县第二中学2019-2020学年高二上学期第二次月考化学试题2020届高三化学选修4二轮专题练——焓变及反应热综合【选择精编25题】河北省邯郸市永年区第二中学2020-2021学年高二上学期第一次月考教学质量检测化学试题重庆市缙云教育联盟2021-2022学年高三8月月度质量检测化学试题



