1 . 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应反应N2(g)+3H2(g)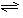 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______ 移动(填“向左”“向右”或“不”);,使用催化剂_____ 反应的ΔH(填“增大”“减小”或“不改变”)。
(2)O2(g)= O+2(g)+e- H1=1175.7kJ·mol-1
H1=1175.7kJ·mol-1
PtF6(g)+ e-1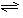 PtF6-(g)
PtF6-(g) H2= -771.1 kJ·mol-1
H2= -771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的 H=
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________ 沉淀(填化学式),生成该沉淀的离子方程式为____________ 。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_____________ 性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________ 。
(1)合成氨反应反应N2(g)+3H2(g)
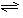 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡(2)O2(g)= O+2(g)+e-
 H1=1175.7kJ·mol-1
H1=1175.7kJ·mol-1PtF6(g)+ e-1
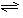 PtF6-(g)
PtF6-(g) H2= -771.1 kJ·mol-1
H2= -771.1 kJ·mol-1O2+PtF6-(s)=O2+(g)+PtF6-
 H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的
 H=
H=(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显
您最近一年使用:0次
2016-12-09更新
|
1606次组卷
|
9卷引用:山西省朔州市怀仁一中2018-2019学年高二上学期第五次月考化学试题
山西省朔州市怀仁一中2018-2019学年高二上学期第五次月考化学试题2009年普通高等学校招生统一考试理综试题化学部分(山东卷)(已下线)2009学年中山一中、翠园中学、宝安中学高三联考化学试题(已下线)2010—2011学年浙江省杭州二中高二下二学期期中考试化学试卷(已下线)2012届高考化学一轮复习《溶液中的离子反应》专题综合测试(苏教版)(已下线)2011-2012学年湖北省荆州中学高二上学期期中考试化学试卷(已下线)2011-2012学年吉林省长春二中高二上学期期末考试化学试卷2015-2016学年四川省彭州中学高二下2月月考化学试卷2020年安徽省全省教学质量检测统一考试(练习检测一)
名校
解题方法
2 . 碳是形成化合物种类最多的元素,其单质及其部分化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
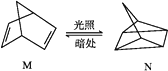
ΔH=+88.6 kJ·mol-1,则M、N相比,较稳定的是__________ 。
(2)CH3OH+O2(g) =CO2(g)+2H2O(g) ΔH=-akJ·mol-1,则a________ (填“>”“<”或“=”)238.6。(已知甲醇的燃烧热为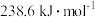 )
)
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:____________________________ 。
(4)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s) ===2Al2O3(s)+3TiC(s) ΔH= -1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为_____________ 。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

ΔH=+88.6 kJ·mol-1,则M、N相比,较稳定的是
(2)CH3OH+O2(g) =CO2(g)+2H2O(g) ΔH=-akJ·mol-1,则a
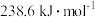 )
) (3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:
(4)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s) ===2Al2O3(s)+3TiC(s) ΔH= -1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为
您最近一年使用:0次
2016-12-08更新
|
2132次组卷
|
14卷引用:山西省实验中学2017-2018学年高二上学期10月月考化学试题
山西省实验中学2017-2018学年高二上学期10月月考化学试题(已下线)2014年高考化学一轮复习课后规范训练6-1练习卷重庆市九校联盟2017-2018学年高二上学期期中考试化学试题(已下线)二轮复习 专题8 化学反应中与能量变化 押题专练【全国百强校】广东仲元中学2017-2018学年高二下学期期中考试(理)化学试题河北省安平中学2017-2018学年高一下学期期末考试化学试题12018-2019学年人教版高二化学选修四章:化学反应与能量末测试题2018-2019学年人教版高中化学选修四 章末综合测评1 化学反应与能量四川省成都经济技术开发区实验中学校2019届高三上学期入学考试化学试题河南省鹤壁市淇县第一中学2018-2019学年高二(普通班)上学期第一次月考化学试题(已下线)《2018-2019学年同步单元双基双测AB卷》第一单元 化学反应与能量单元测试(A卷)【全国百强校】福建省三明市第一中学2018-2019学年高二上学期第一次月考化学试题高二人教版选修4 期末学业测评(二)辽宁省普兰店市第一中学2019届高三上学期期中考试化学试题
真题
名校
3 . Q、R、T、W四种短周期元素在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为_______ 。
(2)元素的非金属性为(原子的得电子能力):Q_______ W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_______ 。
(4)原子序数比R多1的元素的一种氢化物A能分解为其另一种氢化物B,写出A的电子式_____ 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是___ 。
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的△H =_______ kJ/mol(注:题中所设单质均为最稳定单质)
Q | R | ||
T | W |
(1)T的原子结构示意图为
(2)元素的非金属性为(原子的得电子能力):Q
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
(4)原子序数比R多1的元素的一种氢化物A能分解为其另一种氢化物B,写出A的电子式
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的△H =
您最近一年使用:0次
2016-12-08更新
|
1274次组卷
|
5卷引用:山西省实验中学2020届高三化学复习针对性试题集(三)
名校
4 . 已知:C(s)+O2(g)=CO2(g) △H1=-395kJ/mol,
CO(g)+1/2O2(g)=CO2(g) △H2=-283kJ/mol,
则反应C(s)+1/2O2(g)=CO(g)的反应热△H3等于
CO(g)+1/2O2(g)=CO2(g) △H2=-283kJ/mol,
则反应C(s)+1/2O2(g)=CO(g)的反应热△H3等于
| A.-112 kJ/mol | B.-395 kJ/mol | C.+ 112 kJ/mol | D.-283 kJ/mol |
您最近一年使用:0次
2016-11-29更新
|
252次组卷
|
3卷引用:山西省阳泉二中2018-2019学年高二上学期期中考试化学试题
5 . 符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是
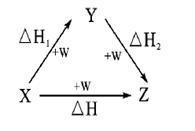
①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
| A.①④⑤ | B.①②③ | C.①③④ | D.①③④⑤⑥ |
您最近一年使用:0次
2016-09-30更新
|
912次组卷
|
20卷引用:2015-2016学年山西省怀仁一中高二下第一次月考化学试卷
2015-2016学年山西省怀仁一中高二下第一次月考化学试卷山西省大同市第一中学2017-2018学年高二上学期期中考试化学试题2015-2016学年湖北省武汉二中高一下期末化学试卷2016-2017学年河北省涿鹿中学高二上学期第一次月考化学试卷安徽省铜陵市第一中学2017-2018学年高二10月月考化学试题湖北省华中师范大学第一附属中学2017-2018学年高二上学期期中考试化学试题高中化学人教版 选修四 第一章 化学反应与能量 第三节 化学反应热的计算 化学反应热的计算第二课时(反应热的计算)宁夏银川一中2017-2018学年高二上学期期末考试化学试题辽宁省大连市普兰店区第二中学2017-2018学年高二上学期期末考试化学试题黑龙江省伊春中学2017-2018学年高二化学上学期期末考试试题【校级联考】安徽省滁州市定远县西片区2018-2019学年高二上学期期中考试化学试题【校级联考】安徽省定远重点中学2018-2019学年高二下学期开学考试化学试题广东省揭阳第一中学2016-2017学年高一下学期第二次阶段考试化学科试题2020届高三化学二轮冲刺新题专练——高考常考题型:无机化学推断题江西省赣州市宁师中学2019-2020学年高二12月月考化学试题甘肃省兰州大学附属中学(33中)2019-2020学年高二上学期期中考试化学试题(已下线)1.3.1 盖斯定律(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)河南省顶级名校2020-2021学年高二上学期开学测试化学试题(已下线)第1章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)河南省开封市五县2021-2022学年高二上学期月考联考化学试题
名校
6 . 根据碘与氢气反应的热化学方程式 (i)I2(g)+H2(g) 2HI(g) △H=-9.48kJ/mol ,(ii) I2(s)+H2(g)
2HI(g) △H=-9.48kJ/mol ,(ii) I2(s)+H2(g) 2HI(g) △H=+26.48kJ/mol,下列判断正确的是
2HI(g) △H=+26.48kJ/mol,下列判断正确的是
 2HI(g) △H=-9.48kJ/mol ,(ii) I2(s)+H2(g)
2HI(g) △H=-9.48kJ/mol ,(ii) I2(s)+H2(g) 2HI(g) △H=+26.48kJ/mol,下列判断正确的是
2HI(g) △H=+26.48kJ/mol,下列判断正确的是| A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1mol气态碘所含的能量相差l7.00 kJ |
| C.反应(i)的产物比反应(ii)的产物稳定 |
| D.反应(i) 拆开1mol I-I键与1mol H-H键需要的总能量小于拆开2mol H-I键需要的总能量 |
您最近一年使用:0次
2016-09-18更新
|
318次组卷
|
7卷引用:山西省太原市山西省实验中学2019-2020学年高二上学期10月月考化学试题
名校
7 . 下列有关反应热的叙述中正确的是
①已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为△H=-241.8 kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g) Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:
上表数据可以计算出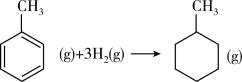 的焓变
的焓变
⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2固体时,放出的热量相等
⑥25℃,101 kPa时,1 mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
①已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为△H=-241.8 kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)
 Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大④已知:
| 共价键 | C—C | C=C | C—H | H—H |
| 键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
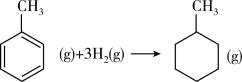 的焓变
的焓变⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2固体时,放出的热量相等
⑥25℃,101 kPa时,1 mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
| A.①②③④ | B.③④⑤ | C.④⑤ | D.⑥ |
您最近一年使用:0次
2015-09-06更新
|
1467次组卷
|
7卷引用:2016-2017学年山西省大同一中高二上10月月考化学卷



