名校
1 . 尿素/H2O2溶液可用于烟气的脱硫脱硝。
(1)已知T℃时,2SO2(g)+O2(g) 2SO3(g) △H1
2SO3(g) △H1
2H2O2(I)=2H2O(I)+O2(g) △H2
SO3(g)+H2O(I))=H2SO4(I) △H3
则SO2(g)+H2O2(I))=H2SO4(I) △H4=__________ (用含△H1、△H2、△H3的代数式表示)
(2)尿素[CO(NH2)2]溶液对NOx及SO2有一定的脱除率。将SO2和NOx (N〇约占90%)通入氧气的体积分数为7%、尿素浓度为5%的反应器中进行反应。
①烟气中SO2最终转化为一种正盐,其化学式为______________ ;NO和NO2以物质的量之比1:1与CO(NH2)2反应生成无毒气体的化学方程式为_______________ 。
②氨基甲酸铵(H2NCOONH4)是尿素的水解产物,将一定量的氨基甲酸铵置于恒容密闭容器中,发生反应:NH2COONH4(s) 2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
该反应的△H__________ (填“>”或“<”)0;348K时,该反应的平衡常数K__________________ 。
(3)其他条件不变,向尿素溶液中添加H2O2溶液,测得不同 pH下氮氧化物的脱除率与时间的关系如图所示。
①NO与H2O2发生反应生成亚硝酸时,氧化剂与还原剂的物质的量之比为____________ 。
(2)脱硝时,最佳pH为_________ ;在碱性较强时,NOx脱除率降低,其原因是___________ (任写一点)。
(1)已知T℃时,2SO2(g)+O2(g)
 2SO3(g) △H1
2SO3(g) △H12H2O2(I)=2H2O(I)+O2(g) △H2
SO3(g)+H2O(I))=H2SO4(I) △H3
则SO2(g)+H2O2(I))=H2SO4(I) △H4=
(2)尿素[CO(NH2)2]溶液对NOx及SO2有一定的脱除率。将SO2和NOx (N〇约占90%)通入氧气的体积分数为7%、尿素浓度为5%的反应器中进行反应。
①烟气中SO2最终转化为一种正盐,其化学式为
②氨基甲酸铵(H2NCOONH4)是尿素的水解产物,将一定量的氨基甲酸铵置于恒容密闭容器中,发生反应:NH2COONH4(s)
 2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:温度/K | 338 | 343 | 348 | 353 |
平衡时气体的总浓度/mol • L-1 | 0.36 | 0.48 | 0.60 | 0.72 |
该反应的△H
(3)其他条件不变,向尿素溶液中添加H2O2溶液,测得不同 pH下氮氧化物的脱除率与时间的关系如图所示。
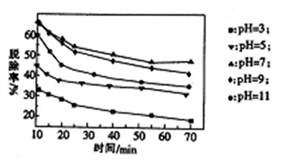
①NO与H2O2发生反应生成亚硝酸时,氧化剂与还原剂的物质的量之比为
(2)脱硝时,最佳pH为
您最近一年使用:0次
2017-03-14更新
|
597次组卷
|
2卷引用:山西省临汾一中、忻州一中、康杰中学等五校2017届高三第五次联考理科综合化学试题
名校
2 . 随着人们生活的发展,能源的利用倍受关注。
(1)甲醇中(CH3OH)作为一种清洁能源开始走进人们的生活。某实验小组向一10 L的恒容密闭容器中通入1 molCO和3molH2,发生反应:CO(g)+2H2(g) CH3OH(g) △H<0,测得CO在不同温度下的平衡转化率与压强的关系如图1所示。
CH3OH(g) △H<0,测得CO在不同温度下的平衡转化率与压强的关系如图1所示。
①已知:2H2(g)+O2(g)===2H2O(g) ΔH1;
CO(g)+ O2(g)=CO2(g) ΔH2;
O2(g)=CO2(g) ΔH2;
CH3OH(g)+ O2(g)= CO2(g)+2H2O(g) ΔH3.
O2(g)= CO2(g)+2H2O(g) ΔH3.
则ΔH=__________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
②温度T1、T2、T3由小到大的顺序为__________________,a、b、c三点对应的混合气体的平均摩尔质
量M(a)、M(b)、M(c)大到小的顺序为_____________________。
③温度为T2时,化学平衡常数K=_________(保留三位有效数字)。
(2)电化学在生产生活中有广泛的应用。
①高铁电池因其储电容量大而开始应用于电动汽车。已知该电池放电时的总反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,则电解质溶液可能为__________ (填字母)。
A.KOH溶液 B.H2SO4C.稀HNO3
②甲醇燃料电池能大幅度地提高甲醇的利用率,其工作原理如图2所示,电解质是掺杂了Y2O3的ZrO2晶体,它能传导O2-。工作时O2-向__________(填“正极”或“负极”)移动,负极的电极反应式为____________。
③铝一空气电池装置如图所示,该电池的负极是__________(填“铝电极”或“空气电极”),每消耗0.54g A1,需消耗标准状况下的空气_______(设空气中O2的体积分数为20%)L。
(1)甲醇中(CH3OH)作为一种清洁能源开始走进人们的生活。某实验小组向一10 L的恒容密闭容器中通入1 molCO和3molH2,发生反应:CO(g)+2H2(g)
 CH3OH(g) △H<0,测得CO在不同温度下的平衡转化率与压强的关系如图1所示。
CH3OH(g) △H<0,测得CO在不同温度下的平衡转化率与压强的关系如图1所示。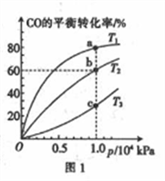
①已知:2H2(g)+O2(g)===2H2O(g) ΔH1;
CO(g)+
 O2(g)=CO2(g) ΔH2;
O2(g)=CO2(g) ΔH2;CH3OH(g)+
 O2(g)= CO2(g)+2H2O(g) ΔH3.
O2(g)= CO2(g)+2H2O(g) ΔH3.则ΔH=__________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
②温度T1、T2、T3由小到大的顺序为__________________,a、b、c三点对应的混合气体的平均摩尔质
量M(a)、M(b)、M(c)大到小的顺序为_____________________。
③温度为T2时,化学平衡常数K=_________(保留三位有效数字)。
(2)电化学在生产生活中有广泛的应用。
①高铁电池因其储电容量大而开始应用于电动汽车。已知该电池放电时的总反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,则电解质溶液可能为__________ (填字母)。
A.KOH溶液 B.H2SO4C.稀HNO3
②甲醇燃料电池能大幅度地提高甲醇的利用率,其工作原理如图2所示,电解质是掺杂了Y2O3的ZrO2晶体,它能传导O2-。工作时O2-向__________(填“正极”或“负极”)移动,负极的电极反应式为____________。
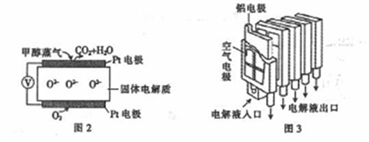
③铝一空气电池装置如图所示,该电池的负极是__________(填“铝电极”或“空气电极”),每消耗0.54g A1,需消耗标准状况下的空气_______(设空气中O2的体积分数为20%)L。
您最近一年使用:0次
解题方法
3 . 人口资源环境委员会副主任、中国科学院院士秦大河表示,当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因。煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一。
⑴已知:H2O(g)=H2O(I) △H=-44kJ/mol
①请写出煤的气化反应生成合成气(CO和H2)的热化学方程式___________ 。
②在恒温、恒容的反应器中,能表明上述反应达到平衡状态的是_______ 。
a.混合气体平均相对分子质量不再改变
b.气体压强不再改变
c.各气体浓度相等
d.反应体系中温度保持不变
e.断裂氢氧键速率是断裂氢氢键速率的2倍
f.混合气体密度不变
g.单位时间内,消耗水的质量与生成氢气的质量比为9:1
⑵在催化剂作用下合成气合成甲烷过程中会发生如下反应:
I CO(g)+3H2(g) = CH4(g)+H2O(g) △H1= -206 kJ/mol
II CO(g)+H2O(g) = CO2(g)+H2(g) △H2= -41 kJ/mol
Ⅲ 2CO(g)+2H2(g)= CH4(g)+CO2(g) △H 3= -247.4 kJ/mol
①图1是太原理工大学煤化工研究所利用热力学数据分析得到温度对反应ⅠInK(化学平衡常数K的自然对数)的曲线图,请分析出现这样趋势的原因是____________ 。
②提高甲烷反应选择性的关键因素是_______ ,根据相关知识和图2分析合成甲烷适宜的反应条件是
在550~630K,1MPa的原因是__________________ 。
③850℃时在体积为5L反应器中发生反应Ⅱ,CO和H2O(g)浓度变化如图所示,请列式计算此条件下的平衡常数_____________ 。
(3)CH4燃料电池利用率很高,装置中添加1L2mol/L的KOH溶液为电解质,持续缓慢通入标准状况下甲烷22.4L~33.6 L时负极电极反应为___________ 。
⑴已知:H2O(g)=H2O(I) △H=-44kJ/mol
| 物质 | H2(g) | C(s) | CO(g) |
| 燃烧热kJ/mol | -285.8 | -393.5 | -283.0 |
①请写出煤的气化反应生成合成气(CO和H2)的热化学方程式
②在恒温、恒容的反应器中,能表明上述反应达到平衡状态的是
a.混合气体平均相对分子质量不再改变
b.气体压强不再改变
c.各气体浓度相等
d.反应体系中温度保持不变
e.断裂氢氧键速率是断裂氢氢键速率的2倍
f.混合气体密度不变
g.单位时间内,消耗水的质量与生成氢气的质量比为9:1
⑵在催化剂作用下合成气合成甲烷过程中会发生如下反应:
I CO(g)+3H2(g) = CH4(g)+H2O(g) △H1= -206 kJ/mol
II CO(g)+H2O(g) = CO2(g)+H2(g) △H2= -41 kJ/mol
Ⅲ 2CO(g)+2H2(g)= CH4(g)+CO2(g) △H 3= -247.4 kJ/mol
①图1是太原理工大学煤化工研究所利用热力学数据分析得到温度对反应ⅠInK(化学平衡常数K的自然对数)的曲线图,请分析出现这样趋势的原因是
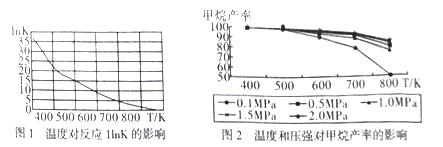
②提高甲烷反应选择性的关键因素是
在550~630K,1MPa的原因是
③850℃时在体积为5L反应器中发生反应Ⅱ,CO和H2O(g)浓度变化如图所示,请列式计算此条件下的平衡常数
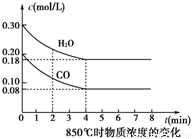
(3)CH4燃料电池利用率很高,装置中添加1L2mol/L的KOH溶液为电解质,持续缓慢通入标准状况下甲烷22.4L~33.6 L时负极电极反应为
您最近一年使用:0次
名校
4 . 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)甲烷—氧气燃料电池是一种清洁能源,该电池用金属铂片插入氢氧化钾溶液中作电极,在两极上分别通甲烷和氧气。其电极反应式分别为:负极_______________ ,正极______________ 。电池在放电过程中溶液的PH将___________ (填“降低”、“升高”或“不变”)。
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:CH4(g)+H2O(g)═CO(g)+3H2(g);△H=+206.2kJ·mol-1
CH4(g)+CO2(g)═2CO(g)+2H2(g);△H=+247.4kJ·mol-1
写出CH4(g)与H2O(g)反应生成CO2(g)和 H2(g)的热化学方程式为________________ 。
(1)甲烷—氧气燃料电池是一种清洁能源,该电池用金属铂片插入氢氧化钾溶液中作电极,在两极上分别通甲烷和氧气。其电极反应式分别为:负极
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:CH4(g)+H2O(g)═CO(g)+3H2(g);△H=+206.2kJ·mol-1
CH4(g)+CO2(g)═2CO(g)+2H2(g);△H=+247.4kJ·mol-1
写出CH4(g)与H2O(g)反应生成CO2(g)和 H2(g)的热化学方程式为
您最近一年使用:0次
名校
5 . (Ⅰ)50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出____________ 。

(2)在测定中和热的实验中,计算反应热时需要的数据有_________
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B. ①②③④ C. ②③④⑤ D. ①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热_________ (填“相等”或“不相等”),所放出的热量________ (填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会______ (填“偏大”、“偏小”或“无影响”).
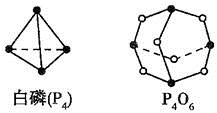
(Ⅱ)(5)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6 的分子结构如下图所示,现提供以下化学键的键能: :
: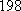 kJ·mol-1,
kJ·mol-1, :
: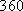 kJ·mol-1,
kJ·mol-1,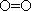 :
: kJ·mol-1,则反应P4(白磷) +3O2=P4O6的热化学反应方程式为
kJ·mol-1,则反应P4(白磷) +3O2=P4O6的热化学反应方程式为__________________ 。
(6)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJ•mol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式___________________ 。
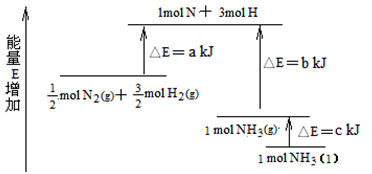
(7)化学反应N2+3H2 2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是
2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是______________ 。
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出

(2)在测定中和热的实验中,计算反应热时需要的数据有
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B. ①②③④ C. ②③④⑤ D. ①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会
(Ⅱ)(5)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6 的分子结构如下图所示,现提供以下化学键的键能:
 :
: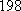 kJ·mol-1,
kJ·mol-1, :
: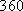 kJ·mol-1,
kJ·mol-1,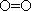 :
: kJ·mol-1,则反应P4(白磷) +3O2=P4O6的热化学反应方程式为
kJ·mol-1,则反应P4(白磷) +3O2=P4O6的热化学反应方程式为
(6)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJ•mol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式
(7)化学反应N2+3H2
 2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是
2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是
您最近一年使用:0次
2017-02-23更新
|
694次组卷
|
2卷引用:山西省运城市河津中学2019-2020学年高二9月月考化学试题
名校
6 . 已知1 mol白磷(s)转化为1 mol红磷,放出18.39 kJ热量,又知:
4P(白、s)+5O2(g)=2P2O5 (s) △H1①
4P(红、s)+5O2(g)=2P2O5 (s) △H2②
则△H1和△H2的关系正确的是:
4P(白、s)+5O2(g)=2P2O5 (s) △H1①
4P(红、s)+5O2(g)=2P2O5 (s) △H2②
则△H1和△H2的关系正确的是:
| A.△H1<△H2 | B.△H1>△H2 | C.△H1=△H2 | D.无法确定 |
您最近一年使用:0次
2017-02-23更新
|
142次组卷
|
3卷引用:山西省阳泉市盂县第三中学2021届高三上学期第一次月考化学试题
名校
解题方法
7 . 雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO 2CO2(g)+N2(g) △H<O
2CO2(g)+N2(g) △H<O
①反应的速率时间图像如图1所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图2所示.以下说法正确的是(填对应字母)__________
B.b1<b2
C.t1>t2
D.图2中阴影部分面积更大
E.图1中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号)__________
已知:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
2NO2(g) N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:__________ .
(3)CH4和H2O(g)在催化剂表面发生反应CH4+H2O⇌CO+3H2,该反应在不同温度下的化学平衡常数如表:
①该反应是__________ 反应(填“吸热”或“放热”).
②T℃时,向1L密闭容器中投入l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O CO+3H2的平衡常数K=
CO+3H2的平衡常数K=__________ ;
(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。__________
②电解后溶液的pH=__________ (忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是__________ L。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO
 2CO2(g)+N2(g) △H<O
2CO2(g)+N2(g) △H<O①反应的速率时间图像如图1所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图2所示.以下说法正确的是(填对应字母)

B.b1<b2
C.t1>t2
D.图2中阴影部分面积更大
E.图1中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号)
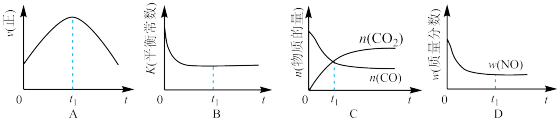
已知:CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol2NO2(g)
 N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:
(3)CH4和H2O(g)在催化剂表面发生反应CH4+H2O⇌CO+3H2,该反应在不同温度下的化学平衡常数如表:
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投入l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O
 CO+3H2的平衡常数K=
CO+3H2的平衡常数K=(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
②电解后溶液的pH=
③阳极产生气体的体积在标准状况下是
您最近一年使用:0次
2017-02-17更新
|
377次组卷
|
7卷引用:2016届山西省祁县中学高三5月月考理综化学试卷
名校
8 . 资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下:
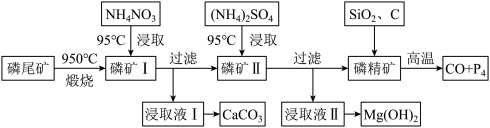
已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
(1)950℃煅烧磷尾矿生成气体的主要成分是_______ 。
(2)实验室过滤所需的玻璃仪器是_______ 。
(3)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是_______ 。
(4)在浸取液II中通入NH3,发生反应的化学方程式是_______ 。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
5CaO(s)+H3PO4(l)+HF(g)=Ca5(PO4)3F(s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_______ 。

已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C
 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4(1)950℃煅烧磷尾矿生成气体的主要成分是
(2)实验室过滤所需的玻璃仪器是
(3)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是
(4)在浸取液II中通入NH3,发生反应的化学方程式是
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
5CaO(s)+H3PO4(l)+HF(g)=Ca5(PO4)3F(s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是
您最近一年使用:0次
2017-02-17更新
|
211次组卷
|
3卷引用:2017届山西省晋商四校高三上11月联考化学试卷
名校
9 . 已知A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系。下列说法错误的是
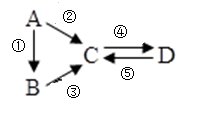

| A.若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染。则D转化成C的反应化学方程为3NO2+H2O=2HNO3+NO |
| B.若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化。在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H 1、△H 2、△H 3,则它们之间的关系为△H 2=△H 1+△H 3 |
C.若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,工业上用D制备A的化学方程式2Na2O(熔融) 4Na+O2↑ 4Na+O2↑ |
| D.若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种气态非金属单质,实验室保存D溶液的方法是加入适量铁粉与适量盐酸 |
您最近一年使用:0次
2017-02-17更新
|
1650次组卷
|
8卷引用:2017届山西省晋商四校高三上11月联考化学试卷
名校
10 . 通过乙醇制取氢气通常有如下两条途径:
a.CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g) ΔH1=+256.6 kJ·mol-1
b.2CH3CH2OH(g)+O2(g)=6H2(g)+4CO(g) ΔH2=+27.6 kJ·mol-1
则下列说法正确的是
a.CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g) ΔH1=+256.6 kJ·mol-1
b.2CH3CH2OH(g)+O2(g)=6H2(g)+4CO(g) ΔH2=+27.6 kJ·mol-1
则下列说法正确的是
| A.升高a的反应温度,乙醇的转化率增大 |
| B.由b可知:乙醇的燃烧热为13.8 kJ·mol-1 |
| C.2H2(g)+O2(g)=2H2O(g) ΔH=+485.6 kJ·mol-1 |
| D.制取等量的氢气,途径b消耗的能量更多 |
您最近一年使用:0次
2016-12-09更新
|
163次组卷
|
4卷引用:山西省运城市河津中学2019-2020学年高二9月月考化学试题



