名校
解题方法
1 . AlN新型材料应用前景广泛,其制备与性质研究成为热点。
相关数据如下:
(1)AlN的制备。
① 化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和NH3为原料制备AlN,反应的化学方程式是____________________ 。
Ⅱ.上述反应适宜的温度范围是______ ℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
② 铝粉直接氮化法。
Al与N2可直接化合为AlN固体,AlN能将Al包裹,反应难以继续进行。控制温度,在Al粉中均匀掺入适量Mg粉,可使Al几乎全部转化为AlN固体。该过程发生的反应有:__________________ 、_________ 和2Al + N2  2AlN。
2AlN。
③碳热还原法。
以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:ⅰ. 2Al2O3(s) ⇌ 4Al(g) + 3O2(g) ∆H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) ∆H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) ∆H 3 =-318 kJ·mol-1
运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:______________________________________ 。
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。
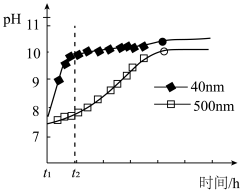
① AlN粉末水解的化学方程式是____________________________________ 。
② 解释t1-t2时间内两条曲线差异的可能原因:_______________________________ 。
(3)AlN含量检测。向a g AlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则样品中AlN的质量分数是________________________________ 。
相关数据如下:
| 物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 相应化合物分解温度/℃ |
| Al | 660 | 2467 | >800 | AlN:>2000 (>1400升华) AlCl3:(>181升华) |
| Mg | 649 | 1090 | >300 | Mg3N2:>800 |
① 化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和NH3为原料制备AlN,反应的化学方程式是
Ⅱ.上述反应适宜的温度范围是
a.75~100 b.600~1100 c.2000~2300
② 铝粉直接氮化法。
Al与N2可直接化合为AlN固体,AlN能将Al包裹,反应难以继续进行。控制温度,在Al粉中均匀掺入适量Mg粉,可使Al几乎全部转化为AlN固体。该过程发生的反应有:
 2AlN。
2AlN。③碳热还原法。
以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:ⅰ. 2Al2O3(s) ⇌ 4Al(g) + 3O2(g) ∆H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) ∆H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) ∆H 3 =-318 kJ·mol-1
运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。

① AlN粉末水解的化学方程式是
② 解释t1-t2时间内两条曲线差异的可能原因:
(3)AlN含量检测。向a g AlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则样品中AlN的质量分数是
您最近一年使用:0次
2020-01-23更新
|
325次组卷
|
4卷引用:北京市2020普通高中学业水平考试等级性抽样测试化学试题
2 . 偏二甲肼( )、肼(
)、肼( )和四氧化二氧(
)和四氧化二氧( )可作为运载火箭的推进剂。
)可作为运载火箭的推进剂。
(1)已知: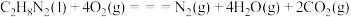



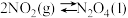

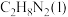 和
和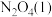 反应生成
反应生成 、
、 和
和 并放出大量热,写出该反应的热化学方程式(
并放出大量热,写出该反应的热化学方程式( 用含
用含 、
、 、
、 的代数式表示)
的代数式表示)__________ 。该反应______ (填“是”或“不是”)自发反应,判断的理由是_______ 。
(2)肼( )也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为
)也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为_________________________________ 。
(3)将4molN2O4放入2 L,恒容密闭容器中发生反应N2O4(g) 2NO2(g),平衡体系中N2O4的体积分数(
2NO2(g),平衡体系中N2O4的体积分数( )随温度的变化如图2所示
)随温度的变化如图2所示
①D点v(正)________ v(逆)(填“>”“=”或“<”)。
②A、B、C点中平衡常数K的值最大的是________ 点。 时,N2O4的平衡转化率为
时,N2O4的平衡转化率为________ ;若达平衡时间为5 s,则此时间内的 平均反应速率为
平均反应速率为________ 。
③若其条件不变,在 原平衡基础上,再加入一定量
原平衡基础上,再加入一定量 ,达到新平衡时,与原平衡相比,NO2的体积分数
,达到新平衡时,与原平衡相比,NO2的体积分数________ (填“增大”“不变”或“减小”)。
 )、肼(
)、肼( )和四氧化二氧(
)和四氧化二氧( )可作为运载火箭的推进剂。
)可作为运载火箭的推进剂。(1)已知:
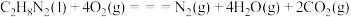



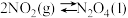

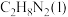 和
和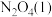 反应生成
反应生成 、
、 和
和 并放出大量热,写出该反应的热化学方程式(
并放出大量热,写出该反应的热化学方程式( 用含
用含 、
、 、
、 的代数式表示)
的代数式表示)(2)肼(
 )也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为
)也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为
(3)将4molN2O4放入2 L,恒容密闭容器中发生反应N2O4(g)
 2NO2(g),平衡体系中N2O4的体积分数(
2NO2(g),平衡体系中N2O4的体积分数( )随温度的变化如图2所示
)随温度的变化如图2所示①D点v(正)
②A、B、C点中平衡常数K的值最大的是
 时,N2O4的平衡转化率为
时,N2O4的平衡转化率为 平均反应速率为
平均反应速率为③若其条件不变,在
 原平衡基础上,再加入一定量
原平衡基础上,再加入一定量 ,达到新平衡时,与原平衡相比,NO2的体积分数
,达到新平衡时,与原平衡相比,NO2的体积分数
您最近一年使用:0次
2020-01-10更新
|
429次组卷
|
5卷引用:2020年天津市学业水平等级考适应性测试化学试题
2014高三·全国·专题练习
名校
解题方法
3 . 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为_________________________________ 。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
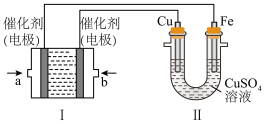
①a处应通入________ (填“CH4”或“O2”),b处电极上发生的电极反应式是__________________________________ 。
②电镀结束后,装置Ⅰ中溶液的pH________ (填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________ 。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________ (忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________ L(标准状况下)。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。

①a处应通入
②电镀结束后,装置Ⅰ中溶液的pH
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷
您最近一年使用:0次
2018-10-02更新
|
348次组卷
|
10卷引用:2014年高中化学苏教版选修四模块综合检测练习卷
(已下线)2014年高中化学苏教版选修四模块综合检测练习卷(已下线)2014年高中化学二轮创新训练上 专题8电化学原理练习卷2015-2016学年湖北孝感高级中学高二上期中测试化学试卷2015-2016学年福建师大附中高二下期中化学试卷河北省蠡县中学2018-2019学年高二上学期第一次(8月)月考化学试题河北省保定市蠡县中学2018-2019学年高二上学期9月月考化学试题贵州省三都水族自治县高级中学2019-2020学年高三上学期期末考试理综化学试题福建省莆田市仙游县枫亭中学2019-2020学年高二上学期期中考试(选考)化学试题河北省邯郸市永年区第一中学2020-2021学年高二上学期10月月考化学试题山东省威海市第二中学2023-2024学年高二上学期第一次月考(实验班)化学试题
名校
解题方法
4 . “低碳经济”正成为科学家研究的主要课题,为了减少空气中的温室气体,并且充分利用二氧化碳资源,科学家们设想了一系列捕捉和封存二氧化碳的方法。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH=-76.0kJ·mol-1
①上述反应中每生成1molFe3O4,转移电子的物质的量为_______ mol。
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1,则反应:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)的△H=__________ 。
(2)用氨水捕集烟气中的CO2生成铵盐是减少CO2排放的可行措施之一。
①分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图所示,若烟气中CO2的含量(体积分数)为12%,烟气通入氨水的流量为0.052 m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为____________ (精确到0.01)。
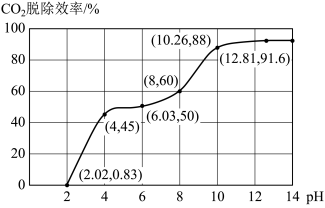
②通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是______________ 。
(3)一定条件下,Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示,回答下列问题:
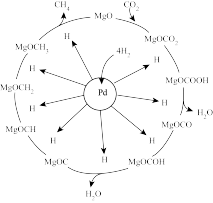
① 该反应的化学方程式为________________ ;反应过程中碳元素的化合价为-2价的中间体是_________ 。
② 向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1、H2:0.8mol·L-1、CH4:0.8mol·L-1、H2O:1.6mol·L-1,CO2的平衡转化率为_________________ ;300℃时上述反应的平衡常数K=___________________ 。
③已知该反应正反应放热,现有两个相同恒容绝热(与外界无热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molCO2和4molH2,在Ⅱ中充入1molCH4和2molH2O(g),300℃下开始反应。达到平衡时,下列说法正确的是________ (填字母):
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅱ中CH4的物质的量分数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH=-76.0kJ·mol-1
①上述反应中每生成1molFe3O4,转移电子的物质的量为
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1,则反应:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)的△H=
(2)用氨水捕集烟气中的CO2生成铵盐是减少CO2排放的可行措施之一。
①分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图所示,若烟气中CO2的含量(体积分数)为12%,烟气通入氨水的流量为0.052 m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为

②通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是
(3)一定条件下,Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示,回答下列问题:

① 该反应的化学方程式为
② 向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1、H2:0.8mol·L-1、CH4:0.8mol·L-1、H2O:1.6mol·L-1,CO2的平衡转化率为
③已知该反应正反应放热,现有两个相同恒容绝热(与外界无热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molCO2和4molH2,在Ⅱ中充入1molCH4和2molH2O(g),300℃下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅱ中CH4的物质的量分数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1。
您最近一年使用:0次
2018-04-13更新
|
367次组卷
|
3卷引用:2017-2018学年人教版选修4化学平衡之平衡状态的判断习题专项训练题
2011高二上·山东潍坊·学业考试
5 . Ⅰ.北京时间11月1日清晨5时58分07秒,中国“长征二号F”遥八运载火箭在酒泉卫星发射中心载人航天发射场点火发射,火箭的第三级使用的推进剂是液氢和液氧。
已知下面在298K时的热化学方程式:
2H2(g)+O2(g)=2H2O(l);ΔH=–571.6kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=–890.3kJ/mol
C(s)+O2(g)=CO2(g);ΔH=–393.5kJ/mol
根据上面的热化学方程式完成下列问题:
⑴通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是_________ 。
⑵根据以上反应,则C(s)+2H2(g)=CH4(g)的焓变ΔH=___________ 。
⑶已知H2O(l)=H2O(g);ΔH=+44.0kJ/mol
试写出甲烷燃烧生成二氧化碳和水蒸气时的热化学方程式:_____________________ 。
Ⅱ.据统计,发达国家每年由于金属腐蚀造成的直接损失约占全年国民生产总值的2%~4%,远远超出水灾、火灾、风灾、地震等自然灾害造成损失的总和。因此,了解金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
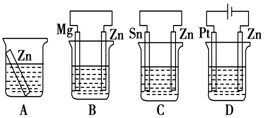
⑴分别放在以下装置(都盛有0.1mol/L的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是_____________ 。
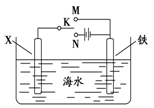
⑵利用下图装置,可以模拟铁的电化学防护。其中X为碳棒,为减缓铁的腐蚀,开关K应置于______ 处。若X为锌,开关K置于M处,该电化学防护法称为______________________ 。
已知下面在298K时的热化学方程式:
2H2(g)+O2(g)=2H2O(l);ΔH=–571.6kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=–890.3kJ/mol
C(s)+O2(g)=CO2(g);ΔH=–393.5kJ/mol
根据上面的热化学方程式完成下列问题:
⑴通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是
⑵根据以上反应,则C(s)+2H2(g)=CH4(g)的焓变ΔH=
⑶已知H2O(l)=H2O(g);ΔH=+44.0kJ/mol
试写出甲烷燃烧生成二氧化碳和水蒸气时的热化学方程式:
Ⅱ.据统计,发达国家每年由于金属腐蚀造成的直接损失约占全年国民生产总值的2%~4%,远远超出水灾、火灾、风灾、地震等自然灾害造成损失的总和。因此,了解金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
⑴分别放在以下装置(都盛有0.1mol/L的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是

⑵利用下图装置,可以模拟铁的电化学防护。其中X为碳棒,为减缓铁的腐蚀,开关K应置于

您最近一年使用:0次
2011高二·福建龙岩·学业考试
解题方法
6 . (1) 2010年10月1日下午18时59分57秒,中国探月二期工程先导星“嫦娥二号”在西昌点火升空,准确入轨。“嫦娥二号”所用燃料为液氢和液氧。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
H2(g)=H2(l) △H=-0.92kJ·mol-1 ;
O2(g)=O2(l) △H=-6.84kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式_______ ;
(2)美国的探月飞船“阿波罗号”使用的氢氧燃料电池,电解液为氢氧化钾溶液,其负极反应式为_______ ;
(3)设计方案实现2HCl+2Cu= CuCl2+H2↑反应,画出装置图_______ ;
(4)pH相同的四种电解质溶液:①Na2CO3 ②NaHCO3 ③CH3COONa ④ NaOH,
其物质的量浓度由大到小的顺序是(填编号)_______ 。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
H2(g)=H2(l) △H=-0.92kJ·mol-1 ;
O2(g)=O2(l) △H=-6.84kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式
(2)美国的探月飞船“阿波罗号”使用的氢氧燃料电池,电解液为氢氧化钾溶液,其负极反应式为
(3)设计方案实现2HCl+2Cu= CuCl2+H2↑反应,画出装置图
(4)pH相同的四种电解质溶液:①Na2CO3 ②NaHCO3 ③CH3COONa ④ NaOH,
其物质的量浓度由大到小的顺序是(填编号)
您最近一年使用:0次



