名校
解题方法
1 . 苯催化加氢制备环己烷是化工生产中的重要工艺,一定条件下,发生如下反应:
Ⅰ:主反应: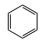 (g) + 3H2(g)⇌
(g) + 3H2(g)⇌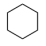 (g) ∆H1<0
(g) ∆H1<0
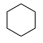
Ⅱ:副反应: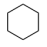 (g)⇌
(g)⇌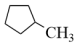 (g) ∆H2>0
(g) ∆H2>0
回答下列问题:
(1)已知:Ⅲ:2H2(g) + O2(g) = 2H2O(l) ∆H3
Ⅳ:2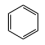 (g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
(g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
Ⅴ: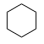 (g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
则∆H1=_______ (用∆H3、∆H4和∆H5表示)。
(2)有利于提高平衡体系中环己烷体积分数的措施有_______。
(3) 和
和 的燃烧热较大的是
的燃烧热较大的是_______ 。
(4)反应Ⅰ在管式反应器中进行,实际投料往往在n(H2):n(C6H6)=3:1的基础上适当增大H2用量,其目的是_______ 。
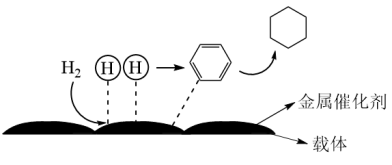
(5)氢原子和苯分子吸附在催化剂表面活性中心时,才能发生反应,机理如图。下列说法不正确的是_______
(6)当H2中混有微量H2S或CO等杂质时,会导致反应Ⅰ的产率降低,推测其可能原因为_______ 。
Ⅰ:主反应:
 (g) + 3H2(g)⇌
(g) + 3H2(g)⇌ (g) ∆H1<0
(g) ∆H1<0Ⅱ:副反应:
 (g)⇌
(g)⇌ (g) ∆H2>0
(g) ∆H2>0回答下列问题:
(1)已知:Ⅲ:2H2(g) + O2(g) = 2H2O(l) ∆H3
Ⅳ:2
 (g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
(g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4Ⅴ:
 (g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5则∆H1=
(2)有利于提高平衡体系中环己烷体积分数的措施有_______。
| A.适当升温 | B.适当降温 | C.适当加压 | D.使用高效催化剂 |
 和
和 的燃烧热较大的是
的燃烧热较大的是(4)反应Ⅰ在管式反应器中进行,实际投料往往在n(H2):n(C6H6)=3:1的基础上适当增大H2用量,其目的是
(5)氢原子和苯分子吸附在催化剂表面活性中心时,才能发生反应,机理如图。下列说法不正确的是_______

| A.此反应(苯催化加氢制备环己烷)的原子利用率为100% |
| B.反应过程中,有H—H、C=C键的断裂和C—H键的生成 |
| C.载体可以增大金属催化剂的表面积,提高催化效率 |
| D.该催化剂可有效提高反应物的平衡转化率 |
您最近一年使用:0次
2021-11-06更新
|
120次组卷
|
2卷引用:湖北省沙市中学2021-2022学年高二上学期期中考试化学试题
解题方法
2 . 利用磷石膏废渣(主要成分为 )生产硫酸可实现硫资源的循环利用.回答下列问题:
)生产硫酸可实现硫资源的循环利用.回答下列问题:
硫黄分解磷石膏工艺涉及的主要反应为:
(I)

(II)

(1)对于反应(I),下列化学反应速率最大的是______
A. B.
B.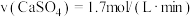
C.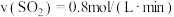 D.
D.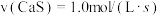
(2)反应 =
=  的
的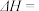
______  ;
;
(3)在恒温恒容密闭容器中只进行反应(I),能说明其已达到平衡状态的是______ (填字母).
A.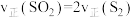 B.气体中含硫原子总数不随时间变化
B.气体中含硫原子总数不随时间变化
C.容器内固体总质量不再随时间变化 D.容器内气体总压强不再随时间变化
(4)在恒温恒容密闭容器中进行的反应(II)达到平衡时,向容器中( 、
、 、
、 均足量)再充入少量
均足量)再充入少量 ,达到新平衡后,与原平衡相比
,达到新平衡后,与原平衡相比
____ (填“增大”“减小”或“不变”),原因为_____ .
 )生产硫酸可实现硫资源的循环利用.回答下列问题:
)生产硫酸可实现硫资源的循环利用.回答下列问题:硫黄分解磷石膏工艺涉及的主要反应为:
(I)


(II)


(1)对于反应(I),下列化学反应速率最大的是
A.
 B.
B.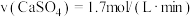
C.
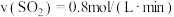 D.
D.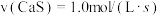
(2)反应
 =
=  的
的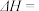
 ;
;(3)在恒温恒容密闭容器中只进行反应(I),能说明其已达到平衡状态的是
A.
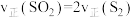 B.气体中含硫原子总数不随时间变化
B.气体中含硫原子总数不随时间变化C.容器内固体总质量不再随时间变化 D.容器内气体总压强不再随时间变化
(4)在恒温恒容密闭容器中进行的反应(II)达到平衡时,向容器中(
 、
、 、
、 均足量)再充入少量
均足量)再充入少量 ,达到新平衡后,与原平衡相比
,达到新平衡后,与原平衡相比
您最近一年使用:0次
2021-10-28更新
|
341次组卷
|
3卷引用:2021年湖北高考化学试题变式题11-19
3 . 二氧化碳加氢合成甲醇是化学固碳的一种有效途径,不仅可以有效减少空气中的 排放,而且还能制备出甲醇清洁能源。反应如下:
排放,而且还能制备出甲醇清洁能源。反应如下:
Ⅰ.

 和
和 还可发生副反应生成CO,反应如下:
还可发生副反应生成CO,反应如下:
Ⅱ.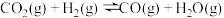

回答下列问题:
(1)已知相关化学键的键能数据如下:
由此计算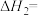
_______  。
。
(2)我国学者结合实验与计算机模拟结果,研究了 与
与 在
在 催化剂表面生成
催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。

①该反应历程中最大的活化能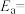
_______ eV。
②后续的反应历程可简化为 (*表示催化剂活性位点),
(*表示催化剂活性位点), ,_______。
,_______。 ,
, 。请补充历程中横线上发生的化学反应方程式
。请补充历程中横线上发生的化学反应方程式_______ 。
(3)当 和
和 的投料比为1∶3在不同的催化剂
的投料比为1∶3在不同的催化剂 条件下反应相同的时间,
条件下反应相同的时间, 选择性和CO选择性随着
选择性和CO选择性随着 转化率的变化如图所示:(已知
转化率的变化如图所示:(已知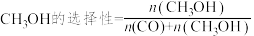 、
、 )
)

①由图可知,催化效果Cat.2_______ (填“优于”或“劣于”)Cat.1。
②若温度升高, 的转化率增大,则
的转化率增大,则 选择性降低的可能原因是
选择性降低的可能原因是_______ 。
(4)若电解质溶液为酸性,甲醇燃料电池的阳极反应式为_______ ,电池工作一段时间后,电解质溶液的pH_______ (填“增大”“不变”或“减小”)。
 排放,而且还能制备出甲醇清洁能源。反应如下:
排放,而且还能制备出甲醇清洁能源。反应如下:Ⅰ.


 和
和 还可发生副反应生成CO,反应如下:
还可发生副反应生成CO,反应如下:Ⅱ.
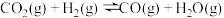

回答下列问题:
(1)已知相关化学键的键能数据如下:
| 化学键 |  |  |  |  |  |
 | 436 | 343 | 1076 | 465 | 413 |
由此计算
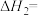
 。
。(2)我国学者结合实验与计算机模拟结果,研究了
 与
与 在
在 催化剂表面生成
催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
①该反应历程中最大的活化能
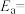
②后续的反应历程可简化为
 (*表示催化剂活性位点),
(*表示催化剂活性位点), ,_______。
,_______。 ,
, 。请补充历程中横线上发生的化学反应方程式
。请补充历程中横线上发生的化学反应方程式(3)当
 和
和 的投料比为1∶3在不同的催化剂
的投料比为1∶3在不同的催化剂 条件下反应相同的时间,
条件下反应相同的时间, 选择性和CO选择性随着
选择性和CO选择性随着 转化率的变化如图所示:(已知
转化率的变化如图所示:(已知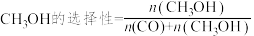 、
、 )
)
①由图可知,催化效果Cat.2
②若温度升高,
 的转化率增大,则
的转化率增大,则 选择性降低的可能原因是
选择性降低的可能原因是(4)若电解质溶液为酸性,甲醇燃料电池的阳极反应式为
您最近一年使用:0次
2021-10-28更新
|
451次组卷
|
4卷引用:湖北省名校教研联盟2022届高三上学期10月联考化学试题
湖北省名校教研联盟2022届高三上学期10月联考化学试题湖北省黄冈市蕲春县第四高级中学2021-2022学年上学期高三11月月考化学试题湖南省三湘名校教育联盟2021-2022学年高三上学期第一次大联考化学试题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习
4 . I. 丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:正丁烷(C4H10)脱氢制
1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)=C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ O2(g)=C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)=C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
(1)反应①的ΔH1为________ kJ·mol-1。
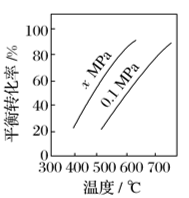
(2)如图是反应①平衡转化率与反应温度及压强的关系图,x_____ (填“大于”或“小于”)0.1;
(3)欲使丁烯的平衡产率提高,应采取的措施是___(填标号)。
II.向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) yC(g);△H<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
yC(g);△H<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
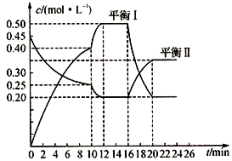
(4)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)=_______ ;
(5)根据图示可确定x:y=______________ ;
(6)0~l0min容器内压强______________ (填“变大”,“不变”或“变小”)
(7)推测第l0min引起曲线变化的反应条件可能是___________ (填序号);第16 min引起曲线变化的反应条件可能是______________ (填序号);
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)=C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+
 O2(g)=C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)=C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1③H2(g)+
 O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
O2(g)=H2O(g) ΔH3=-242 kJ·mol-1(1)反应①的ΔH1为
(2)如图是反应①平衡转化率与反应温度及压强的关系图,x

(3)欲使丁烯的平衡产率提高,应采取的措施是___(填标号)。
| A.升高温度 | B.降低温度 | C.增大压强 | D.降低压强 |
II.向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)
 yC(g);△H<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
yC(g);△H<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
(4)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)=
(5)根据图示可确定x:y=
(6)0~l0min容器内压强
(7)推测第l0min引起曲线变化的反应条件可能是
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
您最近一年使用:0次
名校
解题方法
5 . 目前我国分别在治理大气污染和新能源使用上都取得长足的进步。
(1)在大气污染治理上,目前我国计划在“十二五”期间用甲烷还原氮氧化物(NOx),使其排放量减少10%。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为___________
(2)在新能源使用上,正在研究利用甲烷合成甲醇这个清洁能源。该反应为:CH4(g) + H2O(g) CH3OH(g) + H2(g) △H>0,将一定量的CH4和一定量H2O(g)通入10L容器中,若改变起始量,CH4的平衡转化率如图所示:
CH3OH(g) + H2(g) △H>0,将一定量的CH4和一定量H2O(g)通入10L容器中,若改变起始量,CH4的平衡转化率如图所示:
①假设100 ℃时若按甲投料反应达到平衡所需的时间为5 min,则用甲烷表示该反应的平均反应速率为___________ 。
②在不改变其他外界条件下α1、α2、α3的相对大小顺序为:___________ 。
③欲提高CH4转化率且不改变该反应的平衡常数的方法是___________ (填字母序号)。
A.c(CH4)增大 B.分离出产品CH3OH
C.升高温度 D.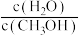 比值增大 E.容器体积缩小一半
比值增大 E.容器体积缩小一半
④下列图象对该反应表达正确的是:___________ 。
A. B.
B.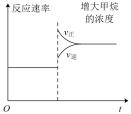 C.
C. D.
D.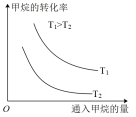
(1)在大气污染治理上,目前我国计划在“十二五”期间用甲烷还原氮氧化物(NOx),使其排放量减少10%。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
(2)在新能源使用上,正在研究利用甲烷合成甲醇这个清洁能源。该反应为:CH4(g) + H2O(g)
 CH3OH(g) + H2(g) △H>0,将一定量的CH4和一定量H2O(g)通入10L容器中,若改变起始量,CH4的平衡转化率如图所示:
CH3OH(g) + H2(g) △H>0,将一定量的CH4和一定量H2O(g)通入10L容器中,若改变起始量,CH4的平衡转化率如图所示:| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(CH4)/ mol | 5 | 4 | 10 |
| n(H2O)/ mol | 10 | 8 | 10 | |
| CH4的平衡转化率 / % | α1=50% | α2 | α3 | |
②在不改变其他外界条件下α1、α2、α3的相对大小顺序为:
③欲提高CH4转化率且不改变该反应的平衡常数的方法是
A.c(CH4)增大 B.分离出产品CH3OH
C.升高温度 D.
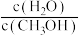 比值增大 E.容器体积缩小一半
比值增大 E.容器体积缩小一半④下列图象对该反应表达正确的是:
A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
2021-10-22更新
|
225次组卷
|
3卷引用:湖北省罗田第一中学2021-2022学年高二10月月考化学试题
6 . I. 已知:H2O2可看作二元弱酸。
(1)请写出H2O2与Ba(OH)2溶液反应生成的酸式盐的电子式________________ 。
某兴趣小组分析H2O2的催化分解原理。
(2)I-催化H2O2分解的原理分为两步,总反应可表示为:2H2O2(aq)=2H2O(l)+O2(g) △H<0,若第一步反应的热化学方程式为:H2O2(aq)+I-(aq)=IO-(aq)+H2O(l) △H>0 慢反应,则第二步反应的热化学方程式为:___________ △H <0 快反应
(3)能正确表示I-催化H2O2分解原理的示意图为______ 。

II. 丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图,主反应为丙烷脱氢反应,副反应为丙烷裂解反应
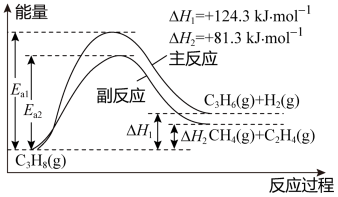
已知主反应:v正= k正p(C3H8),v逆= k逆p(C3H6)·p(H2)。
其中v正、v逆 为正、逆反应速率,k正、k逆为速率常数,p为各组分的分压。
(4)下表中为各物质的燃烧热,计算丙烯的燃烧热为△H =______ kJ·mol-1。
副反应丙烷裂解制乙烯的过程中,其原子利用率为_______ (保留三位有效数字)。
(5)在T1、T2、T3不同温度下,向体积为1L的恒容密闭容器中充入1molC3H8,开始时容器的压强分别为p1、p2、p3,仅发生主反应,丙烷转化率(α)随时间(t)的变化关系如图所示:
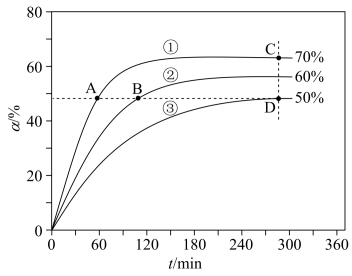
①A、B、D三点中,k正/k逆 值最大的是_________ ,
②A、B、C、D四点中,v逆 最大的是_________ 。
(1)请写出H2O2与Ba(OH)2溶液反应生成的酸式盐的电子式
某兴趣小组分析H2O2的催化分解原理。
(2)I-催化H2O2分解的原理分为两步,总反应可表示为:2H2O2(aq)=2H2O(l)+O2(g) △H<0,若第一步反应的热化学方程式为:H2O2(aq)+I-(aq)=IO-(aq)+H2O(l) △H>0 慢反应,则第二步反应的热化学方程式为:
(3)能正确表示I-催化H2O2分解原理的示意图为

II. 丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图,主反应为丙烷脱氢反应,副反应为丙烷裂解反应

已知主反应:v正= k正p(C3H8),v逆= k逆p(C3H6)·p(H2)。
其中v正、v逆 为正、逆反应速率,k正、k逆为速率常数,p为各组分的分压。
(4)下表中为各物质的燃烧热,计算丙烯的燃烧热为△H =
| H2 | CH4 | C2H4 | |
| △H /kJ·mol—1 | -285.8 | -890.3 | -1411.0 |
副反应丙烷裂解制乙烯的过程中,其原子利用率为
(5)在T1、T2、T3不同温度下,向体积为1L的恒容密闭容器中充入1molC3H8,开始时容器的压强分别为p1、p2、p3,仅发生主反应,丙烷转化率(α)随时间(t)的变化关系如图所示:

①A、B、D三点中,k正/k逆 值最大的是
②A、B、C、D四点中,v逆 最大的是
您最近一年使用:0次
2021-10-21更新
|
599次组卷
|
3卷引用:2021年湖北高考化学试题变式题11-19
解题方法
7 . 雾霾严重影响人们的生活,汽车尾气的排放是造成雾霾天气的重要原因之一、已知汽车尾气排放时容易发生以下反应:
①

②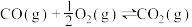
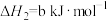
③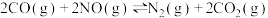
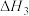
请回答下列问题:
(1)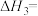
___________  (用含a、b的代数式表示)。
(用含a、b的代数式表示)。
(2)能说明反应③已达平衡状态的标志是___________(填字母)。
(3)在一定温度下,向体积为
 的恒容密闭容器中充入一定量的
的恒容密闭容器中充入一定量的 和
和 ,发生反应③。在
,发生反应③。在 时刻达到平衡,此时
时刻达到平衡,此时 ,
,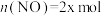 ,
, ,则
,则 的平衡转化率为
的平衡转化率为___________ (用含x、y的代数式表示);再向容器中充入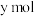
 和
和
 ,则此时
,则此时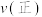
___________ 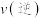 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
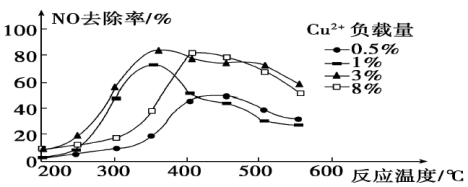
(4)烟气中也含有氮氧化物, 可用于烟气脱硝。为研究温度、催化剂中
可用于烟气脱硝。为研究温度、催化剂中 负载量对
负载量对 去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的
去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的 去除率,应选择的反应温度约为
去除率,应选择的反应温度约为___________ , 负载量为
负载量为___________ 。
①


②
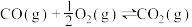
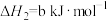
③
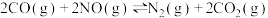
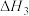
请回答下列问题:
(1)
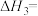
 (用含a、b的代数式表示)。
(用含a、b的代数式表示)。(2)能说明反应③已达平衡状态的标志是___________(填字母)。
A.单位时间内生成  的同时消耗了 的同时消耗了  |
| B.在恒温恒容的容器中,混合气体的密度保持不变 |
| C.在绝热恒容的容器中,反应的平衡常数不再变化 |
D.在恒温恒压的容器中, 的体积分数保持不变 的体积分数保持不变 |

 的恒容密闭容器中充入一定量的
的恒容密闭容器中充入一定量的 和
和 ,发生反应③。在
,发生反应③。在 时刻达到平衡,此时
时刻达到平衡,此时 ,
,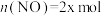 ,
, ,则
,则 的平衡转化率为
的平衡转化率为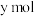
 和
和
 ,则此时
,则此时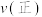
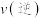 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。(4)烟气中也含有氮氧化物,
 可用于烟气脱硝。为研究温度、催化剂中
可用于烟气脱硝。为研究温度、催化剂中 负载量对
负载量对 去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的
去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的 去除率,应选择的反应温度约为
去除率,应选择的反应温度约为 负载量为
负载量为
您最近一年使用:0次
8 . 甲醚又称二甲醚,被誉为“21世纪的清洁燃料”。由合成气( 、
、 )制备二甲醚的反应原理如下:
)制备二甲醚的反应原理如下:
①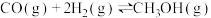

②

回答下列问题:
(1)若由合成气( 、
、 )制备
)制备
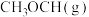 ,且生成
,且生成 ,整个过程中放出的热量为
,整个过程中放出的热量为 ,则
,则
______  。【已知:
。【已知: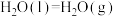
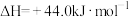 】
】
(2)有人模拟该制备原理,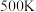 时,在
时,在 的密闭容器中充入
的密闭容器中充入
 和
和
 ,
, 达到平衡,平衡时
达到平衡,平衡时 的转化率为60%,
的转化率为60%, ,用
,用 表示反应①的速率是
表示反应①的速率是______  ,可逆反应②的平衡常数
,可逆反应②的平衡常数
______ 。若在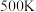 时,测得容器中
时,测得容器中 ,此时反应②的
,此时反应②的
______  (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数 值变小,下列说法正确的是___________。
值变小,下列说法正确的是___________。
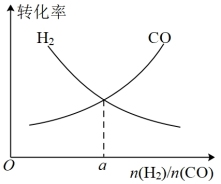
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入 和
和 进行反应①,平衡时
进行反应①,平衡时 和
和 的转化率如图所示,则
的转化率如图所示,则
___________ (填数值)。
(5)甲醇液相脱水法制二甲醚的原理是: ,
, ,与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是
,与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是___________ 。
 、
、 )制备二甲醚的反应原理如下:
)制备二甲醚的反应原理如下:①
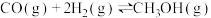

②


回答下列问题:
(1)若由合成气(
 、
、 )制备
)制备
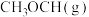 ,且生成
,且生成 ,整个过程中放出的热量为
,整个过程中放出的热量为 ,则
,则
 。【已知:
。【已知: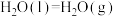
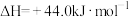 】
】(2)有人模拟该制备原理,
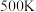 时,在
时,在 的密闭容器中充入
的密闭容器中充入
 和
和
 ,
, 达到平衡,平衡时
达到平衡,平衡时 的转化率为60%,
的转化率为60%, ,用
,用 表示反应①的速率是
表示反应①的速率是 ,可逆反应②的平衡常数
,可逆反应②的平衡常数
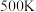 时,测得容器中
时,测得容器中 ,此时反应②的
,此时反应②的
 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数
 值变小,下列说法正确的是___________。
值变小,下列说法正确的是___________。| A.在平衡移动过程中逆反应速率先增大后减小 |
B.容器中 的体积分数增大 的体积分数增大 |
| C.容器中混合气体的平均相对分子质量减小 |
| D.达到新平衡后体系的压强增大 |
 和
和 进行反应①,平衡时
进行反应①,平衡时 和
和 的转化率如图所示,则
的转化率如图所示,则

(5)甲醇液相脱水法制二甲醚的原理是:
 ,
, ,与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是
,与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是
您最近一年使用:0次
解题方法
9 . 氢能是理想的清洁能源,资源丰富。以太阳能为热源分解 ,经由热化学铁氧化合物循环分解水制
,经由热化学铁氧化合物循环分解水制 的过程如下:
的过程如下:
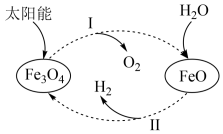
(1)过程Ⅰ:

①过程Ⅰ需要将 不断分离出去,目的是
不断分离出去,目的是______ 。
②平衡常数K随温度变化的关系是______ 。
③一定温度下,在容积可变的密闭容器中,该反应已达平衡,下列说法不正确的是______ 。
A.升高温度,容器内气体密度变大
B.容器内气体密度和相对分子质量都不再改变
C.向容器中通入 ,
, 转化率不变
转化率不变
D.缩小容器的容积, 的浓度变大
的浓度变大
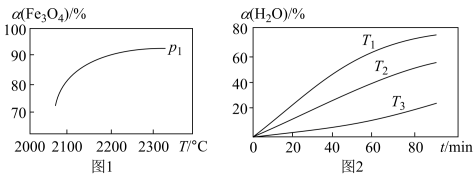
④在压强 下,
下, 的平衡转化率随温度变化的曲线如图1所示。若将压强由
的平衡转化率随温度变化的曲线如图1所示。若将压强由 增大到
增大到 ,在图1中画出
,在图1中画出 的
的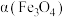 ~
~ 曲线示意图
曲线示意图______ 。
(2)已知 的燃烧热是
的燃烧热是 ,则液态水通过过程Ⅱ转化的热化学方程式为
,则液态水通过过程Ⅱ转化的热化学方程式为___________ 。
(3)其他条件不变时,过程Ⅱ在不同温度下, 的转化率随时间的变化
的转化率随时间的变化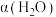 ~
~ 曲线如图2所示。温度
曲线如图2所示。温度 、
、 、
、 由大到小的关系是
由大到小的关系是______ 。
(4)科研人员研制出透氧膜( ),它允许电子、
),它允许电子、 同时透过,可实现水连续分解制
同时透过,可实现水连续分解制 。工作时,
。工作时, 、
、 分别在透氧膜的两侧反应。工作原理示意图如下:
分别在透氧膜的两侧反应。工作原理示意图如下:
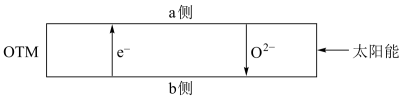
 在
在___________ 侧反应(填“ ”或“
”或“ ”),另一侧的电极反应式是
”),另一侧的电极反应式是___________ 。
 ,经由热化学铁氧化合物循环分解水制
,经由热化学铁氧化合物循环分解水制 的过程如下:
的过程如下:
(1)过程Ⅰ:


①过程Ⅰ需要将
 不断分离出去,目的是
不断分离出去,目的是②平衡常数K随温度变化的关系是
③一定温度下,在容积可变的密闭容器中,该反应已达平衡,下列说法不正确的是
A.升高温度,容器内气体密度变大
B.容器内气体密度和相对分子质量都不再改变
C.向容器中通入
 ,
, 转化率不变
转化率不变D.缩小容器的容积,
 的浓度变大
的浓度变大④在压强
 下,
下, 的平衡转化率随温度变化的曲线如图1所示。若将压强由
的平衡转化率随温度变化的曲线如图1所示。若将压强由 增大到
增大到 ,在图1中画出
,在图1中画出 的
的 ~
~ 曲线示意图
曲线示意图
(2)已知
 的燃烧热是
的燃烧热是 ,则液态水通过过程Ⅱ转化的热化学方程式为
,则液态水通过过程Ⅱ转化的热化学方程式为(3)其他条件不变时,过程Ⅱ在不同温度下,
 的转化率随时间的变化
的转化率随时间的变化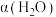 ~
~ 曲线如图2所示。温度
曲线如图2所示。温度 、
、 、
、 由大到小的关系是
由大到小的关系是(4)科研人员研制出透氧膜(
 ),它允许电子、
),它允许电子、 同时透过,可实现水连续分解制
同时透过,可实现水连续分解制 。工作时,
。工作时, 、
、 分别在透氧膜的两侧反应。工作原理示意图如下:
分别在透氧膜的两侧反应。工作原理示意图如下:
 在
在 ”或“
”或“ ”),另一侧的电极反应式是
”),另一侧的电极反应式是
您最近一年使用:0次
10 . 工业生产硫酸中,SO2的催化氧化是关键步骤,排放处理未达标的尾气会产生严重的空气污染。回答下列问题:
(1)SO2是形成酸雨的污染物之一,酸雨的pH范围是___________ 。
(2)已知:①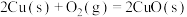
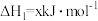
②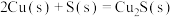
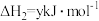
③
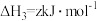
写出Cu2S和O2反应生成 和SO2的热化学方程式
和SO2的热化学方程式___________ 。
(3)硫酸工业中涉及反应: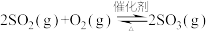
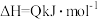 。一定条件下,在恒压密闭容器中,通入2 molSO2和1 mol O2发生上述反应,
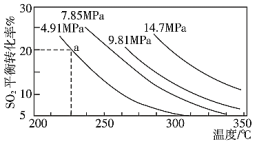
。一定条件下,在恒压密闭容器中,通入2 molSO2和1 mol O2发生上述反应, 的平衡转化率和压强、温度的关系如图所示。a点时该反应的压强平衡常数Kp=
的平衡转化率和压强、温度的关系如图所示。a点时该反应的压强平衡常数Kp=___________ (保留三位有效数字,已知:分压=气体总压强×该气体的物质的量分数,用各气体物质的分压替代浓度计算的平衡常数叫压强平衡常数)。恒压条件下,关于该反应的下列说法中正确的是___________ 。
A.Q大于0
B.相同时间内生成0.2 mol SO2,同时消耗0.1 mol O2,反应达到平衡
C.相同温度下压强越大,SO2的转化率就越大,该反应的平衡常数就越大
D.反应达到平衡后,保持温度不变,再充入2 mol SO2和1 mol O2,SO2的平衡转化率不变
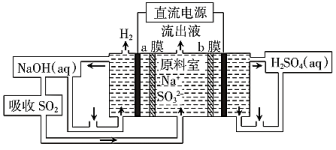
(4)用如图装置回收SO2,可制得硫酸,电极均为惰性电极,a、b膜分别为阳离子、阴离子交换膜,写出阴极的电极反应式___________ 。当阴极收集到标准状况下的H2 44.8 L时,理论上在阳极能得到___________ gH2SO4。
(1)SO2是形成酸雨的污染物之一,酸雨的pH范围是
(2)已知:①
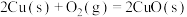
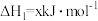
②
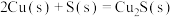
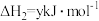
③

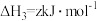
写出Cu2S和O2反应生成
 和SO2的热化学方程式
和SO2的热化学方程式(3)硫酸工业中涉及反应:
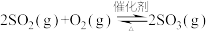
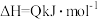 。一定条件下,在恒压密闭容器中,通入2 molSO2和1 mol O2发生上述反应,
。一定条件下,在恒压密闭容器中,通入2 molSO2和1 mol O2发生上述反应, 的平衡转化率和压强、温度的关系如图所示。a点时该反应的压强平衡常数Kp=
的平衡转化率和压强、温度的关系如图所示。a点时该反应的压强平衡常数Kp=
A.Q大于0
B.相同时间内生成0.2 mol SO2,同时消耗0.1 mol O2,反应达到平衡
C.相同温度下压强越大,SO2的转化率就越大,该反应的平衡常数就越大
D.反应达到平衡后,保持温度不变,再充入2 mol SO2和1 mol O2,SO2的平衡转化率不变
(4)用如图装置回收SO2,可制得硫酸,电极均为惰性电极,a、b膜分别为阳离子、阴离子交换膜,写出阴极的电极反应式

您最近一年使用:0次



