解题方法
1 . 砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)AsH3通入AgNO3溶液中可生成Ag、As2O3和HNO3,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(2)改变0.1 mol·L-1三元弱酸H3AsO4溶液的pH,溶液中的H3AsO4、H2AsO 、HAsO
、HAsO 及AsO
及AsO 的物质的量分布分数随pH的变化如图所示:
的物质的量分布分数随pH的变化如图所示:
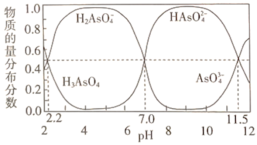
①lgKa1(H3AsO4)=_______ ;用甲基橙作指示剂,用NaOH溶液滴定H3AsO4发生的主要反应的离子方程式为_______ 。
②反应H2AsO4-+AsO
 2HAsO
2HAsO 的lgK=
的lgK=_______ 。
(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g) ∆H1=a kJ·mol-1
As2O3(g)+3C(s)= As4(g)+3CO(g) ∆H2=b kJ·mol-1
As4(g)+3CO(g) ∆H2=b kJ·mol-1
则反应4As(g) As4(g)的∆H=
As4(g)的∆H=_______ kJ·mol-1(用含a、b的代数式表示)。
(4)反应2As2S3(s) 4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
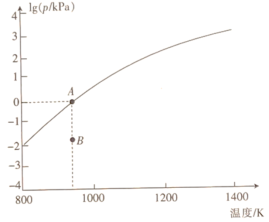
①对应温度下,B点的反应速率v(正)_______ v(逆)(填“>”“<”或“=”)。
②A点处,AsS(g)的分压为_______ kPa,该反应的Kp=_______ kPa5(Kp为以分压表示的平衡常数)。
(1)AsH3通入AgNO3溶液中可生成Ag、As2O3和HNO3,该反应中氧化剂与还原剂的物质的量之比为
(2)改变0.1 mol·L-1三元弱酸H3AsO4溶液的pH,溶液中的H3AsO4、H2AsO
 、HAsO
、HAsO 及AsO
及AsO 的物质的量分布分数随pH的变化如图所示:
的物质的量分布分数随pH的变化如图所示:
①lgKa1(H3AsO4)=
②反应H2AsO4-+AsO

 2HAsO
2HAsO 的lgK=
的lgK=(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g) ∆H1=a kJ·mol-1
As2O3(g)+3C(s)=
 As4(g)+3CO(g) ∆H2=b kJ·mol-1
As4(g)+3CO(g) ∆H2=b kJ·mol-1则反应4As(g)
 As4(g)的∆H=
As4(g)的∆H=(4)反应2As2S3(s)
 4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
①对应温度下,B点的反应速率v(正)
②A点处,AsS(g)的分压为
您最近一年使用:0次
2 . 煤的综合利用包括煤的干馏、煤的气化、煤的液化等。煤的气化用于生产各种气体燃料,有利于提高煤的利用效率和环境保护,以水煤气为原料可以得到多种有机物;煤的液化产品将替代目前的石油,最常见的液化方法是煤生产CH3OH,CH3OH对优化终端能源结构具有重要的战略意义。
(1)煤的直接甲烷化反应为
 ,在不同含金催化剂条件下的反应历程如下图所示:
,在不同含金催化剂条件下的反应历程如下图所示:


催化煤的直接甲烷化效果较好的催化剂是___________ (填“AuF”或“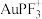 ”),该反应在
”),该反应在___________ (填“高温”或“低温”)下自发进行。
(2)煤的液化可以合成甲醇。已知
“气化”:

催化液化Ⅰ: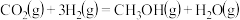

催化液化Ⅱ:

则反应
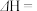
___________  。
。
(3)一定温度时,以水煤气为原料合成甲醇的反应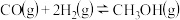 的平衡常数为
的平衡常数为 ,向恒容容器中充入2mol H2和1mol CO,反应达平衡状态时,甲醇的分压
,向恒容容器中充入2mol H2和1mol CO,反应达平衡状态时,甲醇的分压 ,则平衡时,混合气体中CH3OH的物质的量分数为
,则平衡时,混合气体中CH3OH的物质的量分数为___________ %(计算结果保留一位小数,Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数)。
(4)燃煤烟气脱硫的方法有多种。其中有种方法是用氨水将SO2转化为NH4HSO3,再氧化成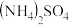 。已知常温下亚硫酸的电离常数
。已知常温下亚硫酸的电离常数 ,
, ,一水合氨的电离常数为
,一水合氨的电离常数为 。
。
①向混合液中通空气氧化的离子反应方程式:___
②关于NH4HSO3溶液,下列说法正确的是:__
A.NH4HSO3溶液呈酸性是因为
B.NH4HSO3溶液中
C.NH4HSO3溶液中
D.NH4HSO3溶液中
③常温下,若溶液中 时,溶液的pH=
时,溶液的pH=___ 。
(1)煤的直接甲烷化反应为

 ,在不同含金催化剂条件下的反应历程如下图所示:
,在不同含金催化剂条件下的反应历程如下图所示:

催化煤的直接甲烷化效果较好的催化剂是
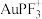 ”),该反应在
”),该反应在(2)煤的液化可以合成甲醇。已知
“气化”:


催化液化Ⅰ:
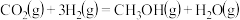

催化液化Ⅱ:


则反应

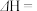
 。
。(3)一定温度时,以水煤气为原料合成甲醇的反应
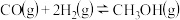 的平衡常数为
的平衡常数为 ,向恒容容器中充入2mol H2和1mol CO,反应达平衡状态时,甲醇的分压
,向恒容容器中充入2mol H2和1mol CO,反应达平衡状态时,甲醇的分压 ,则平衡时,混合气体中CH3OH的物质的量分数为
,则平衡时,混合气体中CH3OH的物质的量分数为(4)燃煤烟气脱硫的方法有多种。其中有种方法是用氨水将SO2转化为NH4HSO3,再氧化成
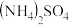 。已知常温下亚硫酸的电离常数
。已知常温下亚硫酸的电离常数 ,
, ,一水合氨的电离常数为
,一水合氨的电离常数为 。
。①向混合液中通空气氧化的离子反应方程式:
②关于NH4HSO3溶液,下列说法正确的是:
A.NH4HSO3溶液呈酸性是因为

B.NH4HSO3溶液中

C.NH4HSO3溶液中

D.NH4HSO3溶液中

③常温下,若溶液中
 时,溶液的pH=
时,溶液的pH=
您最近一年使用:0次
3 . 氮的化合物在生产实践及科学研究中应用广泛。
(1)利用甲烷催化还原氮氧化物。已知:
Ⅰ.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
Ⅱ.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
则反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)的△H为_______ 。
(2)在3.0L密闭容器中通入1molCH4和2mol NO2,在一定温度下进行反应Ⅱ,反应时间(t)与容器内气体总压强(P)的数据见下表:
该温度下的压强平衡常数Kp=_______ 。
(3)已知2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
第一步2NO(g)⇌N2O2(g)(快速平衡)
第二步N2O2(g)+O2(g)⇌2NO2(g)(慢反应)
用O2表示的速率方程为υ(O2)=k1•c2(NO)•c(O2),
用NO2表示的速率方程为υ(NO2)=k2•c2(NO)•c(O2),
k1与k2分别表示速率常数(与温度有关),则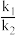 =
=_______ 。
(4)①25℃时,0.1mol/LNH4Cl溶液的pH为_______ (一水合氨Kb=1.8×10-5,lg1.8=0.26)。
②N2H4为二元弱碱,在水中的电离方程式与氨相似,25℃时,其第一步电离反应的平衡常数值为_______ (已知:N2H4+H+⇌N2H 的K=8.7×107;Kw=1.0×10-14)。
的K=8.7×107;Kw=1.0×10-14)。
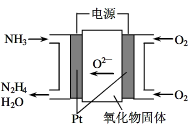
③工业上利用NH3制备联氨(N2H4)装置如图,试写出其阳极电极反应式:_______ 。
(1)利用甲烷催化还原氮氧化物。已知:
Ⅰ.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
Ⅱ.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
则反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)的△H为
(2)在3.0L密闭容器中通入1molCH4和2mol NO2,在一定温度下进行反应Ⅱ,反应时间(t)与容器内气体总压强(P)的数据见下表:
| 反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强P/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
该温度下的压强平衡常数Kp=
(3)已知2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
第一步2NO(g)⇌N2O2(g)(快速平衡)
第二步N2O2(g)+O2(g)⇌2NO2(g)(慢反应)
用O2表示的速率方程为υ(O2)=k1•c2(NO)•c(O2),
用NO2表示的速率方程为υ(NO2)=k2•c2(NO)•c(O2),
k1与k2分别表示速率常数(与温度有关),则
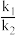 =
=(4)①25℃时,0.1mol/LNH4Cl溶液的pH为
②N2H4为二元弱碱,在水中的电离方程式与氨相似,25℃时,其第一步电离反应的平衡常数值为
 的K=8.7×107;Kw=1.0×10-14)。
的K=8.7×107;Kw=1.0×10-14)。③工业上利用NH3制备联氨(N2H4)装置如图,试写出其阳极电极反应式:

您最近一年使用:0次
4 . 2019年全球二氧化碳排放量预计增幅为0.6%,低于2017年的1.5%,以及2018年的2.1%,增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是用CO2转化为成为有机物实现碳循环。如:
C2H4(g)+H2O(l) C2H5OH(l) △H=-44.2kJ•mol-1
C2H5OH(l) △H=-44.2kJ•mol-1
2CO2(g)+2H2O(l) CH4(g)+3O2(g) △H=+1411.0kJ•mol-1
CH4(g)+3O2(g) △H=+1411.0kJ•mol-1
已知2CO2(g)+3H2O(l) C2H5OH(l)+3O2(g)其逆反应的活化能为EakJ•mol-1,则正反应的活化能为
C2H5OH(l)+3O2(g)其逆反应的活化能为EakJ•mol-1,则正反应的活化能为___ kJ•mol-1。
(2)利用工业废气中的CO2可以制取气态甲醇和水蒸气,一定条件下,往2L恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:
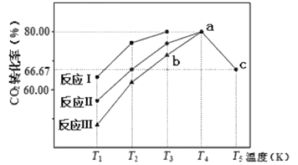
①三个反应中活化能最低的是___ (填“反应I”,“反应II”,“反应III”)。
②已知反应III在a点时已达平衡状态,则a点的平衡常数K=___ 。
③b点v(正)___ v(逆)(填“﹥”,“﹤”,“=”)。
④a点的转化率比c点高的原因可能是___ 。(写出一条即可)
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图所示:

①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式___ 。
②根据图示,写出总反应的化学方程式:___ 。
(1)一种途径是用CO2转化为成为有机物实现碳循环。如:
C2H4(g)+H2O(l)
 C2H5OH(l) △H=-44.2kJ•mol-1
C2H5OH(l) △H=-44.2kJ•mol-12CO2(g)+2H2O(l)
 CH4(g)+3O2(g) △H=+1411.0kJ•mol-1
CH4(g)+3O2(g) △H=+1411.0kJ•mol-1已知2CO2(g)+3H2O(l)
 C2H5OH(l)+3O2(g)其逆反应的活化能为EakJ•mol-1,则正反应的活化能为
C2H5OH(l)+3O2(g)其逆反应的活化能为EakJ•mol-1,则正反应的活化能为(2)利用工业废气中的CO2可以制取气态甲醇和水蒸气,一定条件下,往2L恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:

①三个反应中活化能最低的是
②已知反应III在a点时已达平衡状态,则a点的平衡常数K=
③b点v(正)
④a点的转化率比c点高的原因可能是
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图所示:

①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式
②根据图示,写出总反应的化学方程式:
您最近一年使用:0次
2021-03-10更新
|
212次组卷
|
3卷引用:2021年高考化学押题预测卷(湖北卷)03(含考试版、答题卡、参考答案、全解全析)
(已下线)2021年高考化学押题预测卷(湖北卷)03(含考试版、答题卡、参考答案、全解全析)辽宁省丹东市2021届高三下学期期初考试化学试题江苏省南京市第二十九中学2020--2021学年高二下学期阶段性测试化学试题
解题方法
5 . 氮及其化合物在生产和生活中应用广泛。回答下列问题:
(1)肼(N2H4)常用作火箭的燃料,其在工业生产一直沿用拉希法合成肼——以氨气和次氯酸钠为原料反应制得。
①写出该方法制备肼的化学方程式:______ 。
②已知298K和101kPa条件下:





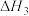
则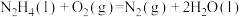 的
的
_______ (用含 、
、 和
和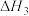 的代数式表示)。
的代数式表示)。
③N2H4的水溶液呈弱碱性,室温下其电离常数 ,则
,则 的N2H4水溶液pH等于
的N2H4水溶液pH等于_______ (忽略N2H4的二级电离和H2O的电离)。
(2)N2O5是一种新型的绿色硝化剂。F. Daniels等曾利用测压法在刚性反应器中研究了25℃时,N2O5 (g)分解反应:
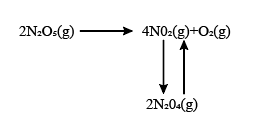
其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示[ 时,N2O5 (g)完全分解]:
时,N2O5 (g)完全分解]:
①研究表明,N2O5 (g)分解的反应速率 ,
, 时,测得体系中
时,测得体系中 ,则此时的
,则此时的
_______ kPa,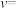
_______  。
。
②若升高反应温度至35℃,则N2O5 (g)完全分解后体系压强 (35℃)
(35℃)____ 63.1kPa(填“ ” “
” “ ”或“
”或“ ”),原因是
”),原因是___ 。
(3)NO氧化反应: 分两步进行,其反应历程能量变化如图所示。
分两步进行,其反应历程能量变化如图所示。
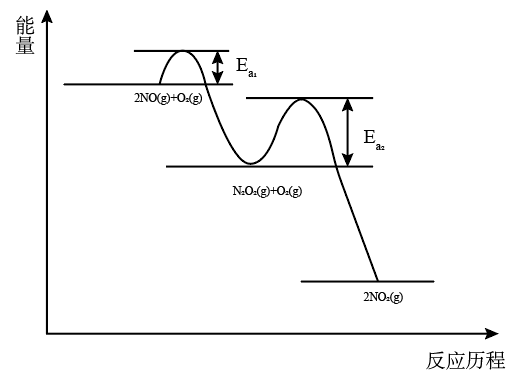
①写出决定NO氧化反应速率的化学方程式:_______ 。
②将物质的量分数为2m% NO(g)、m% O2(g)和q% He(g)的气体通入反应器,在温度T、压强p条件下进行反应。平衡时,若NO转化率为 ,则该反应平衡常数
,则该反应平衡常数
_______ (假设体系中无N2O4;以分压表示,分压 总压
总压 物质的量分数;用含p、m、a的代数式表示)。
物质的量分数;用含p、m、a的代数式表示)。
(1)肼(N2H4)常用作火箭的燃料,其在工业生产一直沿用拉希法合成肼——以氨气和次氯酸钠为原料反应制得。
①写出该方法制备肼的化学方程式:
②已知298K和101kPa条件下:





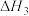
则
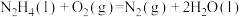 的
的
 、
、 和
和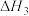 的代数式表示)。
的代数式表示)。③N2H4的水溶液呈弱碱性,室温下其电离常数
 ,则
,则 的N2H4水溶液pH等于
的N2H4水溶液pH等于(2)N2O5是一种新型的绿色硝化剂。F. Daniels等曾利用测压法在刚性反应器中研究了25℃时,N2O5 (g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示[
 时,N2O5 (g)完全分解]:
时,N2O5 (g)完全分解]:| t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 |  |
| p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①研究表明,N2O5 (g)分解的反应速率
 ,
, 时,测得体系中
时,测得体系中 ,则此时的
,则此时的
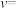
 。
。②若升高反应温度至35℃,则N2O5 (g)完全分解后体系压强
 (35℃)
(35℃) ” “
” “ ”或“
”或“ ”),原因是
”),原因是(3)NO氧化反应:
 分两步进行,其反应历程能量变化如图所示。
分两步进行,其反应历程能量变化如图所示。
①写出决定NO氧化反应速率的化学方程式:
②将物质的量分数为2m% NO(g)、m% O2(g)和q% He(g)的气体通入反应器,在温度T、压强p条件下进行反应。平衡时,若NO转化率为
 ,则该反应平衡常数
,则该反应平衡常数
 总压
总压 物质的量分数;用含p、m、a的代数式表示)。
物质的量分数;用含p、m、a的代数式表示)。
您最近一年使用:0次
解题方法
6 . CO2引起的气候变化已经引起了全世界的关注,但同时CO2也是时持续的碳资源,将CO2转化为高附加值的燃料或化学品不仅可以解决CO2的问题,还可变废为宝得到有用的化学品。CO2加氢制甲醇是实现这一过程的理想选择之一、
(1)CO2加氢制甲醇的化学方程式是:CO2(g)+3H2(g) CH3OH(l)+H2O(l) ∆H, 相关物质的燃烧热数据如下表所示:
CH3OH(l)+H2O(l) ∆H, 相关物质的燃烧热数据如下表所示:
回答下列问题:
①∆H=___________ kJ∙mol−1
②320℃时,将含CO2体积分数10%的空气与H2按体积比5:2投入到密闭容器中,同时加入催化剂发生反应(此时体系内各物质均为气态),测得初始时压强为P,反应一段时间后达到平衡,测得CO2的平衡转化率为50%,则平衡时体系的压强为___________ ,反应的平衡常数___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)Fujta等学者开展了在Cu/ZnO催化剂上进行CO2+H2合成甲醇机理的研究。机理如下:
①过程3的化学方程式为___________ ; 研究表明,过程3的活化能小但实际反应速率慢,是控速步骤,导致该步反应速率小的原因可能是___________ 。
A.H2O对该反应有阻碍作用 B. CO2的存在削弱了同一吸附位上H2的吸附
C.温度变化导致活化能增大 D.温度变化导致平衡常数减小
②ZnO也有催化作用,催化机理与Cu相似,CH3O−Zn与___________ 反应可获得CH3OH。
(3)科学家设计了一种新的CO2−H2O可循环系统,可以实现温室气体的零排放,同时也回避了H2的难储存问题,装置如下:
①系统中的能量转化形式有___________ 。
②b电极上的电极反应式为___________ ,如果将电解质溶液换为KOH溶液,对合成甲醇造成的不良后果是___________ 。
(1)CO2加氢制甲醇的化学方程式是:CO2(g)+3H2(g)
 CH3OH(l)+H2O(l) ∆H, 相关物质的燃烧热数据如下表所示:
CH3OH(l)+H2O(l) ∆H, 相关物质的燃烧热数据如下表所示:| 物质 | H2(g) | CH3OH(1) |
| 燃烧热△H (kJ∙mol−1) | −284 | −726 |
①∆H=
②320℃时,将含CO2体积分数10%的空气与H2按体积比5:2投入到密闭容器中,同时加入催化剂发生反应(此时体系内各物质均为气态),测得初始时压强为P,反应一段时间后达到平衡,测得CO2的平衡转化率为50%,则平衡时体系的压强为
(2)Fujta等学者开展了在Cu/ZnO催化剂上进行CO2+H2合成甲醇机理的研究。机理如下:
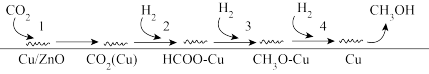
①过程3的化学方程式为
A.H2O对该反应有阻碍作用 B. CO2的存在削弱了同一吸附位上H2的吸附
C.温度变化导致活化能增大 D.温度变化导致平衡常数减小
②ZnO也有催化作用,催化机理与Cu相似,CH3O−Zn与
(3)科学家设计了一种新的CO2−H2O可循环系统,可以实现温室气体的零排放,同时也回避了H2的难储存问题,装置如下:
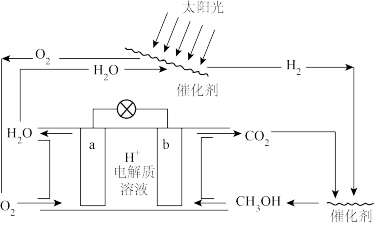
①系统中的能量转化形式有
②b电极上的电极反应式为
您最近一年使用:0次
2021-03-03更新
|
218次组卷
|
3卷引用:湖北省宜昌英杰学校2021-2022学年高三上学期10月月考化学试题
湖北省宜昌英杰学校2021-2022学年高三上学期10月月考化学试题新疆维吾尔自治区2021届高三第二次联考理科综合能力测试化学试卷(已下线)压轴题13 化学反应原理综合题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
7 . 碳的化合物在生产、生活中有着重要的作用。
(1)已知:2CO(g)+O2 (g)=2CO2 (g) △H1=-566kJ⋅mol-1
H2O(g)+CO(g)=H2 (g)+CO2 (g) △H2=-41kJ⋅mol-1
CO(g)+2H2 (g)=CH3 OH(g) △H3=-107kJ⋅mol-1
则2CO2 (g)+4H2 O(g)=2CH3 OH(g)+3O2 (g) △H=___________ kJ⋅mol-1
(2)T℃时,向容积为2L的恒容密闭容器中通入4.0molCO2和6.8molH2,发生反应:CO2 (g)+3H2 (g)⇌CH3 OH(g)+H2 O(g) △H=50kJ ⋅mol -1,5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:
①在0~5min内容器中v(H2)=___________ 。
②反应过程中,下列各项指标能表明A容器中反应的v正<v逆的是___________ (填标号)。
a.体系内的压强增大
b.气体的平均相对分子质量减小
c.H2 O(g)的物质的量增加
d.v正 (CO2)=v逆 (H2)
(3)T℃时,通入1.0 mol CO和3.0 mol H2于恒压密闭容器中,起始容积为2L,发生反应:CO(g)+2H2 (g)⇌CH3 OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:
①该温度下上述反应的平衡常数K=___________ ;
②若达平衡后,再充入1.0 mol CO、4.0 mol H2、1.0 mol CH3 OH,平衡___________ (填“向正反应方向”、“向逆反应方向”或“不”)移动。
(1)已知:2CO(g)+O2 (g)=2CO2 (g) △H1=-566kJ⋅mol-1
H2O(g)+CO(g)=H2 (g)+CO2 (g) △H2=-41kJ⋅mol-1
CO(g)+2H2 (g)=CH3 OH(g) △H3=-107kJ⋅mol-1
则2CO2 (g)+4H2 O(g)=2CH3 OH(g)+3O2 (g) △H=
(2)T℃时,向容积为2L的恒容密闭容器中通入4.0molCO2和6.8molH2,发生反应:CO2 (g)+3H2 (g)⇌CH3 OH(g)+H2 O(g) △H=50kJ ⋅mol -1,5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:
①在0~5min内容器中v(H2)=
②反应过程中,下列各项指标能表明A容器中反应的v正<v逆的是
a.体系内的压强增大
b.气体的平均相对分子质量减小
c.H2 O(g)的物质的量增加
d.v正 (CO2)=v逆 (H2)
(3)T℃时,通入1.0 mol CO和3.0 mol H2于恒压密闭容器中,起始容积为2L,发生反应:CO(g)+2H2 (g)⇌CH3 OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:
①该温度下上述反应的平衡常数K=
②若达平衡后,再充入1.0 mol CO、4.0 mol H2、1.0 mol CH3 OH,平衡
您最近一年使用:0次
名校
解题方法
8 . 甲醇是一种可再生能源,由CO2制备甲醇可能涉及的反应如下:
反应I:CO2(g)+3H2=CH3OH+H2O(g) ΔH1=-49.58 kJ·mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.77 kJ·mol-1
回答下列问题:
(1)反应Ⅲ的ΔH2=_______ ,若反应I、II、III平衡常数分别为K1、K2、K3,则K2=_______ (用K1、K3表示)。
(2)反应II自发进行的条件是_______ (填“低温”“高温”或“任意温度”)。
(3)在一定条件下,2L恒容密闭容器中充入3molH2和1.5molCO2,仅发生反应I,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如表所示。
①T_______ 500℃(填“<”“>”或“=”)
②温度为500℃时,该反应10min时达到平衡,则用H2表示的反应速率为_______ ,该温度下,反应I的平衡常数K1=_______ 。
(4)某研究小组将一定量的H2和CO2充入恒温密闭容器中,加入合适的催化剂(发生反应I、II、III),测得不同温度下体系达到平衡时,CO2的转化率和CH3OH的产率如图所示。
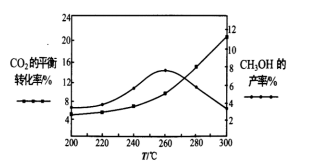
①该反应达到平衡后,为了同时提高反应速率和甲醇的产量,以下措施一定可行的是___ (填标号)。
a.升高温度 b.缩小容器体积 c.分离出甲醇 d.增加CO2浓度
②温度高于260℃时,随温度的升高甲醇产率下降的原因是_______ 。
反应I:CO2(g)+3H2=CH3OH+H2O(g) ΔH1=-49.58 kJ·mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.77 kJ·mol-1
回答下列问题:
(1)反应Ⅲ的ΔH2=
(2)反应II自发进行的条件是
(3)在一定条件下,2L恒容密闭容器中充入3molH2和1.5molCO2,仅发生反应I,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如表所示。
温度/℃ | 500 | T |
CO2的平衡转化率 | 60% | 40% |
①T
②温度为500℃时,该反应10min时达到平衡,则用H2表示的反应速率为
(4)某研究小组将一定量的H2和CO2充入恒温密闭容器中,加入合适的催化剂(发生反应I、II、III),测得不同温度下体系达到平衡时,CO2的转化率和CH3OH的产率如图所示。

①该反应达到平衡后,为了同时提高反应速率和甲醇的产量,以下措施一定可行的是
a.升高温度 b.缩小容器体积 c.分离出甲醇 d.增加CO2浓度
②温度高于260℃时,随温度的升高甲醇产率下降的原因是
您最近一年使用:0次
2021-02-23更新
|
273次组卷
|
3卷引用:湖北省武汉市武昌区2021届高三1月质量检测化学试题
解题方法
9 . 甲醇是一种重要的有机化工原料,在工业上有着重要的用途。
(1)已知:①C2H4(g)+H2O(g) = C2H5OH(g) △H1=-a kJ•mol−1
②2CH3OH(g) = CH3OCH3(g) +H2O(g) △H2=-b kJ•mol−1
③C2H5OH(g) = CH3OCH3(g) △H3=+c kJ•mol−1
请写出乙烯和水蒸气化合生成甲醇气体的热化学方程式:___________ 。
(2)若在体积为 的恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)+3H2(g)
的恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),二氧化碳的平衡转化率和温度的关系如下图A曲线所示。
CH3OH(g)+H2O(g),二氧化碳的平衡转化率和温度的关系如下图A曲线所示。
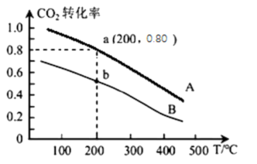
① 下列有关说法正确的是___________ 。
A.该反应为放热反应
B.B平衡曲线相对于A平衡曲线改变的条件为减小了容器的体积
C.当v正(CO2)=3 v逆(H2),该反应达到平衡状态
D.容器内压强和混合气体平均相对分子质量不变,均可以说明该反应达到平衡状态
② 计算a点该反应的化学平衡常数K=___________ L2/mol2(计算结果保留一位小数)。其他条件不变,向a点平衡体系中再充入0.4molCO2和0.4molH2O,则平衡___________ (填“正向”、“逆向”、或“不”)移动。
(3)若在T2℃、10 MPa条件下,往一密闭容器通入CO和H2合成甲醇[其中n(CO):n(H2)=1:2],其反应为:CO(g)+2H2(g) CH3OH(g),测得容器内总压强与反应时间的关系如图所示。
CH3OH(g),测得容器内总压强与反应时间的关系如图所示。
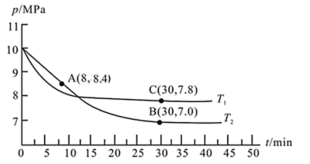
①T1___________ T2 (填“>”、“ <”或“=”)。
②在其他条件不变的情况下,测得T1℃时压强的变化曲线如图所示,则C点的正反应速率vC(正)与A点的逆反应速率vA(逆)的大小关系:vC(正)___________ vA(逆) (填“>”、“<”或“=”)。
③图中B点的压强平衡常数Kp=___________ Mpa−2.(Kp为压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(只需要列出计算式即可)
(1)已知:①C2H4(g)+H2O(g) = C2H5OH(g) △H1=-a kJ•mol−1
②2CH3OH(g) = CH3OCH3(g) +H2O(g) △H2=-b kJ•mol−1
③C2H5OH(g) = CH3OCH3(g) △H3=+c kJ•mol−1
请写出乙烯和水蒸气化合生成甲醇气体的热化学方程式:
(2)若在体积为
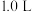 的恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)+3H2(g)
的恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),二氧化碳的平衡转化率和温度的关系如下图A曲线所示。
CH3OH(g)+H2O(g),二氧化碳的平衡转化率和温度的关系如下图A曲线所示。
① 下列有关说法正确的是
A.该反应为放热反应
B.B平衡曲线相对于A平衡曲线改变的条件为减小了容器的体积
C.当v正(CO2)=3 v逆(H2),该反应达到平衡状态
D.容器内压强和混合气体平均相对分子质量不变,均可以说明该反应达到平衡状态
② 计算a点该反应的化学平衡常数K=
(3)若在T2℃、10 MPa条件下,往一密闭容器通入CO和H2合成甲醇[其中n(CO):n(H2)=1:2],其反应为:CO(g)+2H2(g)
 CH3OH(g),测得容器内总压强与反应时间的关系如图所示。
CH3OH(g),测得容器内总压强与反应时间的关系如图所示。
①T1
②在其他条件不变的情况下,测得T1℃时压强的变化曲线如图所示,则C点的正反应速率vC(正)与A点的逆反应速率vA(逆)的大小关系:vC(正)
③图中B点的压强平衡常数Kp=
您最近一年使用:0次
解题方法
10 . 对碳的氧化物和氮的氧化物的无害化处理是人类面临的一个重大课题。回答下列问题:
(1)机动车尾气随意排放会造成CO、NO对大气的污染,尾气中CO、NO的含量是机动车年检的重要指标之一、已知热化学方程式如下:
I.2CO(g) +O2(g)= 2CO2(g) ΔH1= -556.0kJ·mol-1;
Ⅱ.N2(g) +O2(g)= 2NO(g) ΔH2= +180.5 kJ·mol-1 ;
Ⅲ.2NO(g) +2CO(g)=N2(g) +2CO2(g) ΔH3 。
①ΔH3 =___________ kJ·mol-1,若反应III的正反应的活化能为Ea kJ·mol-1 ,则其逆反应的活化能为___________ kJ·mol-1。
②在某容积为2.00L的密闭容器中按照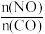 =1.00的比值充入一定量NO和CO混合物,在催化剂的作用下,NO的转化率与温度、压强的关系如下图:
=1.00的比值充入一定量NO和CO混合物,在催化剂的作用下,NO的转化率与温度、压强的关系如下图:
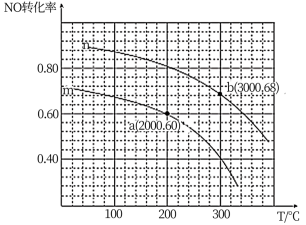
曲线n所代表的压强___________ (填“ >”或“<”)曲线m所代表的压强。测得a点对于反应容器体系中c(CO)=0.10 mol ·L-1,则该条件下容器体系中n(NO) =___________ mol,该温度下平衡常数K=___________ 。
(2)在容积为1.00 L的密闭容器中,充入4 mol H2和1 mol CO2,发生下列可逆反应:CO2(g) +4H2(g) CH4(g) +2H2O(g) ΔH,测得CO2的平衡转化率与温度(T)的对应关系如下表:
CH4(g) +2H2O(g) ΔH,测得CO2的平衡转化率与温度(T)的对应关系如下表:
则ΔH___________ (填“>”或“<”)0,写出提高CO2的平衡转化率的措施有______ (写出1条即可),测得250℃时,平衡体系压强为1.0 ×106 Pa,则平衡常数Kp=______ 。
(1)机动车尾气随意排放会造成CO、NO对大气的污染,尾气中CO、NO的含量是机动车年检的重要指标之一、已知热化学方程式如下:
I.2CO(g) +O2(g)= 2CO2(g) ΔH1= -556.0kJ·mol-1;
Ⅱ.N2(g) +O2(g)= 2NO(g) ΔH2= +180.5 kJ·mol-1 ;
Ⅲ.2NO(g) +2CO(g)=N2(g) +2CO2(g) ΔH3 。
①ΔH3 =
②在某容积为2.00L的密闭容器中按照
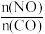 =1.00的比值充入一定量NO和CO混合物,在催化剂的作用下,NO的转化率与温度、压强的关系如下图:
=1.00的比值充入一定量NO和CO混合物,在催化剂的作用下,NO的转化率与温度、压强的关系如下图:
曲线n所代表的压强
(2)在容积为1.00 L的密闭容器中,充入4 mol H2和1 mol CO2,发生下列可逆反应:CO2(g) +4H2(g)
 CH4(g) +2H2O(g) ΔH,测得CO2的平衡转化率与温度(T)的对应关系如下表:
CH4(g) +2H2O(g) ΔH,测得CO2的平衡转化率与温度(T)的对应关系如下表:| T/℃ | 100 | 150 | 200 | 250 | 300 | 350 |
| 转化率/% | 0.64 | 0.58 | 0.53 | 0.50 | 0.48 | 0.47 |
您最近一年使用:0次



