解题方法
1 . 碳、氮及其化合物在工业生产等领域中有着重要应用,同时氮的氧化物也是造成空气污染的主要成分之一,降低其排放可以改善空气质量。
(1)已知:
Ⅰ.2H2(g)+O2(g)=2H2O(g)H1=-483.6kJ·mol-1
Ⅱ.N2(g)+O2(g) 2NO(g)H2=+180.5kJ·mol-1
2NO(g)H2=+180.5kJ·mol-1
Ⅲ.2H2(g)+2NO(g) N2(g)+2H2O(g)
N2(g)+2H2O(g)
①若反应Ⅲ的逆反应活化能为EakJ·mol-1,则正反应活化能为__ kJ·mol-1(用含Ea的式子表示)。
②我国学者在刚性容器中按投料比 =1发生反应Ⅲ,不同催化剂条件下,反应相同时间测得NO转化率与温度的关系如图。
=1发生反应Ⅲ,不同催化剂条件下,反应相同时间测得NO转化率与温度的关系如图。
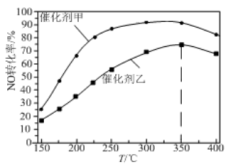
使用催化剂乙时,NO转化率随温度升高先增大后减小的可能原因是___ 。
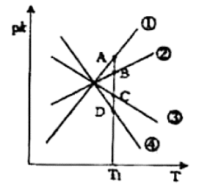
(2)CO还原法处理氮氧化物的原理为2CO(g)+2NO(g)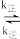 2CO2(g)+N2(g)∆H<0。实验测得v正=k正·c2(CO)·c2(NO),v逆=k逆·c2(CO2)·c(N2)(k正、k逆为速率常数,只与温度有关)。如图所示①②③④四条斜线中,能表示pk逆(pk=-lgk)随温度变化的斜线是
2CO2(g)+N2(g)∆H<0。实验测得v正=k正·c2(CO)·c2(NO),v逆=k逆·c2(CO2)·c(N2)(k正、k逆为速率常数,只与温度有关)。如图所示①②③④四条斜线中,能表示pk逆(pk=-lgk)随温度变化的斜线是___ ,图中A、B、C、D四点的纵坐标分别为a+2.5、a+0.5、a-0.5、a-2.5,则T1温度下,反应达到平衡时 =
=__ (填具体数字)。
(3)氨气可还原氮氧化物,工业上常利用反应N2(g)+3H2(g) 2NH3(g)∆H<0合成氨气,按照n(N2):n(H2)=1:3投料,发生合成氨反应,NH3的平衡体积分数φ(NH3)在不同压强下随温度变化如图所示。
2NH3(g)∆H<0合成氨气,按照n(N2):n(H2)=1:3投料,发生合成氨反应,NH3的平衡体积分数φ(NH3)在不同压强下随温度变化如图所示。

①900K时,反应的平衡常数Kp(p1)___ Kp(p2)。(填“<”、“=”、“>”)
②A点(700K,0.5MPa)时氮气的平衡转化率α(N2)=___ 。
(1)已知:
Ⅰ.2H2(g)+O2(g)=2H2O(g)H1=-483.6kJ·mol-1
Ⅱ.N2(g)+O2(g)
 2NO(g)H2=+180.5kJ·mol-1
2NO(g)H2=+180.5kJ·mol-1Ⅲ.2H2(g)+2NO(g)
 N2(g)+2H2O(g)
N2(g)+2H2O(g)①若反应Ⅲ的逆反应活化能为EakJ·mol-1,则正反应活化能为
②我国学者在刚性容器中按投料比
 =1发生反应Ⅲ,不同催化剂条件下,反应相同时间测得NO转化率与温度的关系如图。
=1发生反应Ⅲ,不同催化剂条件下,反应相同时间测得NO转化率与温度的关系如图。
使用催化剂乙时,NO转化率随温度升高先增大后减小的可能原因是
(2)CO还原法处理氮氧化物的原理为2CO(g)+2NO(g)
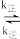 2CO2(g)+N2(g)∆H<0。实验测得v正=k正·c2(CO)·c2(NO),v逆=k逆·c2(CO2)·c(N2)(k正、k逆为速率常数,只与温度有关)。如图所示①②③④四条斜线中,能表示pk逆(pk=-lgk)随温度变化的斜线是
2CO2(g)+N2(g)∆H<0。实验测得v正=k正·c2(CO)·c2(NO),v逆=k逆·c2(CO2)·c(N2)(k正、k逆为速率常数,只与温度有关)。如图所示①②③④四条斜线中,能表示pk逆(pk=-lgk)随温度变化的斜线是 =
=
(3)氨气可还原氮氧化物,工业上常利用反应N2(g)+3H2(g)
 2NH3(g)∆H<0合成氨气,按照n(N2):n(H2)=1:3投料,发生合成氨反应,NH3的平衡体积分数φ(NH3)在不同压强下随温度变化如图所示。
2NH3(g)∆H<0合成氨气,按照n(N2):n(H2)=1:3投料,发生合成氨反应,NH3的平衡体积分数φ(NH3)在不同压强下随温度变化如图所示。
①900K时,反应的平衡常数Kp(p1)
②A点(700K,0.5MPa)时氮气的平衡转化率α(N2)=
您最近一年使用:0次
2 . 含氮化合物在生活、生产、研究领域至关重要。回答下列问题:已知:
Ⅰ.2H2(g)+O2(g) =2H2O(g) ΔH1=−483.6 kJ∙mol−1
Ⅱ.N2(g)+O2(g) 2NO(g) ΔH2=+180.5 kJ∙mol−1
2NO(g) ΔH2=+180.5 kJ∙mol−1
Ⅲ.2H2(g)+2NO(g) N2(g)+2H2O(g)
N2(g)+2H2O(g)
(1)反应Ⅲ的ΔH3=___________ kJ∙mol−1
(2)在恒温恒容的容器中发生反应Ⅲ。
①下列能够说明该反应已达到化学平衡状态的是___________ (填标号)。
A.2υ逆(NO)= υ正(N2)
B.混合气体的密度不再变化
C.容器内总压强不再变化
D.混合气体的平均相对分子质量不再变化
②反应Ⅲ的平衡常数表达式为:___________ 。
(3)如图所示的装置,电源为甲烷燃料电池,其电解质溶液是稀硫酸。X、Y 都是惰性电极。将电源接通后,向甲中滴入酚酞溶液,在 Fe 极附近显红色。试回答下列问题:
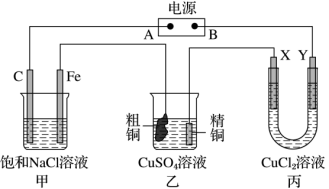
①在电源中,B 电极为___________ (填“正极”或“负极”);该极的电极反应是___________ 。
②甲装置中总的化学方程式是___________ 。
③丙装置在通电一段时间后,X 电极上发生的电极反应式是___________ 。
④如果乙装置中精铜电极的质量增加了 0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为___________ L。
Ⅰ.2H2(g)+O2(g) =2H2O(g) ΔH1=−483.6 kJ∙mol−1
Ⅱ.N2(g)+O2(g)
 2NO(g) ΔH2=+180.5 kJ∙mol−1
2NO(g) ΔH2=+180.5 kJ∙mol−1Ⅲ.2H2(g)+2NO(g)
 N2(g)+2H2O(g)
N2(g)+2H2O(g)(1)反应Ⅲ的ΔH3=
(2)在恒温恒容的容器中发生反应Ⅲ。
①下列能够说明该反应已达到化学平衡状态的是
A.2υ逆(NO)= υ正(N2)
B.混合气体的密度不再变化
C.容器内总压强不再变化
D.混合气体的平均相对分子质量不再变化
②反应Ⅲ的平衡常数表达式为:
(3)如图所示的装置,电源为甲烷燃料电池,其电解质溶液是稀硫酸。X、Y 都是惰性电极。将电源接通后,向甲中滴入酚酞溶液,在 Fe 极附近显红色。试回答下列问题:

①在电源中,B 电极为
②甲装置中总的化学方程式是
③丙装置在通电一段时间后,X 电极上发生的电极反应式是
④如果乙装置中精铜电极的质量增加了 0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为
您最近一年使用:0次
2021-05-05更新
|
116次组卷
|
2卷引用:湖北省鄂西北六校联考2020-2021学年高二下学期期中考试化学试题
解题方法
3 . 工业上用合成气(主要成分为CO、H2)制备二甲醚(CH3OCH3),涉及的主要反应如下:
Ⅰ.CO(g)+2H2(g) CH3OH(g)△H1=-90.8kJ·mol-1
CH3OH(g)△H1=-90.8kJ·mol-1
Ⅱ.2CH3OH(g) CH3OCH3(g)+H2O(g)△H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g)△H2=-23.5kJ·mol-1
(1)2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)△H3=
CH3OCH3(g)+H2O(g)△H3=__ kJ·mol-1。
(2)若在恒温恒容的密闭容器内只发生反应Ⅱ,可判断该反应已达到平衡状态的是__ (填标号)。
A.气体的平均摩尔质量保持不变
B.CH3OCH3浓度与H2O浓度相等
C.CH3OCH3的体积分数保持不变
D.2v(CH3OCH3)=v(CH3OH)
(3)T℃时,将2molCO和2molH2充入一恒容密闭容器内发生反应:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)。起始时,容器内压强为2×106Pa,平衡时总压减少了25%,H2的转化率为
CH3OCH3(g)+H2O(g)。起始时,容器内压强为2×106Pa,平衡时总压减少了25%,H2的转化率为__ ,该反应的平衡常数Kp=__ Pa-4(保留2位有效数字)。达到平衡后﹐欲增加CO的平衡转化率,可采取的措施有__ (填标号)。
A.再通入一定量的CO B.降低温度
C.及时移走CH3OCH3(g) D.通入氮气
(4)当压强为p时,在一密闭容器中充入一定量的CO和H2,测得不同温度下CO的平衡转化率及催化剂的催化效率如图所示。
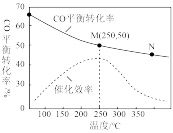
达到平衡后,增大压强,反应Ⅰ的平衡___ (填“向正反应方向”、“向逆反应方向”或“不”,下同)移动,反应Ⅱ的平衡___ 移动,故工业上选择___ (填“高压”或“低压”)制备二甲醚。工业生产中不选择350℃的原因是__ 。
Ⅰ.CO(g)+2H2(g)
 CH3OH(g)△H1=-90.8kJ·mol-1
CH3OH(g)△H1=-90.8kJ·mol-1Ⅱ.2CH3OH(g)
 CH3OCH3(g)+H2O(g)△H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g)△H2=-23.5kJ·mol-1(1)2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g)△H3=
CH3OCH3(g)+H2O(g)△H3=(2)若在恒温恒容的密闭容器内只发生反应Ⅱ,可判断该反应已达到平衡状态的是
A.气体的平均摩尔质量保持不变
B.CH3OCH3浓度与H2O浓度相等
C.CH3OCH3的体积分数保持不变
D.2v(CH3OCH3)=v(CH3OH)
(3)T℃时,将2molCO和2molH2充入一恒容密闭容器内发生反应:2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g)。起始时,容器内压强为2×106Pa,平衡时总压减少了25%,H2的转化率为
CH3OCH3(g)+H2O(g)。起始时,容器内压强为2×106Pa,平衡时总压减少了25%,H2的转化率为A.再通入一定量的CO B.降低温度
C.及时移走CH3OCH3(g) D.通入氮气
(4)当压强为p时,在一密闭容器中充入一定量的CO和H2,测得不同温度下CO的平衡转化率及催化剂的催化效率如图所示。

达到平衡后,增大压强,反应Ⅰ的平衡
您最近一年使用:0次
4 . 煤的综合利用包括煤的干馏、气化、液化等。煤的气化用于生产各种气体燃料,有利于环境保护和提高煤的利用效率;煤的液化产品将替代目前的石油,最常见的液化方法是用煤生产 ,对优化终端能源结构具有重要的战略意义。
,对优化终端能源结构具有重要的战略意义。
(1)工业上可利用煤气化后的产物CO或 来制备清洁液体燃料甲醇。已知:800
来制备清洁液体燃料甲醇。已知:800 时
时
反应Ⅰ:
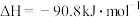
反应Ⅱ:
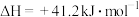
写出用 与
与 反应制备甲醇的热化学方程式:
反应制备甲醇的热化学方程式:___________ 。
①对于反应Ⅰ,在体积一定的密闭容器中按物质的量之比为1∶2充入CO和 ,测得平衡混合物中
,测得平衡混合物中 的体积分数在不同压强下随温度的变化情况如图所示。据此判断:
的体积分数在不同压强下随温度的变化情况如图所示。据此判断:
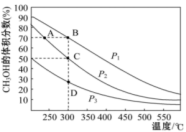
压强
___________ (填“ ”、“
”、“ ”或“
”或“ ”,下同)
”,下同) ;反应速率:
;反应速率: (状态A)
(状态A)___________  (状态B)。
(状态B)。
②对于反应Ⅱ,在体积一定的密闭容器中加入一定量的 和
和 进行反应。下列说法正确的是
进行反应。下列说法正确的是___________ 。
A.若该反应在恒容、绝热容器中进行,当容器中压强保持不变时表明反应达到平衡状态
B.该反应达到平衡时,向平衡体系中充入一定量的氦气,平衡可能发生移动
C.恒温恒容条件下,若改变反应物的投入量, 的值不发生变化
的值不发生变化
D.恒温恒容条件下,若投入气体的总量保持不变,设起始投料比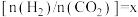 ,当
,当 或1/2时,
或1/2时, 的体积分数不变
的体积分数不变
(2)煤干馏产物焦炭常用于冶炼工业。已知反应①: ;反应②:
;反应②: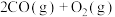
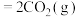 ,反应①、②的反应趋势与温度关系如图所示。
,反应①、②的反应趋势与温度关系如图所示。
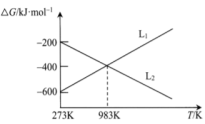
 对应反应是
对应反应是___________ ;当温度低于983K时,过量焦炭的氧化产物以为___________ 主。
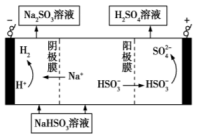
(3)燃煤烟道气常用 溶液充分吸收
溶液充分吸收 得到
得到 溶液,然后电解该溶液可制得硫酸。原理如图,写出电解时阳极的电极反应式
溶液,然后电解该溶液可制得硫酸。原理如图,写出电解时阳极的电极反应式___________ 。
 ,对优化终端能源结构具有重要的战略意义。
,对优化终端能源结构具有重要的战略意义。(1)工业上可利用煤气化后的产物CO或
 来制备清洁液体燃料甲醇。已知:800
来制备清洁液体燃料甲醇。已知:800 时
时反应Ⅰ:

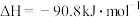
反应Ⅱ:

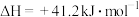
写出用
 与
与 反应制备甲醇的热化学方程式:
反应制备甲醇的热化学方程式:①对于反应Ⅰ,在体积一定的密闭容器中按物质的量之比为1∶2充入CO和
 ,测得平衡混合物中
,测得平衡混合物中 的体积分数在不同压强下随温度的变化情况如图所示。据此判断:
的体积分数在不同压强下随温度的变化情况如图所示。据此判断:
压强

 ”、“
”、“ ”或“
”或“ ”,下同)
”,下同) ;反应速率:
;反应速率: (状态A)
(状态A) (状态B)。
(状态B)。②对于反应Ⅱ,在体积一定的密闭容器中加入一定量的
 和
和 进行反应。下列说法正确的是
进行反应。下列说法正确的是A.若该反应在恒容、绝热容器中进行,当容器中压强保持不变时表明反应达到平衡状态
B.该反应达到平衡时,向平衡体系中充入一定量的氦气,平衡可能发生移动
C.恒温恒容条件下,若改变反应物的投入量,
 的值不发生变化
的值不发生变化D.恒温恒容条件下,若投入气体的总量保持不变,设起始投料比
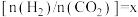 ,当
,当 或1/2时,
或1/2时, 的体积分数不变
的体积分数不变(2)煤干馏产物焦炭常用于冶炼工业。已知反应①:
 ;反应②:
;反应②: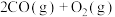
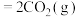 ,反应①、②的反应趋势与温度关系如图所示。
,反应①、②的反应趋势与温度关系如图所示。
 对应反应是
对应反应是(3)燃煤烟道气常用
 溶液充分吸收
溶液充分吸收 得到
得到 溶液,然后电解该溶液可制得硫酸。原理如图,写出电解时阳极的电极反应式
溶液,然后电解该溶液可制得硫酸。原理如图,写出电解时阳极的电极反应式
您最近一年使用:0次
5 .  重整技术是实现“碳中和”的一种理想的
重整技术是实现“碳中和”的一种理想的 利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下。
利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下。
主反应:

副反应:
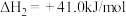
回答下列问题:
(1)已知 、
、 和
和 的燃烧热
的燃烧热 分别为
分别为 、
、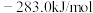 和
和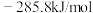 ,该催化重整主反应的
,该催化重整主反应的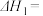
___________  。有利于提高
。有利于提高 平衡转化率的条件是
平衡转化率的条件是___________ (填标号)。
A. 高温高压 B. 高温低压 C. 低温高压 D. 低温低压
(2)在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。
分别等于1.0、1.5、2.0,且反应达到平衡状态。
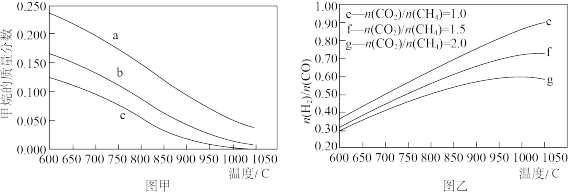
①甲烷的质量分数随温度变化的关系如图甲所示,曲线 对应的
对应的
___________ ;
②反应体系中,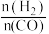 随温度变化的关系如图乙所示,随着进料比
随温度变化的关系如图乙所示,随着进料比 的增加,
的增加,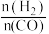 的值
的值___________ (填“增大”、“不变”或“减小”),其原因是___________ 。
(3)在 、
、 时,按投料比
时,按投料比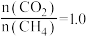 加入刚性密闭容器中,达平衡时甲烷的转化率为
加入刚性密闭容器中,达平衡时甲烷的转化率为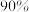 ,二氧化碳的转化率为
,二氧化碳的转化率为 ,则副反应的压强平衡常数
,则副反应的压强平衡常数
___________ (计算结果保留3位有效数字)。
(4)我国科学家设计了一种电解装置如图丙所示,能将二氧化碳转化成合成气 和
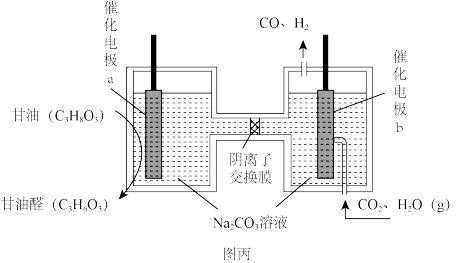
和 ,同时获得甘油醛。则催化电极
,同时获得甘油醛。则催化电极 为
为___________ 极,催化电极 产生
产生 的电极反应式为
的电极反应式为___________ 。
 重整技术是实现“碳中和”的一种理想的
重整技术是实现“碳中和”的一种理想的 利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下。
利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下。主反应:


副反应:

回答下列问题:
(1)已知
 、
、 和
和 的燃烧热
的燃烧热 分别为
分别为 、
、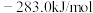 和
和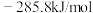 ,该催化重整主反应的
,该催化重整主反应的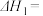
 。有利于提高
。有利于提高 平衡转化率的条件是
平衡转化率的条件是A. 高温高压 B. 高温低压 C. 低温高压 D. 低温低压
(2)在刚性密闭容器中,进料比
 分别等于1.0、1.5、2.0,且反应达到平衡状态。
分别等于1.0、1.5、2.0,且反应达到平衡状态。
①甲烷的质量分数随温度变化的关系如图甲所示,曲线
 对应的
对应的
②反应体系中,
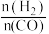 随温度变化的关系如图乙所示,随着进料比
随温度变化的关系如图乙所示,随着进料比 的增加,
的增加,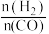 的值
的值(3)在
 、
、 时,按投料比
时,按投料比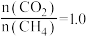 加入刚性密闭容器中,达平衡时甲烷的转化率为
加入刚性密闭容器中,达平衡时甲烷的转化率为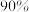 ,二氧化碳的转化率为
,二氧化碳的转化率为 ,则副反应的压强平衡常数
,则副反应的压强平衡常数
(4)我国科学家设计了一种电解装置如图丙所示,能将二氧化碳转化成合成气
 和
和 ,同时获得甘油醛。则催化电极
,同时获得甘油醛。则催化电极 为
为 产生
产生 的电极反应式为
的电极反应式为
您最近一年使用:0次
2021-04-24更新
|
857次组卷
|
6卷引用:湖北省武汉市2020-2021学年高三下学期4月质量检测化学试题
名校
解题方法
6 . CO2是目前大气中含量最高的一种温室气体,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%,CO2的综合利用是解决温室问题的有效途径。
已知l:CO2与CH4经催化重整制得合成气:CO2(g)+CH4(g) 2CO(g)+2H2(g)∆H
2CO(g)+2H2(g)∆H
(1)一定压强下,由最稳定单质生成1mol化合物的焓变为该物质的摩尔生成焓。已知CO2(g)、CH4(g)、CO(g)的摩尔生成焓分别为-395kJ·mol-1、-74.9kJ·mol-1、-110.4kJ·mol-1。则上述重整反应的△H=__ kJ·mol-1。
(2)CH4超干重整CO2技术可得到富含CO的气体,用于生产多种化工产品。目前科学家,研究CH4超干重整CO2的催化转化原理示意图如图:

该技术中的总化学反应方程式为:___ 。
(3)其他条件不变,在不同催化剂(I、II、III)作用下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。
2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。

a点所代表的状态___ (填“是”或“不是”)平衡状态;b点CH4的转化率高于c点原因:__ 。
(4)在一刚性密闭容器中,CH4和CO2的分压分别为16kPa、14kPa,加入Ni/a—Al2O3催化剂并加热至1123K使其发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①研究表明CO的生成速率v(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=8kPa,则p(CO2)=__ kPa,v(CO)=__ mol·g-1·s-1
②达到平衡后测得体系压强是起始时的1.4倍,则该反应的平衡常数Kp=__ (kPa)2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C。放电时该电池吸入CO2,其工作原理如图所示:正极的电极反应式为
2Na2CO3+C。放电时该电池吸入CO2,其工作原理如图所示:正极的电极反应式为___ 。

已知l:CO2与CH4经催化重整制得合成气:CO2(g)+CH4(g)
 2CO(g)+2H2(g)∆H
2CO(g)+2H2(g)∆H(1)一定压强下,由最稳定单质生成1mol化合物的焓变为该物质的摩尔生成焓。已知CO2(g)、CH4(g)、CO(g)的摩尔生成焓分别为-395kJ·mol-1、-74.9kJ·mol-1、-110.4kJ·mol-1。则上述重整反应的△H=
(2)CH4超干重整CO2技术可得到富含CO的气体,用于生产多种化工产品。目前科学家,研究CH4超干重整CO2的催化转化原理示意图如图:

该技术中的总化学反应方程式为:
(3)其他条件不变,在不同催化剂(I、II、III)作用下,反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。
2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。
a点所代表的状态
(4)在一刚性密闭容器中,CH4和CO2的分压分别为16kPa、14kPa,加入Ni/a—Al2O3催化剂并加热至1123K使其发生反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。①研究表明CO的生成速率v(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=8kPa,则p(CO2)=
②达到平衡后测得体系压强是起始时的1.4倍,则该反应的平衡常数Kp=
(5)我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2
 2Na2CO3+C。放电时该电池吸入CO2,其工作原理如图所示:正极的电极反应式为
2Na2CO3+C。放电时该电池吸入CO2,其工作原理如图所示:正极的电极反应式为
您最近一年使用:0次
2021-04-20更新
|
488次组卷
|
3卷引用:湖北省孝感市应城市第一高级中学2020-2021学年高二下学期5月综合检测化学试题
名校
解题方法
7 . 生产生活中氨及铵盐有重要用途,而汽车尾气中含NO、NO2则应降低其排放。
(1)已知(活化能单位 ):
):
则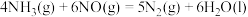 的
的
_______  。
。
(2)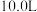 的密闭容器中,按物质的量比
的密闭容器中,按物质的量比 投入氮气和氢气,发生反应
投入氮气和氢气,发生反应 用传感器测得温度为
用传感器测得温度为 时容器中
时容器中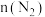 随时间变化如表:
随时间变化如表:
① 时,
时,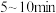 内
内 平均速率为
平均速率为
_______ ;
② 时,该反应平衡常数为
时,该反应平衡常数为_______ (列出计算式);
③x_______ 0.06(填“>”“<”或“=”),原因是_______ 。
④将 与
与 的混合气体置于绝热恒容密闭容器中发生反应,正反应速率随时间变化的趋势如图所示(催化剂活性始终保持不变),下列说法正确的是
的混合气体置于绝热恒容密闭容器中发生反应,正反应速率随时间变化的趋势如图所示(催化剂活性始终保持不变),下列说法正确的是_______ 。
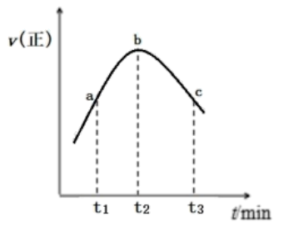
A.反应在b点达到平衡状态
B.从 到
到 逆反应的速率先增大后减小
逆反应的速率先增大后减小
C.a、b、c三点中,c点 的转化率最大
的转化率最大
D.如果将容器改为恒温恒容,其它条件不变,c点 的产率会变小
的产率会变小
(1)已知(活化能单位
 ):
):| 反应 | 正反应活化能 | 逆反应活化能 |
 | 282 | 102 |
 | a | b |
则
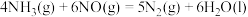 的
的
 。
。(2)
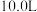 的密闭容器中,按物质的量比
的密闭容器中,按物质的量比 投入氮气和氢气,发生反应
投入氮气和氢气,发生反应 用传感器测得温度为
用传感器测得温度为 时容器中
时容器中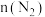 随时间变化如表:
随时间变化如表:物质的量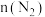 | 0 |  |  |  |  |
 |  | 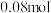 |  | 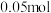 | 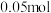 |
 |  | 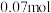 | _______ |  | 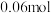 |
①
 时,
时,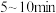 内
内 平均速率为
平均速率为
②
 时,该反应平衡常数为
时,该反应平衡常数为③x
④将
 与
与 的混合气体置于绝热恒容密闭容器中发生反应,正反应速率随时间变化的趋势如图所示(催化剂活性始终保持不变),下列说法正确的是
的混合气体置于绝热恒容密闭容器中发生反应,正反应速率随时间变化的趋势如图所示(催化剂活性始终保持不变),下列说法正确的是
A.反应在b点达到平衡状态
B.从
 到
到 逆反应的速率先增大后减小
逆反应的速率先增大后减小C.a、b、c三点中,c点
 的转化率最大
的转化率最大D.如果将容器改为恒温恒容,其它条件不变,c点
 的产率会变小
的产率会变小
您最近一年使用:0次
2021-04-16更新
|
209次组卷
|
2卷引用:湖北省恩施高中、龙泉中学、宜昌一中2020-2021学年高三下学期4月联合考试化学试题
8 . 氧族元素的单质及其化合物在工业生产和生活中有重要的应用,运用化学原理研究氧族元素的单质及其化合物有重要意义。回答下列问题:
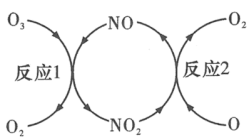
(1)臭氧层被破坏的反应过程如图所示,NO的作用是___________ 。已知:O3(g)+O(g)=2O2(g)∆H=-143kJ·mol-1、“反应1”:O3(g)+NO(g)=NO2(g)+O2(g)△H1=-200.2kJ·mol-1,写出“反应2”的热化学方程式___________ 。
(2)在恒温恒容密闭容器中,n(O3):n(SO2)=1:1投料发生如下反应:SO2(g)+O3(g) SO3(g)+O2(g)△H=-240.8kJ·mol-1,T1和T2(T1<T2)时SO2的转化率如图所示。
SO3(g)+O2(g)△H=-240.8kJ·mol-1,T1和T2(T1<T2)时SO2的转化率如图所示。
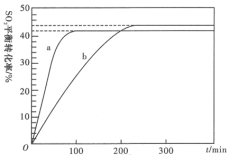
T1时,计算该反应的分压平衡常数Kp=___________ (结果保留小数点后两位)。恒温时增大SO2平衡转化率的措施是___________ (写一条)。
(3)在容积为1L的多个反应装置中,分别充入2molSO2和2molO3控制在不同温度下发生反应,经过相同反应时间t后剩余SO2的物质的量与温度的关系如图所示。
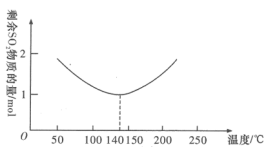
已知臭氧会转化成氧气:2O3(g) 3O2(g),在上述反应条件下臭氧分解率与温度关系如表:
3O2(g),在上述反应条件下臭氧分解率与温度关系如表:
①低于140℃,SO2的剩余量随温度升高减小的原因是___________ ;高于200℃,SO2的剩余量随着温度升高增大,除了升温平衡向吸热的逆向移动这一原因外,另一原因是___________ 。
②已知250℃时SO2(g)+O3(g) SO3(g)+O2(g)的平衡常数K=1,平衡时氧气的浓度c(O2)=
SO3(g)+O2(g)的平衡常数K=1,平衡时氧气的浓度c(O2)=___________ mol/L(结果保留小数点后两位)。
(1)臭氧层被破坏的反应过程如图所示,NO的作用是

(2)在恒温恒容密闭容器中,n(O3):n(SO2)=1:1投料发生如下反应:SO2(g)+O3(g)
 SO3(g)+O2(g)△H=-240.8kJ·mol-1,T1和T2(T1<T2)时SO2的转化率如图所示。
SO3(g)+O2(g)△H=-240.8kJ·mol-1,T1和T2(T1<T2)时SO2的转化率如图所示。
T1时,计算该反应的分压平衡常数Kp=
(3)在容积为1L的多个反应装置中,分别充入2molSO2和2molO3控制在不同温度下发生反应,经过相同反应时间t后剩余SO2的物质的量与温度的关系如图所示。

已知臭氧会转化成氧气:2O3(g)
 3O2(g),在上述反应条件下臭氧分解率与温度关系如表:
3O2(g),在上述反应条件下臭氧分解率与温度关系如表:| 温度/℃ | 50 | 100 | 150 | 200 | 250 | 300 |
| 分解率/% | 0 | 0 | 0 | 6 | 30 | 81 |
①低于140℃,SO2的剩余量随温度升高减小的原因是
②已知250℃时SO2(g)+O3(g)
 SO3(g)+O2(g)的平衡常数K=1,平衡时氧气的浓度c(O2)=
SO3(g)+O2(g)的平衡常数K=1,平衡时氧气的浓度c(O2)=
您最近一年使用:0次
名校
解题方法
9 . 乙二醇是一种重要的基本化工原料。煤制乙二醇的工艺流程如下:

(1)I中气化炉内的主要反应有:
i.
ii.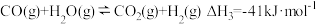
①写出CO2被C还原成CO的热化学反应方程式:_______ 。
②其他条件相同时,增大气化炉内水蒸气的分压P(混合气体中某气体的分压越大,表明其浓度越大),达到平衡时各组分的体积分数( )如下表所示。解释出现该变化趋势的可能原因是
)如下表所示。解释出现该变化趋势的可能原因是_______ 。
(2)II的总反应是4CO+4CH3OH+O2 2
2  +2H2O,该过程分两步进行。
+2H2O,该过程分两步进行。
第一步为CO与亚硝酸甲酯(CH3ONO)在Pd催化剂作用下发生反应:
第二步为常温常压下利用NO、CH3OH和O2进行的CH3ONO再生反应。
①第二步反应的化学方程式是_______ 。
②第一步反应的机理如下图所示,下列说法正确的是_______ (填字母序号)。
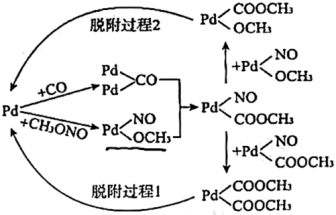
a. CH3ONO中氮氧双键在Pd表面断裂
b.脱附过程1生成了草酸二甲酯
c.脱附过程2生成了副产物碳酸二甲酯(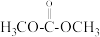 )
)
d.增大投料比[n(CO):n(CH3ONO)],可提高最终产物中草酸二甲酯的比率
③第一步反应时,若CO中混有少量H2,H2在Pd表面易形成PD-H中间体,结合第一步反应机理,推测因H2导致生成的副产物有_____ 、____ 。
(3)Ⅲ中,草酸二甲酯经过催化氢化可生成乙二醇和甲醇。理论上,该反应中n(草酸二甲酯):n (氢气)
___ 。

(1)I中气化炉内的主要反应有:
i.

ii.
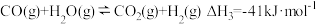
①写出CO2被C还原成CO的热化学反应方程式:
②其他条件相同时,增大气化炉内水蒸气的分压P(混合气体中某气体的分压越大,表明其浓度越大),达到平衡时各组分的体积分数(
 )如下表所示。解释出现该变化趋势的可能原因是
)如下表所示。解释出现该变化趋势的可能原因是 |  |  | 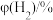 |
| 0.017 | 15.79 | 31.50 | 51.23 |
| 0.041 | 19.52 | 27.12 | 52.04 |
| 0.065 | 21.15 | 23.36 | 54.14 |
| 0.088 | 21.64 | 21.72 | 55.46 |
 2
2  +2H2O,该过程分两步进行。
+2H2O,该过程分两步进行。第一步为CO与亚硝酸甲酯(CH3ONO)在Pd催化剂作用下发生反应:

第二步为常温常压下利用NO、CH3OH和O2进行的CH3ONO再生反应。
①第二步反应的化学方程式是
②第一步反应的机理如下图所示,下列说法正确的是

a. CH3ONO中氮氧双键在Pd表面断裂
b.脱附过程1生成了草酸二甲酯
c.脱附过程2生成了副产物碳酸二甲酯(
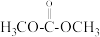 )
)d.增大投料比[n(CO):n(CH3ONO)],可提高最终产物中草酸二甲酯的比率
③第一步反应时,若CO中混有少量H2,H2在Pd表面易形成PD-H中间体,结合第一步反应机理,推测因H2导致生成的副产物有
(3)Ⅲ中,草酸二甲酯经过催化氢化可生成乙二醇和甲醇。理论上,该反应中n(草酸二甲酯):n (氢气)

您最近一年使用:0次
2021-04-10更新
|
719次组卷
|
4卷引用:湖北省武汉市汉阳一中2021届高三下学期三模化学试题
名校
10 . 二甲醚是一种重要的化工原料,回答下列问题:
(1)已知:①C(s)+ O2(g)=CO(g) ∆H1=-111. 8 kJ/mol;
O2(g)=CO(g) ∆H1=-111. 8 kJ/mol;
②C(s)+ H2O(g)=CO(g) +H2(g) ∆H2 =130 kJ/mol;
③CO(g)+ 2H2(g)=CH3OH(g) ∆H3=- 90.1 kJ/mol;
④2CH3OH(g)=CH3OCH3(g)+H2O(g) ∆H4= -134 kJ/mol。
则CH3OCH3(g)+ O2 (g)=2CO(g)+3H2(g) ∆H=
O2 (g)=2CO(g)+3H2(g) ∆H=______ kJ/mol;该反应能够自发进行所采用的有利条件是______ (填“高温”“低温”或“任意温度”)。
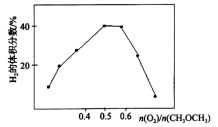
(2)在恒温恒压条件下,化工生产上利用二甲醚与氧气为原料制备合成气,实际生产过程中常常添加一定量的水蒸气,其目的是______ ;研究发现,所得平衡混合气体中H2的体积分数随n(O2)/n(CH3OCH3)变化如图所示,试解释该曲线先变大后减小的原因______ 。
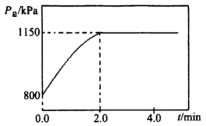
(3)某温度下,在VL的刚性容器中充入4.0molCH3OCH3、2.0molO2及2.0molH2O(g),在催化剂作用下仅发生反应CH3OCH3(g)+ O2(g)
O2(g) 2CO(g)+3H2(g),实验测得容器中压强与时间变化如图所示。则前2.0min内该反应速率v(CH3OCH3)=
2CO(g)+3H2(g),实验测得容器中压强与时间变化如图所示。则前2.0min内该反应速率v(CH3OCH3)=______ mol·min-1;该温度下其分压平衡常数Kp=______ (kPa)3.5(已知 =12.2)。
=12.2)。
(4)二甲醚燃料电池常采用磺酸类质子溶剂,其工作原理如图所示,则负极的电极反应式为______ ,若消耗标准状况下5.6LO2,则理论上左右两室溶液质量变化的差为______ g。

(1)已知:①C(s)+
 O2(g)=CO(g) ∆H1=-111. 8 kJ/mol;
O2(g)=CO(g) ∆H1=-111. 8 kJ/mol;②C(s)+ H2O(g)=CO(g) +H2(g) ∆H2 =130 kJ/mol;
③CO(g)+ 2H2(g)=CH3OH(g) ∆H3=- 90.1 kJ/mol;
④2CH3OH(g)=CH3OCH3(g)+H2O(g) ∆H4= -134 kJ/mol。
则CH3OCH3(g)+
 O2 (g)=2CO(g)+3H2(g) ∆H=
O2 (g)=2CO(g)+3H2(g) ∆H=(2)在恒温恒压条件下,化工生产上利用二甲醚与氧气为原料制备合成气,实际生产过程中常常添加一定量的水蒸气,其目的是

(3)某温度下,在VL的刚性容器中充入4.0molCH3OCH3、2.0molO2及2.0molH2O(g),在催化剂作用下仅发生反应CH3OCH3(g)+
 O2(g)
O2(g) 2CO(g)+3H2(g),实验测得容器中压强与时间变化如图所示。则前2.0min内该反应速率v(CH3OCH3)=
2CO(g)+3H2(g),实验测得容器中压强与时间变化如图所示。则前2.0min内该反应速率v(CH3OCH3)= =12.2)。
=12.2)。
(4)二甲醚燃料电池常采用磺酸类质子溶剂,其工作原理如图所示,则负极的电极反应式为

您最近一年使用:0次
2021-04-04更新
|
648次组卷
|
5卷引用:湖北省华大新高考联盟2021届高三下学期3月教学质量测评(全国卷)理综化学试题



