名校
解题方法
1 . 下列热化学方程式及有关应用的叙述中,正确的是
A.甲烷的燃烧热的 为 为 ,则甲烷燃烧的热化学方程式可表示为: ,则甲烷燃烧的热化学方程式可表示为: 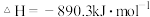 |
B.已知强酸与强碱在稀溶液里反应的中和热的 为 为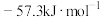 ,则 ,则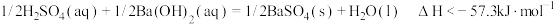 |
C. 、 、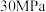 下,将 下,将 和 和 置于密闭的容器中充分反应生成 置于密闭的容器中充分反应生成 ,放热 ,放热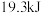 ,其热化学方程式为:N2(g)+3H2(g) ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) 2NH3(g) 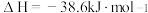 |
D.已知 、 、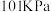 条件下: 条件下: 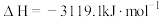 ,则 ,则 比 比 稳定 稳定 |
您最近一年使用:0次
2022-08-25更新
|
470次组卷
|
11卷引用:江西省宜春市万载中学2021-2022学年高一上学期第二次月考化学试题
江西省宜春市万载中学2021-2022学年高一上学期第二次月考化学试题湖南省衡阳市常宁五中2020届高三11月月考化学试题江西省宜春市奉新县第一中学2020届高三上学期第四次月考化学试题河北省衡水市第十四中学2019-2020学年高二上学期第三次调研考试化学试题(已下线)1.1.2 热化学方程式(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)辽宁省沈阳市法库县高级中学2020-2021学年高二9月月考化学试题(已下线)第9单元 化学反应中的能量变化(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷上海市进才中学2022-2023学年高二上学期10月阶段测试化学试题黑龙江省牡丹江市第一高级中学2022-2023学年高二10月月考化学试题广东省惠州市第一中学2022-2023学年高二上学期第一次月考化学试题黑龙江省七台河市勃利县高级中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
2 . 理论研究表明,在101kPa和298K下,HCN(g)  HNC(g),异构化反应过程的能量变化如图所示。下列说法不正确的是
HNC(g),异构化反应过程的能量变化如图所示。下列说法不正确的是
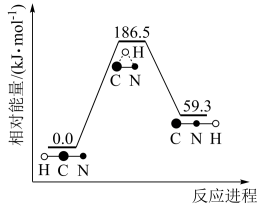
 HNC(g),异构化反应过程的能量变化如图所示。下列说法不正确的是
HNC(g),异构化反应过程的能量变化如图所示。下列说法不正确的是
| A.HCN(g)比HNC(g)稳定 |
| B.该异构化反应的△H=+59.3kJ·mol-1 |
| C.使用催化剂,可以改变反应的反应热和活化能 |
| D.完全断开1mol HCN(g)中的共价键所吸收的热量比完全断开1mol HNC(g)中的共价键所吸收的热量多 |
您最近一年使用:0次
名校
3 . 为了研究反应 能量变化情况,某同学设计了如图所示装置。当向盛有
能量变化情况,某同学设计了如图所示装置。当向盛有 的试管中滴加试剂
的试管中滴加试剂 时,看到
时,看到 形管中甲处液面下降乙处液面上升。试回答下列问题:
形管中甲处液面下降乙处液面上升。试回答下列问题:
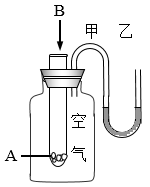
(1)该反应为___________ 反应(填“放热”或“吸热”)。
(2)物质中的化学能通过化学反应转化成___________ 释放出来。
(3)若甲烷的燃烧热为 ,写出表示甲烷燃烧热的热化学方程式
,写出表示甲烷燃烧热的热化学方程式___________ 。
(4)已知
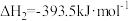
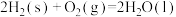
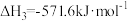 。
。
则高温下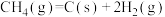

___________  。
。
 能量变化情况,某同学设计了如图所示装置。当向盛有
能量变化情况,某同学设计了如图所示装置。当向盛有 的试管中滴加试剂
的试管中滴加试剂 时,看到
时,看到 形管中甲处液面下降乙处液面上升。试回答下列问题:
形管中甲处液面下降乙处液面上升。试回答下列问题:
(1)该反应为
(2)物质中的化学能通过化学反应转化成
(3)若甲烷的燃烧热为
 ,写出表示甲烷燃烧热的热化学方程式
,写出表示甲烷燃烧热的热化学方程式(4)已知

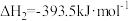
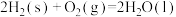
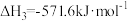 。
。则高温下
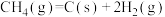

 。
。
您最近一年使用:0次
2021-11-01更新
|
220次组卷
|
3卷引用:浙江省宁波市北仑中学2021-2022学年高一上学期期中考试化学(育英班)试题
4 . 甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
(1)汽油的主要成分之一是辛烷[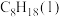 ]。已知:25℃、101kPa时,1mol
]。已知:25℃、101kPa时,1mol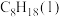 完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应的热化学方程式为
完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应的热化学方程式为______ 。
(2)已知:25℃、101kPa时,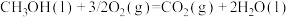

相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是______ 。
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

根据图信息分析,与汽油相比,甲醇作为燃料的优点是______ 。
Ⅱ.甲醇的合成
(4)以 和
和 为原料合成甲醇,反应的能量变化如图所示。
为原料合成甲醇,反应的能量变化如图所示。
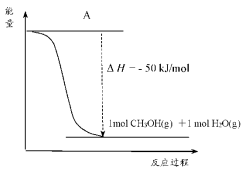
①补全图:图中A处应填入______ 。
②由图可知,该反应中反应物 和
和 的总能量
的总能量______ (填“大于”、“小于”或“等于”)生成物 和
和 的总能量。
的总能量。
(5)已知:1mol液态甲醇完全气化需吸热37.4kJ,1mol液态水完全气化需吸热44.0kJ,由 合成1mol液态甲醇和1mol液态水将
合成1mol液态甲醇和1mol液态水将______ (填“吸收”或“放出”)______ kJ热量。
(6)已知: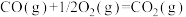
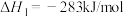
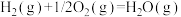
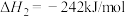
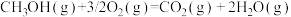
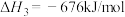
以 和
和 为原料合成甲醇的反应为
为原料合成甲醇的反应为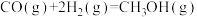 。
。
该反应的 为
为______ kJ/mol。
(1)汽油的主要成分之一是辛烷[
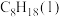 ]。已知:25℃、101kPa时,1mol
]。已知:25℃、101kPa时,1mol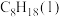 完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应的热化学方程式为
完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应的热化学方程式为(2)已知:25℃、101kPa时,
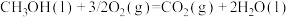

相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

根据图信息分析,与汽油相比,甲醇作为燃料的优点是
Ⅱ.甲醇的合成
(4)以
 和
和 为原料合成甲醇,反应的能量变化如图所示。
为原料合成甲醇,反应的能量变化如图所示。
①补全图:图中A处应填入
②由图可知,该反应中反应物
 和
和 的总能量
的总能量 和
和 的总能量。
的总能量。(5)已知:1mol液态甲醇完全气化需吸热37.4kJ,1mol液态水完全气化需吸热44.0kJ,由
 合成1mol液态甲醇和1mol液态水将
合成1mol液态甲醇和1mol液态水将(6)已知:
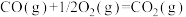
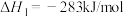
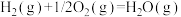
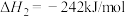
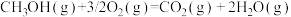
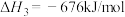
以
 和
和 为原料合成甲醇的反应为
为原料合成甲醇的反应为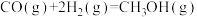 。
。该反应的
 为
为
您最近一年使用:0次
解题方法
5 . 化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)通过化学键的键能计算。已知:
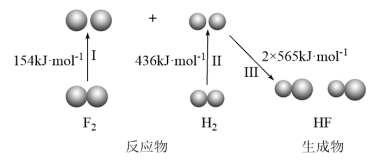
完成转化Ⅲ需要___________ (填“吸收”或“放出”)能量:F﹣F、H﹣H、H﹣F,稳定性强的是___________ ;计算可得:H2(g)+F2(g)=2HF(g)△H=___________ ;
(2)通过物质所含能量计算。已知:1mol白磷(P4,s)和4mol红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。
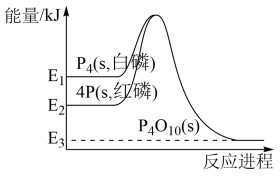
P4(白磷,s)=4P(红磷,s)△H___________ 0(填“>”或“<”),物质的稳定性:白磷___________ 红磷(填“>”或“<”),红磷燃烧的热化学方程式是4P(红磷,s)+5O2(g)=P4O10(s)△H=___________ kJ•mol﹣1
(3)通过盖斯定律可计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+ O2(g)=Na2O(s)△H=﹣412kJ•mol﹣1
O2(g)=Na2O(s)△H=﹣412kJ•mol﹣1
Ⅱ.2Na(s)+O2(g)=Na2O2(s)△H=﹣511kJ•mol﹣1
写出Na2O2与Na反应生成Na2O的热化学方程式___________ 。
(1)通过化学键的键能计算。已知:

完成转化Ⅲ需要
(2)通过物质所含能量计算。已知:1mol白磷(P4,s)和4mol红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。

P4(白磷,s)=4P(红磷,s)△H
(3)通过盖斯定律可计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+
 O2(g)=Na2O(s)△H=﹣412kJ•mol﹣1
O2(g)=Na2O(s)△H=﹣412kJ•mol﹣1Ⅱ.2Na(s)+O2(g)=Na2O2(s)△H=﹣511kJ•mol﹣1
写出Na2O2与Na反应生成Na2O的热化学方程式
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题:
(1)下列关于充电电池、干电池的叙述合理的是___ 。
①干电池可以实现化学能向电能的转化和电能向化学能的转化
②锌锰干电池长时间连续使用时内装糊状物可能流出腐蚀电器
③充电电池可以无限制地反复放电、充电
④充电是使放电时的氧化还原反应逆向进行
(2)为应对全球气候问题,中国政府承诺“2030年碳达峰”“2060年碳中和”。二氧化碳再次成为科学家们研究的重点。回答下列问题:
已知:①H2(g)+ O2(g)=H2O(l) ΔH1=-285.8kJ/mol
O2(g)=H2O(l) ΔH1=-285.8kJ/mol
②C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH2=-1366.8kJ/mol
③H2O(l)=H2O(g) ΔH3=+44kJ⋅mol-1
则CO2与H2反应生成C2H5OH(g)和H2O(g)的热化学方程式为___ 。
(3)镁和铝插入NaOH溶液介质中,___ 为负极,其电极反应式为___ 。
(4)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。正极的反应式是
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。正极的反应式是___ 。
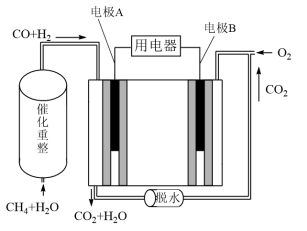
(5)一种熔融碳酸盐燃料电池原理示意如图:电池工作时,外电路上电流的方向应从___ 电极(“填A或B”)流向用电器。内电路中,CO 向
向___ 电极(“填A或B”)移动,电极A上CO参与的电极反应为___ 。
(1)下列关于充电电池、干电池的叙述合理的是
①干电池可以实现化学能向电能的转化和电能向化学能的转化
②锌锰干电池长时间连续使用时内装糊状物可能流出腐蚀电器
③充电电池可以无限制地反复放电、充电
④充电是使放电时的氧化还原反应逆向进行
(2)为应对全球气候问题,中国政府承诺“2030年碳达峰”“2060年碳中和”。二氧化碳再次成为科学家们研究的重点。回答下列问题:
已知:①H2(g)+
 O2(g)=H2O(l) ΔH1=-285.8kJ/mol
O2(g)=H2O(l) ΔH1=-285.8kJ/mol②C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH2=-1366.8kJ/mol
③H2O(l)=H2O(g) ΔH3=+44kJ⋅mol-1
则CO2与H2反应生成C2H5OH(g)和H2O(g)的热化学方程式为
(3)镁和铝插入NaOH溶液介质中,
(4)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:Cd+2NiO(OH)+2H2O
 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。正极的反应式是
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。正极的反应式是(5)一种熔融碳酸盐燃料电池原理示意如图:电池工作时,外电路上电流的方向应从
 向
向
您最近一年使用:0次
7 . 研究表明:丰富的CO2可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)枯竭危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例、该过程分两步进行:
第一步:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41.3kJ⋅mol-1
CO(g)+H2O(g) △H=+41.3kJ⋅mol-1
第二步:2CO(g)+4H2(g) C2H4(g)+2H2O(g) △H=-210.5kJ⋅mol-1
C2H4(g)+2H2O(g) △H=-210.5kJ⋅mol-1
①CO2加氢合成乙烯的热化学方程式为___ 。
②一定条件下的密闭容器中,上述反应达到平衡后,要加快反应速率并提高CO2的转化率,可以采取的措施是___ (填字母)。
A.减小压强 B.增大H2浓度 C.加入适当催化剂 D.分离出水蒸气
(2)另一种方法是将CO2和H2在催化剂条件下生成甲醇蒸气和水蒸气。现在10L恒容密闭容器中投入1molCO2和2.75molH2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
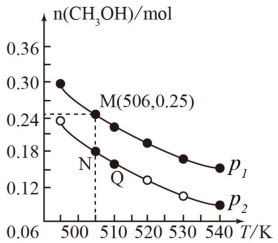
①上述反应的△H___ 0(填“>”或“<”),图中压强p1___ p2(填“>”或“<”)。
②经测定知Q点时容器的压强是反应前压强的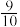 ,则Q点H2的转化率为
,则Q点H2的转化率为___ 。
③N点时,该反应的平衡常数K=___ (计算结果保留两位小数)。
(1)目前工业上有一种方法是用CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例、该过程分两步进行:
第一步:CO2(g)+H2(g)
 CO(g)+H2O(g) △H=+41.3kJ⋅mol-1
CO(g)+H2O(g) △H=+41.3kJ⋅mol-1第二步:2CO(g)+4H2(g)
 C2H4(g)+2H2O(g) △H=-210.5kJ⋅mol-1
C2H4(g)+2H2O(g) △H=-210.5kJ⋅mol-1①CO2加氢合成乙烯的热化学方程式为
②一定条件下的密闭容器中,上述反应达到平衡后,要加快反应速率并提高CO2的转化率,可以采取的措施是
A.减小压强 B.增大H2浓度 C.加入适当催化剂 D.分离出水蒸气
(2)另一种方法是将CO2和H2在催化剂条件下生成甲醇蒸气和水蒸气。现在10L恒容密闭容器中投入1molCO2和2.75molH2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
①上述反应的△H
②经测定知Q点时容器的压强是反应前压强的
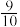 ,则Q点H2的转化率为
,则Q点H2的转化率为③N点时,该反应的平衡常数K=
您最近一年使用:0次
名校
解题方法
8 . NO用途广泛,对其进行研究具有重要的价值和意义
(1)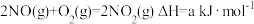 的反应历程与能量变化关系如图所示。
的反应历程与能量变化关系如图所示。
已知:第Ⅱ步反应为: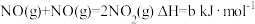
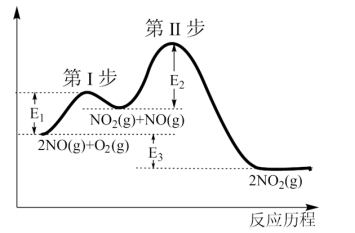
①第Ⅰ步反应的热化学方程式为___________ 。
②关于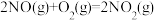 的反应历程,下列说法正确的是
的反应历程,下列说法正确的是___________
A.相同条件下,决定该反应快慢的步骤为第Ⅱ步反应
B.使用合适的催化剂会使E1、E2、E3同时减小
C.第Ⅰ步反应为吸热反应,第Ⅱ步反应为放热反应
D.反应的中间产物是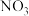 和NO
和NO
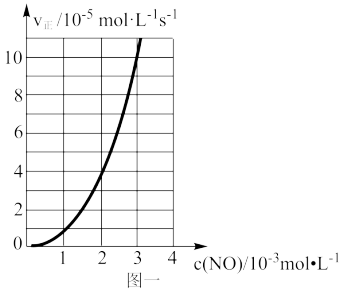
(2)NO的氯化还原反应为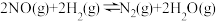 。研究表明:某温度时,v正=
。研究表明:某温度时,v正=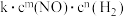 ,其中
,其中 。该温度下,当
。该温度下,当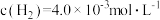 时,实验测得v正与
时,实验测得v正与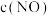 的关系如图一所示,则m=
的关系如图一所示,则m=___________ ,n=___________ 。
(3)NO易发生二聚反应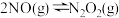 。在相同的刚性反应器中充入等量的NO,分别发生该反应。不同温度下,NO的转化率随时间(t)的变化关系如图二所示。
。在相同的刚性反应器中充入等量的NO,分别发生该反应。不同温度下,NO的转化率随时间(t)的变化关系如图二所示。
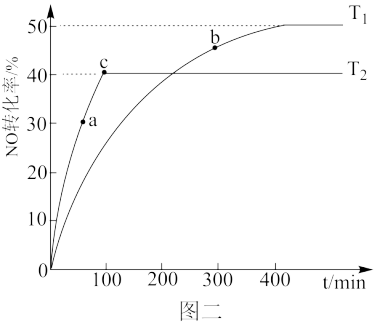
①该反应的
___________ 0(填“>”“<”或“=”)。
②a、b处正反应速率va___________ vb(填“>”“<”或“=”)。
③c点对应体系的总压强为200kPa,则T2温度下,该反应的平衡常数Kp=___________  (Kp为以分压表示的平衡常数)
(Kp为以分压表示的平衡常数)
(1)
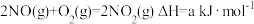 的反应历程与能量变化关系如图所示。
的反应历程与能量变化关系如图所示。已知:第Ⅱ步反应为:
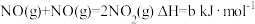

①第Ⅰ步反应的热化学方程式为
②关于
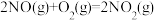 的反应历程,下列说法正确的是
的反应历程,下列说法正确的是A.相同条件下,决定该反应快慢的步骤为第Ⅱ步反应
B.使用合适的催化剂会使E1、E2、E3同时减小
C.第Ⅰ步反应为吸热反应,第Ⅱ步反应为放热反应
D.反应的中间产物是
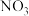 和NO
和NO(2)NO的氯化还原反应为
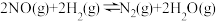 。研究表明:某温度时,v正=
。研究表明:某温度时,v正=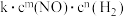 ,其中
,其中 。该温度下,当
。该温度下,当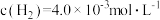 时,实验测得v正与
时,实验测得v正与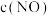 的关系如图一所示,则m=
的关系如图一所示,则m=
(3)NO易发生二聚反应
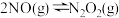 。在相同的刚性反应器中充入等量的NO,分别发生该反应。不同温度下,NO的转化率随时间(t)的变化关系如图二所示。
。在相同的刚性反应器中充入等量的NO,分别发生该反应。不同温度下,NO的转化率随时间(t)的变化关系如图二所示。
①该反应的

②a、b处正反应速率va
③c点对应体系的总压强为200kPa,则T2温度下,该反应的平衡常数Kp=
 (Kp为以分压表示的平衡常数)
(Kp为以分压表示的平衡常数)
您最近一年使用:0次
9 . 以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步: (快反应)
(快反应)
第二步: (慢反应)
(慢反应)
第三步: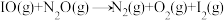 (快反应)
(快反应)
实验表明,含碘时N2O分解速率方程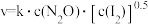 (k为速率常数)。下列表述正确的是___________
(k为速率常数)。下列表述正确的是___________
(2)汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的NO(g)和CO(g)在催化剂的作用下转化成两种无污染的气体: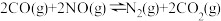
 。
。
①已知:反应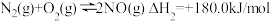 ,若CO的燃烧热
,若CO的燃烧热 为-283.5kJ/mol,则
为-283.5kJ/mol,则 =
=___________ 。
②若在恒容的密闭容器中,充入2molCO和1molNO,下列选项中不能说明该反应已经达到平衡状态的是___________ 。
A.CO和NO的物质的量之比不变 B.混合气体的密度保持不变
C.混合气体的压强保持不变 D.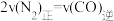
③研究表明氮氧化物的脱除率除了与还原剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以 (A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
(A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:Ⅰ. +□
+□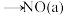
Ⅱ.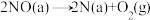
Ⅲ.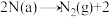 □
□
Ⅳ.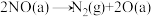
Ⅴ.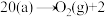 □
□
注:□表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是___________ 。
(3) 与
与 之间存在反应
之间存在反应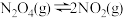 。将定量的
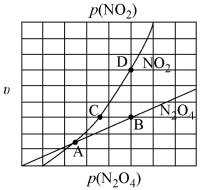
。将定量的 放入恒容密闭容器中,测得其平衡转化率[
放入恒容密闭容器中,测得其平衡转化率[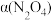 ]随温度的变化如图所示。
]随温度的变化如图所示。
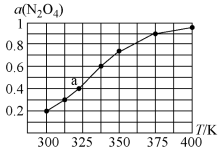
①图中a点对应温度下。已知N2O4的起始压强为108kPa,则该温度下反应的平衡常数Kp=___________ kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系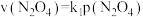 ,
,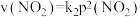 ,其中k1、k2是与反应温度有关的常数。相应的速率、压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=
,其中k1、k2是与反应温度有关的常数。相应的速率、压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________ ,在图上标出的点中,能表示反应达到平衡状态的点为___________ (填字母代号)。
(1)N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步:
 (快反应)
(快反应)第二步:
 (慢反应)
(慢反应)第三步:
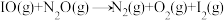 (快反应)
(快反应)实验表明,含碘时N2O分解速率方程
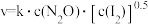 (k为速率常数)。下列表述正确的是___________
(k为速率常数)。下列表述正确的是___________| A.N2O分解反应中:k值与是否含碘蒸气有关 |
| B.第三步对总反应速率起决定作用 |
| C.第二步活化能比第三步小 |
| D.IO为反应的催化剂 |
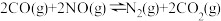
 。
。①已知:反应
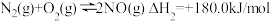 ,若CO的燃烧热
,若CO的燃烧热 为-283.5kJ/mol,则
为-283.5kJ/mol,则 =
=②若在恒容的密闭容器中,充入2molCO和1molNO,下列选项中不能说明该反应已经达到平衡状态的是
A.CO和NO的物质的量之比不变 B.混合气体的密度保持不变
C.混合气体的压强保持不变 D.
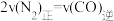
③研究表明氮氧化物的脱除率除了与还原剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以
 (A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
(A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:Ⅰ.
 +□
+□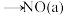
Ⅱ.
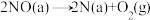
Ⅲ.
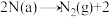 □
□Ⅳ.
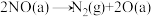
Ⅴ.
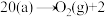 □
□注:□表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是
(3)
 与
与 之间存在反应
之间存在反应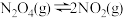 。将定量的
。将定量的 放入恒容密闭容器中,测得其平衡转化率[
放入恒容密闭容器中,测得其平衡转化率[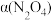 ]随温度的变化如图所示。
]随温度的变化如图所示。
①图中a点对应温度下。已知N2O4的起始压强为108kPa,则该温度下反应的平衡常数Kp=
②在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系
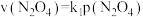 ,
,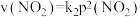 ,其中k1、k2是与反应温度有关的常数。相应的速率、压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=
,其中k1、k2是与反应温度有关的常数。相应的速率、压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=
您最近一年使用:0次
名校
解题方法
10 . 以锌锰废电池中的碳包(含碳粉、Fe、Cu、Ag和MnO2等物质)为原料回收MnO2的工艺流程如下:
I.将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
II.将滤渣a在空气中灼烧除去碳粉,得到粗MnO2;
III.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
IV.向III所得溶液(pH约为6)中缓慢滴加0.50mol•L-1Na2CO3溶液(pH约为12),过滤,得滤渣b,其主要成分为MnCO3;
V.滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2。
(1)Ι中Ag与足量稀HNO3反应生成NO的化学方程式为___________ 。
(2)已知II的灼烧过程中同时发生反应:
MnO2(s)+C(s)=MnO(s)+CO(g) △H=+24.4kJ•mol-1
MnO2(s)+CO(g)=MnO(s)+CO2(g) △H=-148.1kJ•mol-1
写出MnO2和C反应生成MnO和CO2的热化学方程式:___________ 。
(3)H2O2的电子式为_______ ,分子中含有的化学键类型为_______ 、_______ 。
(4)III中MnO2溶解的离子方程式为_______ ,溶解一定量的MnO2,H2O2的实际消耗量比理论值高,用化学方程式解释原因:______ 。
(5)IV中,若改为“向0.50mol•L-1Na2CO3溶液中缓慢滴加III所得溶液”,滤渣b中会混有较多_____ 杂质。
(6)V中MnCO3在空气中灼烧的化学方程式为_______ 。
I.将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
II.将滤渣a在空气中灼烧除去碳粉,得到粗MnO2;
III.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
IV.向III所得溶液(pH约为6)中缓慢滴加0.50mol•L-1Na2CO3溶液(pH约为12),过滤,得滤渣b,其主要成分为MnCO3;
V.滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2。
(1)Ι中Ag与足量稀HNO3反应生成NO的化学方程式为
(2)已知II的灼烧过程中同时发生反应:
MnO2(s)+C(s)=MnO(s)+CO(g) △H=+24.4kJ•mol-1
MnO2(s)+CO(g)=MnO(s)+CO2(g) △H=-148.1kJ•mol-1
写出MnO2和C反应生成MnO和CO2的热化学方程式:
(3)H2O2的电子式为
(4)III中MnO2溶解的离子方程式为
(5)IV中,若改为“向0.50mol•L-1Na2CO3溶液中缓慢滴加III所得溶液”,滤渣b中会混有较多
(6)V中MnCO3在空气中灼烧的化学方程式为
您最近一年使用:0次



