名校
解题方法
1 . 我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和。而研发 的碳捕捉和碳利用技术则是关键。通过各国科技工作者的努力,已经开发出许多将
的碳捕捉和碳利用技术则是关键。通过各国科技工作者的努力,已经开发出许多将 回收利用的技术。回答下列问题:
回收利用的技术。回答下列问题:
(1) 在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。



获取乙二醇的反应历程可分为如下2步:
I. ;
;
II. 加氢生成乙二醇与甲醇。
加氢生成乙二醇与甲醇。
步骤II的热化学方程式是___________ 。
(2)通过人工光合作用,以 和
和 为原料制备
为原料制备 和
和 的工作原理如图所示。
的工作原理如图所示。
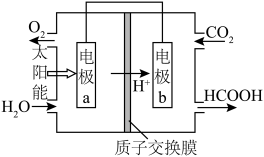
电极 上的电极反应式为
上的电极反应式为___________ 。
(3)研究表明,在电解质水溶液中, 气体可被电化学还原。
气体可被电化学还原。 在碱性介质中电还原为正丙醇
在碱性介质中电还原为正丙醇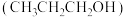 的电极反应式为
的电极反应式为___________ 。
(4)一种聚合物锂电池通过充、放电可实现“大气固碳”(工作原理如图所示)。该电池在充电时,通过催化剂的选择性控制,只有 发生氧化释放出
发生氧化释放出 和
和 。图中
。图中 的移动方向是
的移动方向是___________ (填“充电”或“放电”)时的移动方向;充电时,阳极的电极反应式为___________ ;该电池每循环充、放电子各 ,理论上可固定
,理论上可固定
___________ L(标准状况下)。

 的碳捕捉和碳利用技术则是关键。通过各国科技工作者的努力,已经开发出许多将
的碳捕捉和碳利用技术则是关键。通过各国科技工作者的努力,已经开发出许多将 回收利用的技术。回答下列问题:
回收利用的技术。回答下列问题:(1)
 在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。


获取乙二醇的反应历程可分为如下2步:
I.
 ;
;II.
 加氢生成乙二醇与甲醇。
加氢生成乙二醇与甲醇。步骤II的热化学方程式是
(2)通过人工光合作用,以
 和
和 为原料制备
为原料制备 和
和 的工作原理如图所示。
的工作原理如图所示。
电极
 上的电极反应式为
上的电极反应式为(3)研究表明,在电解质水溶液中,
 气体可被电化学还原。
气体可被电化学还原。 在碱性介质中电还原为正丙醇
在碱性介质中电还原为正丙醇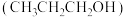 的电极反应式为
的电极反应式为(4)一种聚合物锂电池通过充、放电可实现“大气固碳”(工作原理如图所示)。该电池在充电时,通过催化剂的选择性控制,只有
 发生氧化释放出
发生氧化释放出 和
和 。图中
。图中 的移动方向是
的移动方向是 ,理论上可固定
,理论上可固定

您最近一年使用:0次
名校
解题方法
2 .  是空气的主要污染物之一,有效去除大气中的
是空气的主要污染物之一,有效去除大气中的 可以保护大气环境。含氮废水氨氮(以
可以保护大气环境。含氮废水氨氮(以 存在)和硝态氮(以
存在)和硝态氮(以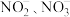 存在)引起水体富营养化,需经处理后才能排放。
存在)引起水体富营养化,需经处理后才能排放。
(1)空气中污染物 可在催化剂作用下用
可在催化剂作用下用 还原。
还原。
已知: ;
;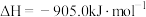
 ;
;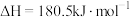
有氧条件下, 与
与 反应生成
反应生成 ,相关热化学方程式为
,相关热化学方程式为
 ;
;
___________  。
。
(2)工业上含氮化合物污染物处理
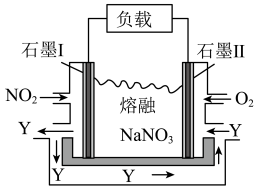
①以 、熔融
、熔融 组成的燃料电池装置如图所示,在使用过程中石墨I电极反应生成一种氧化物
组成的燃料电池装置如图所示,在使用过程中石墨I电极反应生成一种氧化物 ,则该电池的正极反应式为
,则该电池的正极反应式为___________ 。
②纳米铁粉可用于处理含氮废水。用纳米铁粉处理水体中的 ,反应的离子方程式为
,反应的离子方程式为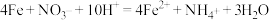 。研究发现,若
。研究发现,若 偏低将会导致
偏低将会导致 的去除率下降,其原因是
的去除率下降,其原因是___________ 。相同条件下,纳米铁粉去除不同水样中 的速率有较大差异(如图),产生该差异的可能原因是
的速率有较大差异(如图),产生该差异的可能原因是___________ 。

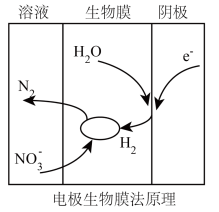
③电极生物膜法也能有效去除水体中的 ,进行生物的反硝化反应,其可能反应机理如图所示。以必要的化学用语及文字来描述此过程为
,进行生物的反硝化反应,其可能反应机理如图所示。以必要的化学用语及文字来描述此过程为___________ 。
 是空气的主要污染物之一,有效去除大气中的
是空气的主要污染物之一,有效去除大气中的 可以保护大气环境。含氮废水氨氮(以
可以保护大气环境。含氮废水氨氮(以 存在)和硝态氮(以
存在)和硝态氮(以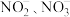 存在)引起水体富营养化,需经处理后才能排放。
存在)引起水体富营养化,需经处理后才能排放。(1)空气中污染物
 可在催化剂作用下用
可在催化剂作用下用 还原。
还原。已知:
 ;
;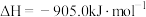
 ;
;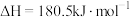
有氧条件下,
 与
与 反应生成
反应生成 ,相关热化学方程式为
,相关热化学方程式为 ;
;
 。
。(2)工业上含氮化合物污染物处理
①以
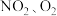 、熔融
、熔融 组成的燃料电池装置如图所示,在使用过程中石墨I电极反应生成一种氧化物
组成的燃料电池装置如图所示,在使用过程中石墨I电极反应生成一种氧化物 ,则该电池的正极反应式为
,则该电池的正极反应式为
②纳米铁粉可用于处理含氮废水。用纳米铁粉处理水体中的
 ,反应的离子方程式为
,反应的离子方程式为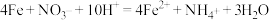 。研究发现,若
。研究发现,若 偏低将会导致
偏低将会导致 的去除率下降,其原因是
的去除率下降,其原因是 的速率有较大差异(如图),产生该差异的可能原因是
的速率有较大差异(如图),产生该差异的可能原因是
③电极生物膜法也能有效去除水体中的
 ,进行生物的反硝化反应,其可能反应机理如图所示。以必要的化学用语及文字来描述此过程为
,进行生物的反硝化反应,其可能反应机理如图所示。以必要的化学用语及文字来描述此过程为
您最近一年使用:0次
3 . 我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和,而研发CO2的碳捕捉和碳利用技术则是关键。
(1)大气中的CO2主要来自于煤、石油及其他含碳化合物的燃烧,CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
①CH4(g) C(s)+2H2(g) ΔH1=akJ•mol-1
C(s)+2H2(g) ΔH1=akJ•mol-1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=bkJ•mol-1
CO(g)+H2O(g) ΔH2=bkJ•mol-1
③2CO(g) CO2(g)+C(s) ΔH3=ckJ•mol-1
CO2(g)+C(s) ΔH3=ckJ•mol-1
反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的ΔH=
2CO(g)+2H2(g)的ΔH=____ kJ•mol-1。
(2)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图1所示,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。生成C2H4的电极反应式为_____ 。

(3)CO2的电化学催化还原具有条件温和、对环境友好的优点。Cu对CO2的电还原有一定的催化作用。在0.1mol•L-1CuSO4/H2SO4溶液中,改变沉积时间,进行恒电位沉积制备纳米Cu电极。图2是根据不同沉积时间制备的纳米Cu电极的循环伏安曲线作出的CO2的还原峰电流(峰电流越大,表明纳米Cu电极催化效果越好)与沉积时间的关系图,沉积时间超过50s,进一步延长沉积时间,纳米Cu电极催化效果减弱的原因是____ 。

(4)常温下,以NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。用1LNa2CO3溶液将2.33gBaSO4固体全都转化为BaCO3,再过滤,所用的Na2CO3溶液的物质的量浓度至少为____ mol•L-1。
[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10;忽略溶液体积变化]
(5)章根强课题组通过温和的自光刻技术制备出富含氧空位的Co(CO3)0.5(OH)•0.11H2O纳米线(用CoⅡ表示),测试结果表明,该CoⅡ在可见光下具有优异的光催化CO2还原活性。分析表明,该CO2还原催化机理为典型的CoⅡ/CoI反应路径(如图3)。首先,光敏剂([Ru(bpy)3]2+)通过可见光照射被激发到激发态([Ru(bpy)3]2+*),随后([Ru(bpy)3]2+*)被TEOA淬灭得到([Ru(bpy)3]+)还原物种,该还原物种将向CoⅡ供激发电子将CoⅡ还原为CoI,_____ 。(结合图示,描述CO2还原为CO的过程)

(1)大气中的CO2主要来自于煤、石油及其他含碳化合物的燃烧,CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
①CH4(g)
 C(s)+2H2(g) ΔH1=akJ•mol-1
C(s)+2H2(g) ΔH1=akJ•mol-1②CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=bkJ•mol-1
CO(g)+H2O(g) ΔH2=bkJ•mol-1③2CO(g)
 CO2(g)+C(s) ΔH3=ckJ•mol-1
CO2(g)+C(s) ΔH3=ckJ•mol-1反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的ΔH=
2CO(g)+2H2(g)的ΔH=(2)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图1所示,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。生成C2H4的电极反应式为

(3)CO2的电化学催化还原具有条件温和、对环境友好的优点。Cu对CO2的电还原有一定的催化作用。在0.1mol•L-1CuSO4/H2SO4溶液中,改变沉积时间,进行恒电位沉积制备纳米Cu电极。图2是根据不同沉积时间制备的纳米Cu电极的循环伏安曲线作出的CO2的还原峰电流(峰电流越大,表明纳米Cu电极催化效果越好)与沉积时间的关系图,沉积时间超过50s,进一步延长沉积时间,纳米Cu电极催化效果减弱的原因是

(4)常温下,以NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。用1LNa2CO3溶液将2.33gBaSO4固体全都转化为BaCO3,再过滤,所用的Na2CO3溶液的物质的量浓度至少为
[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10;忽略溶液体积变化]
(5)章根强课题组通过温和的自光刻技术制备出富含氧空位的Co(CO3)0.5(OH)•0.11H2O纳米线(用CoⅡ表示),测试结果表明,该CoⅡ在可见光下具有优异的光催化CO2还原活性。分析表明,该CO2还原催化机理为典型的CoⅡ/CoI反应路径(如图3)。首先,光敏剂([Ru(bpy)3]2+)通过可见光照射被激发到激发态([Ru(bpy)3]2+*),随后([Ru(bpy)3]2+*)被TEOA淬灭得到([Ru(bpy)3]+)还原物种,该还原物种将向CoⅡ供激发电子将CoⅡ还原为CoI,

您最近一年使用:0次
2022-12-08更新
|
457次组卷
|
2卷引用:江苏省苏州中学、淮阴中学、姜堰中学、海门中学四校2023届高三上学期期中联考化学试题
4 . 化学反应过程中既有物质变化,又有能量变化。释放或吸收热量是化学反应中能量变化的主要形式之一
(1)甲烷具有较大的燃烧热( ),是常见燃料。请写出甲烷燃烧的热化学反应方程式
),是常见燃料。请写出甲烷燃烧的热化学反应方程式_______ 。
(2)①工业上高纯硅可通过下列反应制取: 该反应的反应热
该反应的反应热
_______  。
。
已知:
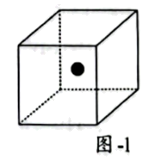
②硅晶体结构与金刚石类似。题图-1所示立方体体心的“●”表示晶体中的一个Si原子,请在立方体的顶点用“●”表示出与之紧邻的所有硅原子。________
(3)自发热材料在生活中的应用日益广泛。某实验小组为探究“CaO-Al- ”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值(
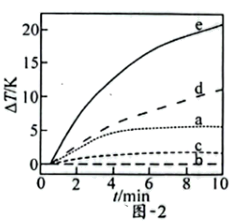
”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值( )随时间(t)的变化曲线,如图-2所示。
)随时间(t)的变化曲线,如图-2所示。
已知:I.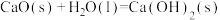
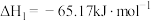
II.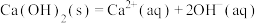
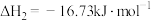
III.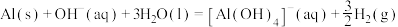
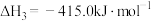
①实验b中, 的变化说明Al粉与
的变化说明Al粉与 在该条件下
在该条件下_______ (填“反应”或“不反应”)。
②实验c中,前3min的 有变化,其原因是
有变化,其原因是_______ ;3min后 基本不变,其原因是
基本不变,其原因是_______ 。
③实验d在10min内温度持续升高的原因是_______ 。
④实验e中发生的总反应可表示为: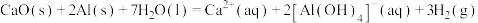 ,其
,其
_______ 。
五组实验对比,e放热效果最好。
(1)甲烷具有较大的燃烧热(
 ),是常见燃料。请写出甲烷燃烧的热化学反应方程式
),是常见燃料。请写出甲烷燃烧的热化学反应方程式(2)①工业上高纯硅可通过下列反应制取:
 该反应的反应热
该反应的反应热
 。
。已知:
| 化学键 | Si-Cl | H-H | H-Cl | Si-Si |
键能/ | 360 | 436 | 431 | 176 |
②硅晶体结构与金刚石类似。题图-1所示立方体体心的“●”表示晶体中的一个Si原子,请在立方体的顶点用“●”表示出与之紧邻的所有硅原子。

(3)自发热材料在生活中的应用日益广泛。某实验小组为探究“CaO-Al-
 ”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值(
”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值( )随时间(t)的变化曲线,如图-2所示。
)随时间(t)的变化曲线,如图-2所示。| 实验编号 | 反应物组成 |
| a | 0.20gCaO粉末、5.0mL |
| b | 0.15gAl粉、5.0mL |
| c | 0.15gAl粉、5.0mL饱和石灰水 |
| d | 0.15gAl粉、5.0mL石灰乳 |
| e | 0.15gAl粉、0.20gCaO粉末 5.0mL |

已知:I.
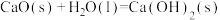
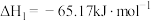
II.
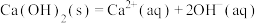
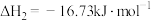
III.
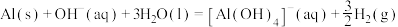
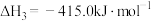
①实验b中,
 的变化说明Al粉与
的变化说明Al粉与 在该条件下
在该条件下②实验c中,前3min的
 有变化,其原因是
有变化,其原因是 基本不变,其原因是
基本不变,其原因是③实验d在10min内温度持续升高的原因是
④实验e中发生的总反应可表示为:
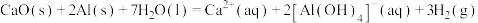 ,其
,其
五组实验对比,e放热效果最好。
您最近一年使用:0次
名校
解题方法
5 . 完成下列填空:
(1)0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水放出649.5 kJ热量,其热化学方程式为:_______ ;
(2)已知H-H键键能为436 kJ/mol,H-N键键能为391 kJ/mol,根据化学方程式:
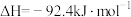 ,则N≡N键键能是
,则N≡N键键能是_______ 。
(3)1 mol氧气与足量氢气反应生成水蒸气放热483.6 kJ,写出该反应的热化学方程式:_______ 。若1 mol水蒸气转化成液态水放热44 kJ,写出表示氢气燃烧热的热化学方程式:_______ 。
(4)已知:①
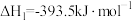
②
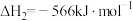
③
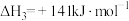
则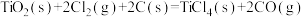 的△H=
的△H=_______ 。
(1)0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水放出649.5 kJ热量,其热化学方程式为:
(2)已知H-H键键能为436 kJ/mol,H-N键键能为391 kJ/mol,根据化学方程式:

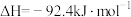 ,则N≡N键键能是
,则N≡N键键能是(3)1 mol氧气与足量氢气反应生成水蒸气放热483.6 kJ,写出该反应的热化学方程式:
(4)已知:①

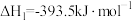
②

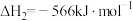
③

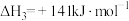
则
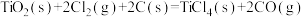 的△H=
的△H=
您最近一年使用:0次
名校
6 . 已知:①2H2(g)+O2(g)=2H2O(g) ΔH1;
②2Fe(s)+ O2(g)=Fe2O3(s) ΔH2;
O2(g)=Fe2O3(s) ΔH2;
③2Al(s)+ O2(g)=Al2O3(s) ΔH3;
O2(g)=Al2O3(s) ΔH3;
④2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) ΔH4。
下列关于反应焓变的判断正确的是
②2Fe(s)+
 O2(g)=Fe2O3(s) ΔH2;
O2(g)=Fe2O3(s) ΔH2;③2Al(s)+
 O2(g)=Al2O3(s) ΔH3;
O2(g)=Al2O3(s) ΔH3;④2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) ΔH4。
下列关于反应焓变的判断正确的是
A.H2的燃烧热为 ΔH1 ΔH1 | B.ΔH2=ΔH3+ΔH4 |
| C.增加氧气的量可改变ΔH2、ΔH3的值 | D.ΔH3<ΔH2 |
您最近一年使用:0次
2022-07-22更新
|
3079次组卷
|
14卷引用:江苏省常熟中学2022-2023学年高二上学期10月份阳光调研化学(选修)试题
江苏省常熟中学2022-2023学年高二上学期10月份阳光调研化学(选修)试题江苏省常熟市王淦昌高级中学2022-2023学年高二上学期10月月考化学试卷(已下线)1.3 燃料的合理利用-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)1.3 燃料的合理利用-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)第一章化学反应的热效应山西省晋中市平遥县第二中学校2022-2023学年高二上学期8月质检化学试题上海市进才中学2022-2023学年高二上学期10月阶段测试化学试题福建省厦门集美中学2022-2023学年高二上学期第一次月考(10月)化学试题福建省莆田第六中学2022-2023学年高二上学期第二次月考(A卷)化学试题福建省莆田第六中学2022-2023学年高二上学期第二次月考(B卷)化学试题福建省上杭县才溪中学2022-2023学年高二上学期10月月考化学试题四川省广元中学2022-2023学年高二下学期4月月考化学试题福建省福州市闽侯县第一中学2023-2024学年高二上学期10月月考化学试题上海市进才中学2023-2024学年高二上学期1月期末化学试题
名校
7 . CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应I:CO2(g)+H2(g) =CO(g)+H2O(g) ΔH=+41.2 kJ·mol−1
反应II:2CO2(g)+6H2(g) =CH3OCH3(g)+3H2O(g) ΔH=—122.5 kJ·mol−1
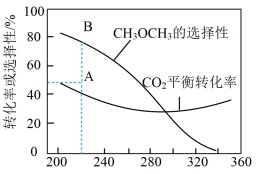
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。 (CH3OCH3的选择性=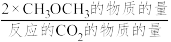 ×100%)
×100%)
下列说法不正确 的是
反应I:CO2(g)+H2(g) =CO(g)+H2O(g) ΔH=+41.2 kJ·mol−1
反应II:2CO2(g)+6H2(g) =CH3OCH3(g)+3H2O(g) ΔH=—122.5 kJ·mol−1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。 (CH3OCH3的选择性=
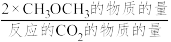 ×100%)
×100%)
下列说法
| A.CO的选择性随温度的升高逐渐增大 |
| B.反应2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH=—204.9 kJ·mol−1 |
| C.在240~320℃范围内,温度升高,平衡时CH3OCH3的物质的量先增大后减小 |
| D.反应一段时间后,测得CH3OCH3的选择性为48%(图中A点),增大压强可能将CH3OCH3的选择性提升到B点 |
您最近一年使用:0次
2022-05-31更新
|
980次组卷
|
7卷引用:江苏省苏州市2022届高考考前模拟化学试卷题
江苏省苏州市2022届高考考前模拟化学试卷题江苏省扬州中学2021-2022学年高二下学期6月月考化学试题(已下线)专题10 化学反应速率与化学平衡-备战2023年高考化学母题题源解密(全国通用)(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(练)-2023年高考化学一轮复习讲练测(全国通用)江苏省常州市十校2022-2023学年高三上学期12月联合调研化学试题江苏省连云港市灌南二中、南师大灌云附中2022-2023学年高二下学期第二次阶段性检测化学试题(已下线)选择题11-13
8 . 我国提出了2030年前碳达峰、2060年前碳中和的“双碳”目标。二氧化碳催化加氢合成CH3OH是一种实现“双碳”目标的有效方法,其主要反应的热化学方程式为
反应Ⅰ:
反应Ⅱ:
下列说法正确的是

反应Ⅰ:

反应Ⅱ:

下列说法正确的是

| A.1个固态CO2晶胞(如上图)中含4个CO2分子,其分子间和分子内的作用力均有饱和性和方向性 |
B.反应 |
C.用E表示键能,反应Ⅰ的 |
| D.CH3OH能与水互溶,主要原因是CH3OH与H2O分子间形成氢键以及都是极性分子 |
您最近一年使用:0次
9 . 工厂烟气(主要污染物SO2、NO)直接排放会造成空气污染,需处理后才能排放。
(1)O3氧化。O3氧化过程中部分反应的能量变化如图所示。
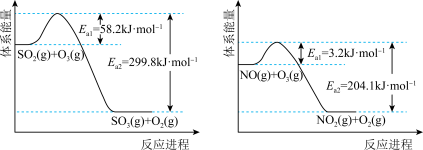
①已知2SO2(g)+O2(g) =2SO3(g) ΔH =−198 kJ·mol−1。则反应2O3(g)=3O2(g)的 ΔH=_______ kJ·mol−1。
②其他条件不变时,增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是_______ 。
(2)NaClO2氧化。40 ℃时向一定量NaClO2溶液中按一定流速持续通入工厂烟气,溶液的pH与ORP值(氧化还原电位)随时间变化如图所示。

①写出NO与ClO 反应的离子方程式:
反应的离子方程式:_______ 。
②烟气中含有少量SO2,能提高NO的脱除率,可能原因是_______ 。
(3)TiO2光催化。主要是利用TiO2光催化剂在紫外线作用下产生的高活性自由基(·OH、·O )和h+(h+代表空位,空位有很强的得电子能力),将烟气中的SO2、NO等氧化除去。TiO2光催化剂粒子表面产生·OH的机理如图所示(图中部分产物略去)。已知TiO2中电子跃迁的能量hv=3.2eV。
)和h+(h+代表空位,空位有很强的得电子能力),将烟气中的SO2、NO等氧化除去。TiO2光催化剂粒子表面产生·OH的机理如图所示(图中部分产物略去)。已知TiO2中电子跃迁的能量hv=3.2eV。
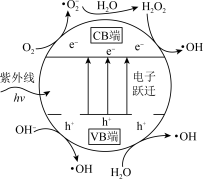
①TiO2光催化剂在紫外线作用下产生·OH的过程可描述为_______ 。
②在TiO2中掺杂一定量的金属离子可提高光催化活性。对所掺杂金属离子的要求是_______ 。
(1)O3氧化。O3氧化过程中部分反应的能量变化如图所示。

①已知2SO2(g)+O2(g) =2SO3(g) ΔH =−198 kJ·mol−1。则反应2O3(g)=3O2(g)的 ΔH=
②其他条件不变时,增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是
(2)NaClO2氧化。40 ℃时向一定量NaClO2溶液中按一定流速持续通入工厂烟气,溶液的pH与ORP值(氧化还原电位)随时间变化如图所示。

①写出NO与ClO
 反应的离子方程式:
反应的离子方程式:②烟气中含有少量SO2,能提高NO的脱除率,可能原因是
(3)TiO2光催化。主要是利用TiO2光催化剂在紫外线作用下产生的高活性自由基(·OH、·O
 )和h+(h+代表空位,空位有很强的得电子能力),将烟气中的SO2、NO等氧化除去。TiO2光催化剂粒子表面产生·OH的机理如图所示(图中部分产物略去)。已知TiO2中电子跃迁的能量hv=3.2eV。
)和h+(h+代表空位,空位有很强的得电子能力),将烟气中的SO2、NO等氧化除去。TiO2光催化剂粒子表面产生·OH的机理如图所示(图中部分产物略去)。已知TiO2中电子跃迁的能量hv=3.2eV。
①TiO2光催化剂在紫外线作用下产生·OH的过程可描述为
②在TiO2中掺杂一定量的金属离子可提高光催化活性。对所掺杂金属离子的要求是
您最近一年使用:0次
2022-04-06更新
|
838次组卷
|
6卷引用:江苏省昆山六校2022~2023学年高三上学期10月联合教学质量调研化学试题
江苏省昆山六校2022~2023学年高三上学期10月联合教学质量调研化学试题江苏省连云港市2022届高三第二次调研考试化学试题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(江苏专用)(已下线)必刷卷02-2022年高考化学考前信息必刷卷(辽宁地区专用)(已下线)必刷卷05-2022年高考化学考前信息必刷卷(江苏专用)(已下线)黄金卷10-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)
解题方法
10 . 工业合成氨是20世纪的伟大成就之一,但化肥的过度使用、硝酸工业废气和机动车尾气的排放,给水体和大气带来了一定程度的污染,需要进行综合处理。
Ⅰ.合成氨
(1)工业合成氨反应为: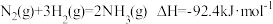 。下列说法正确的是_______。
。下列说法正确的是_______。
(2)一种电化学合成氨的原理如图所示。产生 的电极反应式是
的电极反应式是_______ 。

Ⅱ.含氮污染的处理
(3)水体中氨氮处理:在微生物作用下,废水中 经两步反应被氧化成
经两步反应被氧化成 :
:


则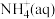 全部氧化成
全部氧化成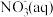 的热化学方程式是
的热化学方程式是_______ 。
(4)大气中NO处理:电解 溶液(调节起始
溶液(调节起始 约为9)获得
约为9)获得 溶液,可用于去除大气中NO。其他条件相同,电解所得溶液中相关成分的浓度与电流强度的关系如图所示。
溶液,可用于去除大气中NO。其他条件相同,电解所得溶液中相关成分的浓度与电流强度的关系如图所示。

①用电解所得 溶液氧化NO生成
溶液氧化NO生成 和
和 ,其离子方程式为
,其离子方程式为_______ 。
②电流强度大于4A,随着电流强度增大,电解所得溶液对NO去除率下降,其原因是_______ 。
Ⅰ.合成氨
(1)工业合成氨反应为:
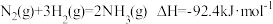 。下列说法正确的是_______。
。下列说法正确的是_______。| A.采用高温以提高反应的平衡转化率 |
B.采用高压以加快反应速率,提高 的产量 的产量 |
C.为提高 转化率,可适当增大 转化率,可适当增大 的浓度 的浓度 |
D.生产过程中将 液化分离,有利于氨的合成 液化分离,有利于氨的合成 |
 的电极反应式是
的电极反应式是
Ⅱ.含氮污染的处理
(3)水体中氨氮处理:在微生物作用下,废水中
 经两步反应被氧化成
经两步反应被氧化成 :
:

则
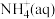 全部氧化成
全部氧化成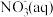 的热化学方程式是
的热化学方程式是(4)大气中NO处理:电解
 溶液(调节起始
溶液(调节起始 约为9)获得
约为9)获得 溶液,可用于去除大气中NO。其他条件相同,电解所得溶液中相关成分的浓度与电流强度的关系如图所示。
溶液,可用于去除大气中NO。其他条件相同,电解所得溶液中相关成分的浓度与电流强度的关系如图所示。
①用电解所得
 溶液氧化NO生成
溶液氧化NO生成 和
和 ,其离子方程式为
,其离子方程式为②电流强度大于4A,随着电流强度增大,电解所得溶液对NO去除率下降,其原因是
您最近一年使用:0次



